利用类病毒脂质体抗原检测H5N1亚型禽流感病毒抗体ELISA方法的建立
杨 倩,朱道中,薛春宜,李晓明,曹永长*,段燕喻,王 莹,吴晓薇,刘志玲
(1.中山大学生命科学学院有害生物控制与资源利用国家重点实验室,广东广州 510006;2.广东出入境检验检疫局检验检疫技术中心,广东广州 510623;3.中国疾病预防控制中心病毒病预防控制所,北京 102206)
禽流感(Avian influenza,AI)是由正黏病毒科A型流感病毒属的流感病毒引起的一种禽类重要传染性疫病。该病于1878年首次报道于意大利,自从1959年高致病性AI首次报道以来,全世界共暴发了32次,每次都给养禽业造成了巨大损失,其中较为受关注的有1959年英格兰H5N1亚型AI、1994年墨西哥AI、1997年香港AI、2004年亚洲 H5N1亚型AI及2013年倍受关注的H7N9亚型AI事件[1]。该病影响范围大,对人、畜、禽的健康均构成了极大的威胁。目前根据禽流感病毒(Avian influenza virus,AIV)致病性的不同,可分为高致病性AIV、低致病性AIV和非致病性AIV 3大类。迄今为止,高致病性AI基本是由H5亚型或H7亚型AIV引发的[2]。为了有效地防控AI,国内外政府与学者给予了该病极大的关注。
AIV的一个重要的结构蛋白血凝素(HA)是大小为75ku的糖蛋白,具有凝集部分动物红细胞的功能,是主要的表面抗原。基质蛋白(M)包括2个蛋白M1和M2,其中M1蛋白是病毒颗粒的主要组分,与病毒的组装和出芽相关[3]。病毒样颗粒(virus-like particles,VLP)是含有特定病毒的一个或多个结构蛋白的空心颗粒,内部不含病毒核酸物质,在形态结构和大小上与真实的病毒粒子类似,具有与完整病毒类似的免疫原性和免疫反应性[4]。流感病毒的结构蛋白可以相互作用,形成流感VLP。本研究的VLP是利用流感病毒HA和M1两个结构蛋白形成的。
对于流感病毒VLP的应用主要在疫苗研制领域和免疫测定领域。在疫苗研制方面,因为VLP疫苗既避免了病毒的感染性,又具有疫苗的有效预防的可能性,因此较为理想。现已报道的有H1N1、H3N2、H5N1、H7N1、H5N3及 H9N2亚型流感病毒VLP,动物试验证明这些流感病毒VLP可诱导产生保护性免疫应答反应。现阶段研究表明,流感病毒VLP疫苗可诱导产生较高的免疫效价,并且可诱导产生交叉免疫反应,同时不含核酸安全性较高。但目前研究大多停留在动物试验和临床前试验的阶段。现在VLP在免疫测定中也有了一定得应用,主要包括在抗体检测的应用和抗原检测的应用。
传统意义上的脂质体亦称类脂小球,它是由磷脂双分子定向排列而成的,其直径约为几微米至几毫米,是人工制备的颗粒,其组成包括不溶性的极性的磷脂质和胆固醇等附加剂。由于其制备简单、安全性高、靶向性高、无免疫原性反应等受到人们的广泛重视。利用重组杆状病毒感染宿主细胞,病毒大量出芽后,会导致宿主细胞的细胞膜破裂,破碎的细胞因疏水作用而形成“球状”,将其称为类病毒脂质体。现在关于类病毒脂质体的研究还停留在初期阶段,因此希望进行更加深入的研究。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞和培养基 重组的 A/Harbin/Re-1/2003(H5N1Re-1)灭活禽流感病毒由哈尔滨兽医研究所赠送,含有 A/goose/Guangdong/1/96(H5N1)的HA和NA片段,其他6个片段来自A/Puerto Rico/8/1934(H1N1)。
pFastBacDual-HA和pFastBacDual-HA-M1质粒和Sf9细胞由中山大学生命科学学院有害生物控制与资源利用国家重点实验室构建和保存;Grace培养基为Invitrogen公司产品;Sf-900ⅡSFM 为GIBCO公司产品。
1.1.2 ELISA所用试剂和器材 包被缓冲液,洗涤缓冲液,封闭液,稀释缓冲液,底物缓冲液,显色缓冲液,终止液;96孔平底聚苯乙烯酶标板为Greiner公司产品。
1.2 方法
1.2.1 重组杆状病毒的构建 将pFastBacDual-HA和pFastBacDual-HA-M1转化大肠埃希菌DH10β感受态细胞,进行转座反应,然后经蓝斑筛选和抗生素筛选,获得相应质粒并利用PCR技术对转座质粒(rBacmid)进行鉴定。参考Invitrogen公司Bac-To-Bac表达系统技术手册,将质粒(rBacmid-HA、rBacmid-HA-M1)和 Cellfectin®Ⅱ Reagent脂质体混合,接种于对数生长期的Sf9细胞,然后置于28℃培养5h后,弃去原混合物并用新鲜的培养基洗涤2次,然后加入Grace完全培养基,28℃继续培养72h,收获培养基和细胞,上清即为P1代重组病毒,4℃保存备用。用P1重组病毒感染Sf9细胞进行扩大培养,蚀斑鉴定种毒滴度,于-80℃保存备用。
1.2.2 H5N1亚型 AIV VLP的制备、纯化和鉴定 将纯化后的重组杆状病毒rBacmid-HA-M1以5mol感染昆虫细胞。28℃,培养72h后,收获上清。10 000r/min、4℃离心30min,收集上清液,然后将上清液,40 000r/min、4℃离心2h,收集沉淀用PBS重悬。将PBS重悬液上样于200g/L~600g/L梯度蔗糖液面上,27 000r/min、4 ℃离心2h,吸取病毒条带,然后40 000r/min、4℃离心1h脱糖,用适量PBS重悬沉淀。通过血凝试验检测获得的纯化的AIV VLP的血凝活性,通过透射电镜观察形态,鉴定是否与真实流感病毒颗粒具有相似的构象。
1.2.3 H5N1亚型AIV类病毒脂质体的制备和鉴定 将纯化后的重组杆状病毒rBacmid-HA-M1以5mol感染昆虫细胞,28℃培养72h后,收获细胞。将细胞用PBS洗涤3次,离心后取沉淀。将沉淀用200μL预冷的PBS重悬,反复冻融3次后在冰水浴中采用超声波破碎30min,然后静置10min,最后3 000r/min离心5min,取上清进行鉴定。鉴定方法同VLP。
1.2.4 H5N1亚型AIV HA蛋白的制备和鉴定将纯化后的重组杆状病毒rBacmid-HA以MOI为5感染昆虫细胞,28℃,培养72h后,收获细胞。将细胞用PBS洗涤3次,离心后取沉淀。向沉淀加入200μL细胞裂解液,混匀,然后在冰上静置30min,3 000r/min离心5min,取上清。通过SDS-PAGE和血凝试验进行鉴定。
1.2.5 最适抗原包被浓度和对照血清最佳稀释度的确定 以单独表达的HA蛋白、类病毒脂质体、VLP分别作为抗原进行包被。采用方阵试验确定最适抗原包被浓度和血清最佳稀释度。抗原用包被液进行稀释,每100μL含抗原量分别为10、20、30、40、50、60、70、80、90、100、110、120ng,然后分别加入酶标板内,100μL/孔,4℃包被过夜;洗涤后用封闭液37℃封闭1h;再次洗涤后,将阴、阳性血清用稀释液分别作1∶10、1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400稀释,加入相应的孔内,100μL/孔,同时设空白对照,37℃温育1h;用洗涤液洗涤3次,然后加入驴抗鸡IgG-HRP(1∶5 000稀释),100μL/孔,37 ℃温育1h;再次洗涤后加显色液,100L/孔,37℃温育10min,2mol/L H2SO4终止,50μL/孔,将酶标板置于450nm处读取OD值。取阳性血清孔的OD值接近1.0,阴性血清孔OD值小于0.2,P/N最大的血清稀释度作为抗原及血清的最适工作浓度。
1.2.6 间接ELISA临界值的判定 间接ELISA方法的判定标准:取3种抗原样品进行ELISA检测。当(样品OD450nm值-空白对照OD450nm值)/(阴性对照OD450nm值-空白对照OD450nm值)≥2.1时为阳性[5]。
1.2.7 特异性试验 采用试验建立的间接ELISA方法,分别用VLP、类病毒脂质体、HA蛋白和灭活的H5N1亚型AIV作为抗原对H1N1亚型流感病毒阳性血清、H3N2亚型流感病毒阳性血清、H9N2亚型流感病毒阳性血清、新城疫阳性血清以及H5N1亚型AIV阳性血清和阴性血清进行检测,比较检测结果。
1.2.8 敏感性试验 取3份H5N1亚型AIV阳性血清,进行系列稀释后,分别采用VLP、类病毒脂质体、HA蛋白和灭活的H5N1亚型AIV作为抗原进行检测,记录各阳性血清在不同方法的检测终点(阳性反应最高稀释度),比较对同一组样品的检测灵敏度(最高稀释度)。
1.2.9 重复性试验 取H5N1亚型AIV阳性血清和阴性血清各1份,用3个不同时间制备的VLP、类病毒脂质体、HA蛋白作为抗原进行3次检测,分别计算批内和批间的变异系数。
1.2.10 保存稳定性试验 将包被用的抗原冻干成粉末,分别取置于37℃前、置37℃后4d和8d的样品,按相同方法检测同一份阳性和阴性血清,比较前后3个时间的检测结果。
1.2.11 临床样品检测 用本试验建立的间接ELISA方法对100份疑似H5N1亚型AIV阳性的血清进行检测。
1.2.12 血凝抑制试验 分别用VLP、类病毒脂质体和灭活H5N1亚型AIV制备4单位抗原。参照《禽流感检疫技术规范》(SN/T1182—2010)[6]中的血凝抑制试验方法对30份阳性血清及1份SPF鸡阴性血清分别进行HI抗体检测,比较不同抗原所测得的HI抗体效价。
2 结果
2.1 抗原的鉴定
2.1.1 血凝试验
2.1.1.1 VLP的血凝试验 血凝试验结果表明,10μg纯化的VLP的HA效价为256,具有很强的凝集鸡红细胞的能力,说明HA组装入VLP-HAM1以后,仍然保持血凝活性和正确的空间构象。
2.1.1.2 类病毒脂质体的血凝试验 血凝试验结果表明,10μg类病毒脂质体的HA效价为256,具有很强的凝集鸡红细胞的能力,说明禽流感病毒类病毒脂质体有较高的血凝活性。
2.1.2 电镜观察
2.1.2.1 透射电镜观察病毒样颗粒的形态 从图1可以看出,表达的HA和M1形成的VLP直径80nm~120nm,有明显的刺突结构(HA蛋白),与流感病毒粒子相似。
图1 H5N1AIV VLP电镜观察结果Fig.1 Observation of influenza H5N1AIV VLP by electron microscopy
2.1.2.2 透射电镜观察类病毒脂质体的形态 从图2可以看出,形成的类病毒脂质体直径约为20nm~30nm,呈球状。

图2 H5N1AIV类病毒脂质体电镜观察结果Fig.2 Observation of influenza H5N1AIV virus-like liposomes by electron microscopy
2.1.3 重组HA的SDS-PAGE鉴定 HA基因大小为1 760bp,编码一条由568个氨基酸组成的蛋白,分子质量约为70ku。重组杆状病毒rBacmid-HA感染Sf9细胞72h后,收获细胞,用预冷的PBS洗涤后裂解,离心后取上清进行SDS-PAGE检测,可以检测到表达的HA(图3)。

图3 HA蛋白SDS-PAGE检测Fig.3 SDS-PAGE analysis of recombinant HA protein expression
2.2 抗原最佳包被浓度与对照血清最佳稀释度的确定
通过方阵试验确定抗原最佳包被浓度为100ng/孔,H5N1亚型AIV血清最佳工作浓度为1∶500,二抗最佳稀释度为1∶5 000。
2.3 间接ELISA临界值的判定结果
通过随机取抗原样品进行ELISA检测,结果显示,阴性对照于450nm下的OD值的平均值为0.120,空白对照的OD值的平均值为0.047。
2.4 特异性试验
采用VLP、类病毒脂质体、HA蛋白和灭活H5N1亚型AIV分别作为抗原对H1N1、H3N2、H9N2亚型流感病毒阳性血清、新城疫阳性血清及H5N1亚型AIV阴性血清检测结果均为阴性,对H5N1亚型AIV标准阳性血清检测结果为阳性。但是VLP作为抗原对H1N1亚型流感病毒阳性血清、H3N2亚型流感病毒阳性血清、H9N2亚型流感病毒阳性血清均为阳性,故无法区分不同亚型的流感病毒。结果如表1。

表1 不同抗原的特异性试验结果Table 1 The results of specificity test with different antigens
2.5 敏感性试验
分别以HA蛋白、VLP、类病毒脂质体和灭活的H5N1亚型AIV作为抗原,检测3份不同稀释度的H5N1亚型AIV阳性血清,结果表明HA重组蛋白的敏感性稍低于其他3种物质作为抗原的敏感性,结果如表2。
表2 四种抗原的敏感性试验结果Table 2 The results of sensitivity test with four kinds of antigens
2.6 重复性试验
以3个不同时间制备的VLP、类病毒脂质体、HA蛋白作为抗原进行3次检测,获得的批内和批间系数均小于10%,结果表明用3种抗原建立的检测方法重复性均较好(表3和表4)。

表3 批内变异系数Table 3 The results of variation co-efficient within batch

表4 批间变异系数Table 4 The results of variation co-efficient between batchs
2.7 稳定性试验
比较前后3次检测结果,结果表明无显著差异(只列出其中一组数据)。按37℃放置1d相当于4℃放置1.6个月计算[5],该试剂盒在4℃下至少可以稳定保存1年。结果如表5。
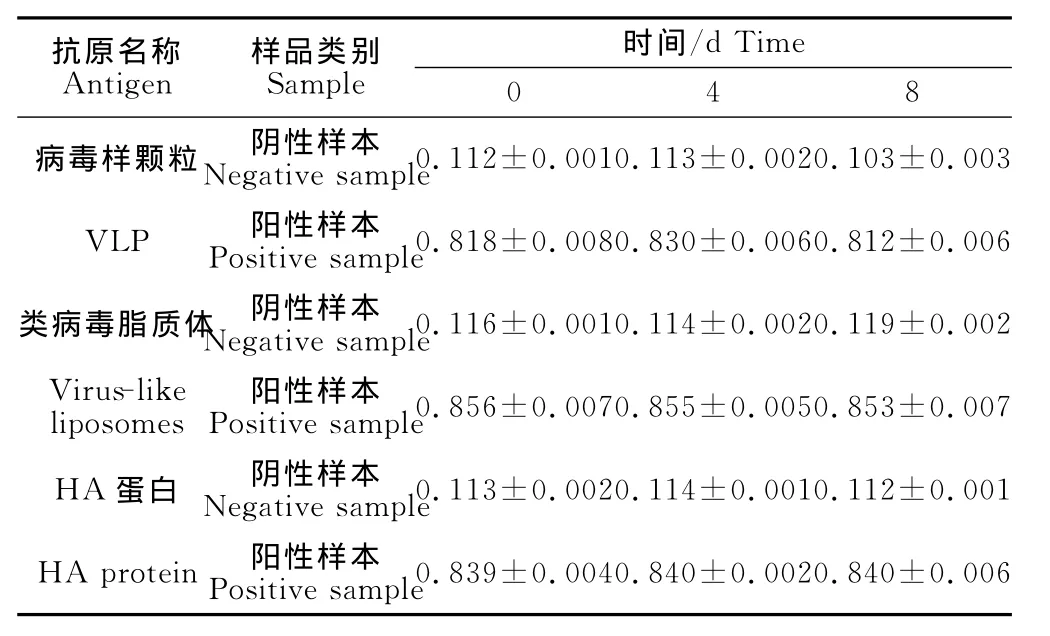
表5 稳定性试验结果Table 5 The results of stability tests
2.8 临床样品检测
利用本试验建立的间接ELISA方法对100份疑似H5N1亚型AIV阳性血清进行检测。用类病毒脂质体、HA蛋白和用灭活的H5N1亚型AIV作为抗原的方法,阳性检出率均为100%,而以VLP为抗原的方法阳性检出率为98%。
2.9 血凝抑制试验
分别采用VLP、类病毒脂质体和灭活的H5N1亚型AIV抗原对30份阳性血清及1份SPF鸡阴性血清进行HI抗体滴度检测,结果同一血清样品用类病毒脂质体作为抗原和用灭活的H5N1亚型AIV作为抗原测定的抗体效价相差不超过1个滴度,同一血清样品用VLP作为抗原和用灭活的H5N1亚型AIV作为抗原测定的抗体效价相差不超过2个滴度。总体而言,类脂质体与VLP相比较,具有更好的抗原性,更接近于灭活的H5N1亚型AIV,结果如表6。

表6 鸡血清中HI滴度检测结果Table 6 The detection results of HI titer in chicken sera
3 讨论
通过一系列验证性试验,结果表明制备的3种物质中类病毒脂质体与灭活全病毒一样,具有较好的免疫原性,但比灭活全病毒更安全,因此在抗体检测方面具有更好的应用前景。
目前,针对VLP的研究主要集中在疫苗的开发,有些VLP疫苗已经成功应用于临床,如人乳头瘤病毒(Human papilloma virus,HPV)四价VLP疫苗已经获得批准并投放到市场[7];乙型肝炎病毒(Hepatitis B virus,HBV)的 VLP预防性疫苗也研制成功并获准投放到市场中[8]。除此以外,鸡传染性囊病病毒(Infectious bursal disease virus,IBDV)、新城疫病毒(Newcastle disease virus,NDV)、引起重症急性呼吸综合征(Severe acute respiratory syndrome,SARS)的冠状病毒等VLP的疫苗都有较为深入的研究与开发[9]。同时,国内外学者针对禽流感也建立了一系列检测方法,包括血凝抑制试验、ELISA、RT-PCR、荧光RT-PCR、环介导等温扩增技术等[10-11],但针对禽流感病毒抗体的检测均采用的是灭活的AIV作为检测抗原。
本研究分别制备了AIV VLP、类病毒脂质体和HA蛋白,尤其是VLP和类病毒脂质体均不含有病毒核酸,在形态上与真实的病毒相似,从而希望利用其特点在疫苗领域及检测领域充分发挥其抗原抗体免疫反应的作用[12-13]。通过采用上述3种抗原物质分别包被酶标板,建立了相应的H5N1亚型AIV抗体ELISA检测方法。特异性试验、敏感性试验、重复性试验和稳定性试验结果表明,类病毒脂质体相对于VLP和HA蛋白而言,在检测方面具有更为良好的表现,而VLP在特异性反应中所表现的结果并不理想,原因可能是因为M1蛋白较为保守,干扰了对流感病毒不同亚型的区别,类病毒脂质体由于只有HA蛋白的存在,因此能较好的体现其型特异性。此外,类病毒脂质体由于在形态上类似于真实的病毒,故在敏感性方面优于用传统方法处理的单独表达的HA蛋白。综上所述,本研究以类病毒脂质体为基础,成功地建立了一种检测H5N1亚型AIV的ELISA方法,提示类病毒脂质体在免疫检测领域内具有良好的应用前景,尤其是在重大人畜共患病免疫检测方法研究中具有安全优势。
[1]Gao R,Cao B,Hu Y,et al.Human infection with a novel avian-origin influenza A (H7N9)virus[J].N Engl J Med,2013,368(20):1888-1897.
[2]Obenauer J C,Denson J,Mehta P K,et al.Large-scale sequence analysis of avian influenza isolates[J].Science,2006,311(5767):1576-1580.
[3]Fournier G,Chiang C,Munier S,et al.Recruitment of RED-SMU1complex by influenza a virus RNA polymerase to control viral mRNA splicing[J].PLoS Pathog,2014,10(6):1-16.
[4]Kim H J,Jin Y,Kim H J.The concentration of carbon source in the medium affects the quality of virus-like particles of human papillomavirus type 16produced in saccharomyces cerevisiae[J].PLoS One,2014,9(4):1-7.
[5]白 玲,张志刚,刘永明.合成肽抗原抗精子抗体ELISA试剂盒的研究[J].广西医科大学学报,2004,21(4):497-499.
[6]SN/T1182-2010.禽流感检疫技术规范[S].
[7]Keim B.Controversy over cervical cancer vaccine spurs safety surveillance[J].Nat Med,2007,13(4):392-393.
[8]Wheeler C M,Bautista O M,Tomassini J E,et al.Safety and immunogenicity of co-administered quadrivalent human papilloma virus(HPV)-6/11/16/18L1virus-like particle(VLP)and hepatitis B (HBV)vaccines[J].Vaccine,2008,26(5):686-696.
[9]宋丽丽,毕玉或,甘书钻,等.冠状病毒颗粒样疫苗研究进展[J].动物医学进展,2014,35(4):102-106.
[10]彭 宜,谢芝勋,刘加波,等.禽流感病毒RT-LAMP检测技术的建立[J].动物医学进展,2012,33(12):43-46.
[11]卢体康,秦智锋,陈 兵,等.H7亚型禽流感病毒实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2012,33(3):9-13.
[12]曹德康,昊利群,国 文.流感疫苗接种人群抗体水平监测分析[J].国际流行病学传染病学,2012,39(5):323-326.
[13]Xiang J,WUnschmann S,George S L,et al.Recombinant hepatitis C virus-like particles expressed by baculovirus:utility in cell-binding and antibody detection assays[J].Med Virol,2002,68(4):537-543.

