猪流行性腹泻病毒灭活疫苗的制备及攻毒保护研究
徐宏军,杨鹏程,任 丽,胡来根,何孔旺,刘文倩,代洪波
(1.成都天邦生物制品有限公司,四川成都610100;2.江苏省农业科学院兽医研究所,江苏南京210014)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种猪的急性肠道传染病。该病于1971年在英国首次被报道,不久相继在欧洲各国开始流行。其在亚洲流行情况较欧洲更为严重,并呈现出哺乳仔猪高发病率、高致死率的特点[1]。我国于1976年首次报道该病,到2000年,该病已经在全国范围内流行。特别是从2010年起,该病在我国的免疫猪群中再度流行,给我国的养猪业带来了极大的危害[2-3]。新毒株的出现导致对目前CV777株疫苗毒免疫效力的质疑,然而目前没有更为合适的新的疫苗毒株出现,如何提高现有灭活疫苗保护力就成为防控PED 的研究热点。本试验旨在通过使用细胞悬浮培养工艺制备高效价PED 灭活疫苗(CV777株),与普通转瓶培养生产的PED 灭活疫苗(CV777株)及组织灭活苗进行动物攻毒保护对比试验,探索提高疫苗中的抗原含量是否能够有效提高PEDV 疫苗的保护力。
1 材料与方法
1.1 材料
1.1.1 主要试剂 T4DNA ligase、10×buffer for T4DNA ligase、pMD19-T simple vecter为宝生物工程(大连)有限公司产品;2×Taq PCR Master Mix、ddH2O、DNA Marker DL 2 000、琼脂糖凝胶DNA 纯化回收试剂盒、质粒抽提试剂盒、病毒RNA提取试剂盒、一步法RT-PCR 试剂盒为天根生物有限公司产品;DMEM 细胞培养液、新生牛血清为Gibco公司产品。
1.1.2 细胞与毒株 DH5α菌种由本实验室保存。Vero E6细胞、猪流行性腹泻疫苗毒(CV777株)由哈尔滨兽医研究所提供;猪流行性腹泻病毒流行株(JS12株)由江苏省农科院兽医研究所惠赠。猪流行性腹泻组织灭活苗由江苏省农科院兽医研究所惠赠。
1.1.3 试验用动物 猪流行腹泻抗原、抗体阴性妊娠母猪,为四川眉山散养农户饲养。
1.2 方法
1.2.1 PEDV 疫苗毒(CV777株)生物信息学分析
根据GenBank中公布的PEDV S基因主要中和位点序列(S基因1 495位~1 914位核苷酸),设计合成PEDV S 基 因 扩 增 引 物 如 下:P1:5′-TTCTGAGTCACGAACAGCCA-3′;P2:5′-CATATGCAGCCTGCTCTGAA-3′。目的片段为650bp 左右,引物由宝生物工程(大连)有限公司合成。以天根生物病毒RNA 提取试剂盒,分别提取PEDV 疫苗株CV777株与流行毒株JS12株病毒RNA,以天根生物一步法RT-PCR 试剂盒方法进行CV777株与JS12株S基因扩增。分别回收RT-PCR 扩增产物,链接至pMD19-T simple vecter,转化DH5α感
受态细胞,筛选阳性克隆送上海英俊公司进行测序。将测序结果与GenBank上所提交的PEDV S基因核酸及氨基酸序列进行比对,以DNA Star进行遗传进化树分析。
1.2.2 PEDV 转瓶灭活疫苗的制备 以传统转瓶生产工艺在Vero E6细胞上对PEDV CV777株进行增殖,待80%以上细胞出现细胞病变时收获病毒液,进行半成品检验。检验合格后,病毒液用甲醛灭活后与60%氢氧化铝胶佐剂以2∶1 比例进行乳化,制备PEDV 转瓶灭活疫苗。按《中国人民共和国兽用生物制品质量标准》(2001年版)对疫苗进行各项检测。
1.2.3 PEDV 悬浮培养高价灭活疫苗的制备 使用悬浮培养工艺(专利号:ZL20101013700.5)培养Vero E6 细胞,待满球率大于90%时接毒进行PEDV CV777 株悬浮培养。接毒剂量为0.01 MOI,接毒后定期取样观察细胞病变情况,待细胞病变达80%以上时收获病毒液,进行半成品检验。检验合格后,病毒液用甲醛灭活后与60%氢氧化铝凝胶佐剂以2∶1 比例进行乳化,制备PEDV悬浮培养高价灭活疫苗,按《中国人民共和国兽用生物制品质量标准》(2001 年版)对疫苗进行各项检测。
1.2.4 动物试验
1.2.4.1 分组与免疫 在四川眉山某乡镇散养农户家中采集妊娠母猪血液送至成都天邦生物制品有限公司诊断中心,以PEDV 抗体检测试剂盒进行PEDV 抗 体 检 测,以PEDV 抗 原RT-PCR 检 测 方法[4]与韩国Anigen公司PEDV 抗原胶体金检测试剂盒同时进行PEDV 抗原检测。共筛选8 头PEDV 抗原、抗体阴性妊娠母猪,分4 组进行不同PEDV 疫苗的免疫,每组2头。产前30d,各试验组分别免疫对应疫苗(表1),免疫剂量为4mL/头;对照组每头注射4mL PBS。
1.2.4.2 攻毒保护试验 试验母猪产子后14d左右,每头母猪选取5头仔猪进行攻毒保护试验,攻毒之前仔猪均采用母乳饲养3d~5d,然后分组独立饲养。按表2,每头仔猪口服、肌肉注射PEDV 流行毒株(JS12 株)病毒液(107.0TCID50/mL)各1 mL。攻毒后连续观察6d,每3h观察一次,记录试验仔猪是否出现水样腹泻、呕吐等流行性腹泻症状,采集腹泻仔猪肛门拭子,送成都天邦生物制品有限公司诊断中心进行PEDV 抗原RT-PCR 检测[4]。
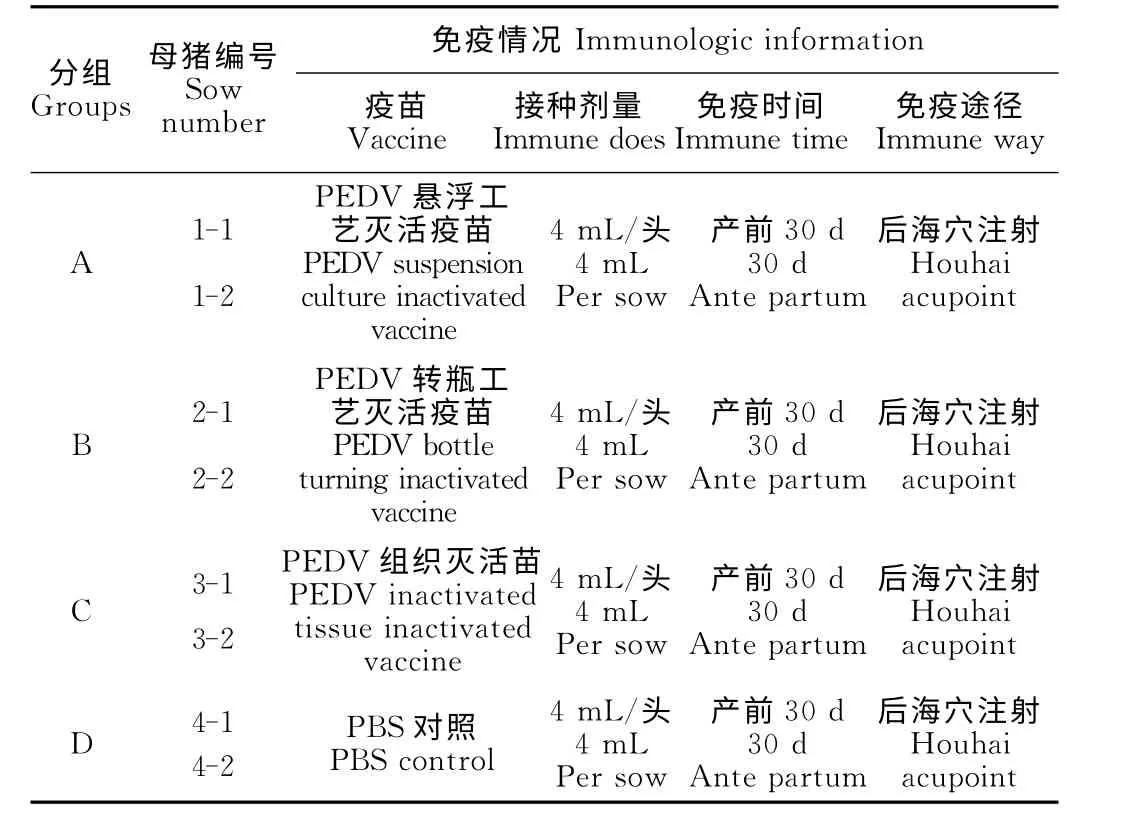
表1 试验母猪分组与免疫信息Table 1 The grouping and immune information of experimental sows

表2 仔猪攻毒保护试验分组Table 2 The grouping and challenge-protection experiment in piglets
2 结果
2.1 PEDV 疫苗毒(CV777)生物信息学分析
将成都天邦生物制品有限公司现用PEDV CV777疫苗毒株S 基因测序结果命名为GSCV777,PEDV JS12流行毒株S基因测序结果命名为GS-JS12。以DNA Star软件将JS12流行毒株、CV777疫苗毒株的S基因与GenBank上所提交的PEDV CV777株S基因序列,以及部分PEDV 流行毒株S基因序列进行核苷酸与氨基酸的序列比对,比对结果见图1、图2。成都天邦生物制品有限公司现用PEDV CV777 疫苗株S 基因核酸序列与CV777参考核酸序列相似性为99.7%,氨基酸序列同源性为99.5%,成都天邦生物制品有限公司现用CV777毒株在传代使用过程中S 基因未发生明显突变。PEDV CV777株S 基因与流行毒株的相似性在96.4%~99.7%之间,氨基酸序列相似性在96.7%~99.5%之间。
2.2 PEDV 转瓶灭活疫苗的制备
转瓶工艺培养PEDV 半成品效价为107.0TCID50/mL。与氢氧化铝佐剂2∶1乳化后制备成品疫苗,转瓶灭活疫苗成品抗原滴度计算值为106.82TCID50/mL。转瓶灭活疫苗无菌检验、外源病毒检验等各项质量检验符合相关标准。
2.3 PEDV 悬浮培养高价灭活疫苗的制备
悬浮工艺培养PEDV 半成品效价为108.5TCID50/mL。与氢氧化铝佐剂2∶1乳化后制备成品疫苗,转瓶灭活疫苗成品抗原滴度计算值为108.32TCID50/mL。转瓶灭活疫苗无菌检验、外源病毒检验等各项质量检验符合相关标准。

图1 PEDV S基因核苷酸序列比对结果Fig.1 Homology analysis of PEDV S gene nucleotide sequence
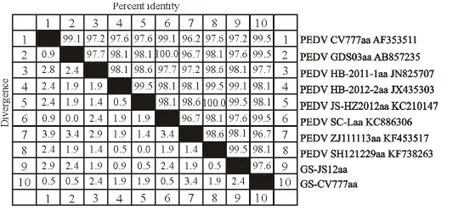
图2 PEDV S基因氨基酸序列比对结果Fig.2 Homology analysis of PEDV S gene amino acid sequence
2.4 动物试验结果
2.4.1 临床观察 母猪产前30d分别免疫不同工艺制备的PEDV 灭活疫苗,母猪产仔后14d左右进行仔猪PEDV 攻毒保护试验。攻毒后连续观察6d,A 组(悬浮工艺灭活疫苗)10头仔猪共有2头出现腹 泻 症 状,发 病 率20%(2/10),保 护 率80%(8/10);B组(转瓶工艺灭活疫苗)10头仔猪共有8头出现腹泻症状,发病率80%(8/10),保护率仅为20%(2/10);C组(组织灭活苗)10头仔猪有9头出现腹泻症状,发病率90%(9/10);D 组(对照)10头仔猪全部出现腹泻症状,发病率100%(10/10)。试验结果统计见表3。
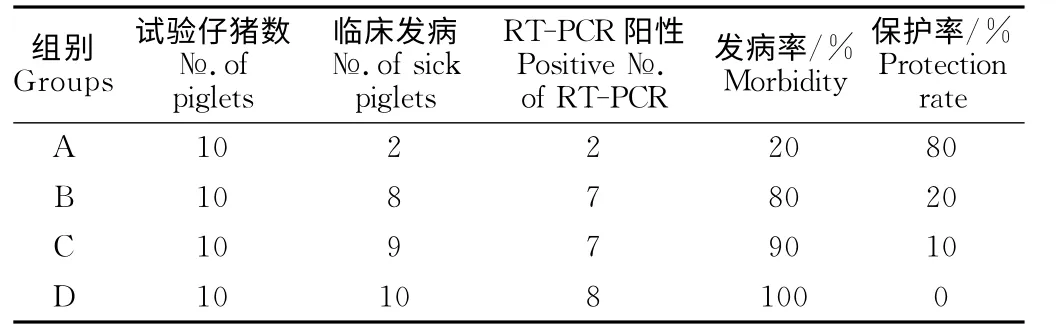
表3 攻毒保护试验结果Table 3 The test results of animal challenge protection
2.4.2 剖检大体病变观察 将发病仔猪在观察期结束后进行处死,仔猪均出现小肠鼓气,肠壁变薄,肠系淋巴结肿大出血等PED 剖检病变(图3)。
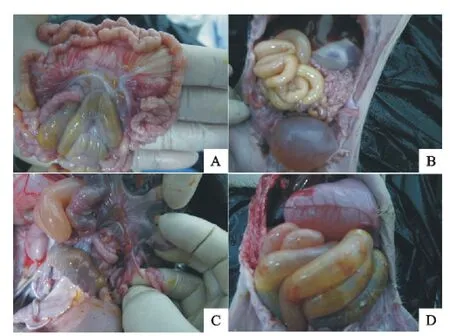
图3 病猪剖检病理变化Fig.3 The pathological lesions of sick piglets
2.4.3 RT-PCR 检测所采集腹泻猪肛拭子PEDV结果 采集试验仔猪的肛拭子,通过RT-PCR 进行PEDV 抗原检测,检测结果见表3。悬浮工艺灭活疫苗组共检出2头PEDV 抗原阳性,转瓶工艺灭活疫苗组共检出7头阳性,组织灭活苗组共检出7头阳性,对照组共检出8头阳性。结合临床症状进行保护率判定,母猪产前30d左右免疫接种1次,悬浮高价灭活疫苗保护率为80%(8/10);转瓶工艺灭活疫苗组保护率为20%(2/10);组织灭活苗组10%(1/10)保护;对照组全部发病,0/10保护。
3 讨论
近年来,PED 已成为危害养猪业重要的传染病之一,在秋冬春三季常呈现大面积暴发的态势。PEDV 虽只有一个血清型但毒株变异较大,在亚洲流行形势复杂。杨汉春[5]曾报道基于对北京、河北、山东、河南、浙江等地区12个发病猪场的临床症状和肠道组织样本的病原学检测结果表明,引起仔猪腹泻的主要病原是猪流行性腹泻病毒(PEDV),对毒株的全基因组序列测定表明,是一种新的毒株,其主要抗原表位基因S基因与我国邻国韩国的同源性最高,而与传统疫苗毒株CV777基因差异较大。毒株基因变异应该是造成免疫失败和仔猪死亡率高的主要原因。进一步分析发现分离毒株的全长基因序列和棘突蛋白(S)基因序列长度有差异,其他基因长度保守性强。S 基因的变异率高于其他基因,特别是短期内基因突变主要发生于S 基因。综合分析认为国内变异毒株虽与韩国毒株遗传关系较近,但从境内毒株衍生和进化而来的可能性更大[6]。
PEDV 分离难度大,细胞适应性差是目前疫苗毒株难以更换的主要原因。1988 年Hofmann M等[7]首次报道在细胞维持液中添加一定剂量的胰酶可以使PEDV 在Vero细胞上增殖,人们才开始能够在传代细胞上对PEDV 进行培养。虽然其后有很多人在进行PEDV 在传代细胞上培养的研究,相继 有 在IBRS-2、PK-15 细 胞 系 上 培 养 成 功 的 报道[8-9],但这仍是制约获得新的合适的疫苗毒株的主要因素。组织灭活苗在防治PED 的历史上发挥了重要的作用[10],但制备成本高,效价难以稳定,安全性差都是其不可避免的缺点。在本次试验中,我们可以观察到组织灭活苗在3个试验组中虽然毒株针对性最强,但保护率却最差(10%)。究其原因可能是使用小肠组织及内容物反复冻融后的上清溶液作为抗原,因为反复冻融并不能保证病毒的完全释放,因而很难保证疫苗中的抗原含量,从而导致最终的试验结果。所以,组织灭活疫苗已经逐渐被淘汰。
面对以上问题,如何能够在使用传统疫苗毒株CV777的条件下提高疫苗保护力成为目前PED 疫苗的主要研究重点。国内学者的主要观点是在疫苗中提高抗原含量能够在一定程度上增强疫苗保护力。2011年福建省农业科学院畜禽水产疾病诊疗中心[11]对福建省内184份顽固性腹泻病料进行检测,猪流行性腹泻感染96份,占52.2%。哺乳仔猪为主要感染对象,一旦感染发病率100%,病死率为80%~100%。同时研究人员还发现在只进行过一次传染性胃肠炎-流行性腹泻二联疫苗或三联疫苗免疫的规模化养殖场较进行过两次免疫的养殖发病情况更为严重。上述调查报告从侧面印证了学者的观点。为证实此种观点,我们设计了本次试验。在试验中,我们使用拥有专利技术的猪流行性腹泻病毒的生产方法(ZL 20101013700.5)进行PEDV(CV777株)灭活苗的抗原制备,使其在灭活前效价达到108.5TCID50/mL,是传统转瓶工艺生产工艺所制备的疫苗抗原配苗标准 (国家标准107.0TCID50/mL以上为合格)30倍。通过攻毒保护试验,可以明显看出通过提高抗原含量的方法能够有效提高疫苗保护力(悬浮培养苗保护率80%,普通转瓶苗保护率20%)。近年来,我国不断暴发猪流行性腹泻疾病,目前国内猪流行性腹泻的预防疫苗以转瓶工艺生产为主 (质控标准为107.0TCID50/mL),对PEDV 流行毒株的保护效果欠佳,导致用户对疫苗毒株免疫效果的质疑[12]。试验通过悬浮培养技术提高猪流行性腹泻病毒疫苗株抗原效价,能够给流行毒株提供有效保护,消除对现用疫苗毒株有效性的质疑,为今后PED 疫苗的研制与生产提供了新的方向。
[1] Barbara E S,Sylvie D A,William L M,et al.猪病学[M].赵德明,张中秋,沈建忠,等,译.8版.北京:中国农业大学出版社,2008.
[2] 杨丽梅,马 力,徐倩倩,等.我国猪病毒性腹泻的诊断与流行病学调查研究概况[J].动物医学进展,2014,35(2):115-119.
[3] 魏海芳,王鸿忠.青海省部分地区PEDV、TGEV 和RV 感染情况调查与分析[J].动物医学进展,2013,34(9):133-136.
[4] Ben Salem A N,Chupin Sergei A,Bjadovskaya Olga P,et al.Multiplex nested RT-PCR for the detection of porcine enteric viruses[J].J Virol Meth,2010,165(2):283-293.
[5] 杨汉春.我国新发猪病的流行现状[J].兽医导刊,2012(2):22-27.
[6] 董世娟,朱于敏,于瑞嵩,等.我国PEDV 分子流行病学研究进展[C]//中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集.北京:中国畜牧兽医学会,2013:96-101.
[7] Hofmann M,Wyler R.Propagation of the virus of porcine epidemic diarrhea in cell culture[J].J Clin Microbiol,1988,26:2235-2239.
[8] 钱永清,闻人楚,唐永兰,等.猪流行性腹泻病毒的分离培养鉴定[J].上海农业学报,1999,15(2):41-44.
[9] 古洪浪,邓胜朝,崔 进,等.猪流行性腹泻病毒PEDV-GD12株的分离鉴定[J].中国兽医杂志,2013,49(11):22-24.
[10] 王 凤,汤德元,李春燕,等.猪流行性腹泻病毒基因及其疫苗的研究[J].猪业科学,2010(12):42-47.
[11] 张世忠,江 斌.2011年福建省猪流行性腹泻的流行特点及其防治措施[J].福建畜牧兽医,2012,34(2):23-25.
[12] 赵梦姣,陈书民,成 岩,等.山东省部分地区猪流行性腹泻流行病学调查及其M 基因遗传变异分析[J].中国兽医学报,2013,33(10):1504-1508.

