γ干扰素释放试验在不同年龄活动性结核病患儿诊断中的应用价值
孙琳 田建岭 尹青琴 李洁琼 郭雅洁 綦辉 肖婧 徐放 焦伟伟 申晨 申阿东
·论著·
γ干扰素释放试验在不同年龄活动性结核病患儿诊断中的应用价值
孙琳 田建岭 尹青琴 李洁琼 郭雅洁 綦辉 肖婧 徐放 焦伟伟 申晨 申阿东
目的 评价γ干扰素释放试验(interferon gamma release assays,IGRAs)在不同年龄活动性结核病患儿诊断中的应用价值。方法 搜集2011年3月至2013年6月期间,我院临床诊断为活动性结核病的患儿205例、非结核呼吸系统感染患儿867例进行回顾性分析。根据年龄分为不同亚组(0~岁组136例,2~岁组323例,6~岁组312例,10~18岁组301例),分析IGRAs和结核菌素皮肤试验(tuberculin skin test, TST)在各亚组中的敏感度、特异度、一致性等。准确度以受试者特征工作曲线下面积(AUC)评价。结果 在总的研究对象中,IGRAs的敏感度(85.4%,175/205)与TST试验(81.5%,167/205)接近(χ2=1.128,P>0.05);在0~岁组患儿中,IGRAs的敏感度(80.0%,24/30)高于TST(53.3%,16/30)(χ2=0.03,P>0.05),但差异无统计学意义。在各年龄组中IGRAs的特异度均显著高于TST(0~岁,99.1% 和86.8%,χ2=12.125,P<0.01;2~岁,93.9% 和73.6%,χ2=41.603,P<0.01;6~岁,92.2%和77.0%,χ2=23.948,P<0.01; 10~18岁组,88.8%和65.6%,χ2=33.040,P<0.01)。0~岁组、2~岁组和10~18岁组中IGRAs检测的AUC(分别为0.895、0.882、0.893)均高于TST(分别为0.701、0.770、0.764)(P值均<0.05),6~岁组中IGRAs检测和TST的AUC差异无统计学意义,分别为0.895和0.838,P>0.05;Kappa值均小于0.40。4个年龄组间,IGRAs检测的AUC差异无统计学意义(P值均>0.05)。IGRAs试验结果总的不确定率为8.6%(101/1173),10~18岁组的不确定率显著低于其他年龄组(0~岁,2~岁,6~岁,10~18岁分别为10.5%,10.0%,8.0%,6.8%,χ2=859.9,P<0.01)。结论 IGRAs在各年龄阶段儿童具有较好的敏感度和特异度,在活动性结核病患儿的辅助诊断中均具有一定的应用价值。
干扰素γ释放试验; 结核/诊断; 儿童
结核病是当前威胁发展中国家儿童健康的重要原因之一。儿童结核病负担已经高达全球负担的10%~20%[1]。儿童作为高危人群,感染Mtb后容易进展为严重的活动性结核病。因此,早期对儿童结核病进行诊断并加以控制对于结核病的防控具有非常重要的意义。
目前,结核病的免疫学诊断方法主要包括结核菌素皮肤试验(tuberculin skin test, TST)和γ干扰素释放试验(interferon gamma release assays,IGRAs)。而IGRAs在儿童结核病辅助诊断中的研究较少,尤其是在5岁以下儿童中应用的数据更少。儿童作为一个快速发育的个体,机体抵抗外来病原体的防御能力在不同的年龄段存在显著差异。5岁以下儿童作为结核病的高风险人群,在感染Mtb的最初2年内,进展为重症结核病的概率高达20%~40%[2],因此,更加需要灵敏、准确的方法进行早期诊断。但不同研究者对年龄是否会影响IGRAs试验的诊断价值仍然存在争议[3-4]。本研究通过评价IGRAs和TST两种方法在不同年龄组儿童中的准确性,从而确定IGRAs在不同年龄段儿童结核病诊断中的辅助价值。
资料和方法
一、实验设计
本研究为基于医院的诊断研究,目的在于评价IGRAs和TST在临床实际应用中的价值。对IGRAs和TST两种方法敏感度的评价,分别在确诊活动性结核病患儿(Mtb培养阳性)和临床诊断的活动性结核病患儿中进行,特异度评价在呼吸系统感染性疾病患儿中进行。
二、研究对象
(一)纳入标准
纳入研究对象为2011年3月至2013年6月期间,因呼吸系统感染性疾病就诊于我院的患儿。根据临床最终诊断,分为活动性结核病组(简称“结核病组”)和呼吸系统感染性疾病组(简称“非结核病组”)。
确诊活动性结核病患儿:体液标本(痰液、支气管灌洗液、胃液、脑脊液、胸腔积液等)结核分枝杆菌培养阳性和(或)抗酸染色阳性;临床诊断的活动性结核病患儿[5-6]:同时具有:(1)存在疑似活动性结核病症状;(2)影像学检查提示活动性结核病存在;(3)抗结核治疗有效;(4)有明确的活动性结核病密切接触史。
呼吸系统感染性疾病组:(1)存在确切的其他病原体感染的证据,如病毒、支原体、肺炎链球菌等;(2)存在典型的呼吸系统感染性疾病症状;(3)常规抗炎治疗后病情好转或治愈;(4)经临床诊断为非结核的其他呼吸系统感染性疾病。
(二)排除标准
存在以下情况者不纳入本研究:(1)合并血液系统疾病者,如急性淋巴细胞白血病、中性粒细胞缺乏症、非霍奇金淋巴瘤等;(2)合并免疫系统疾病者,如免疫缺陷病;(3)使用免疫抑制剂者或糖皮质激素治疗>1周者;(4)未能同时行IGRAs和TST两种方法检测者;(5)IGRAs试验结果为临界值者;(6)临床资料不全者。
(三)研究对象纳入
2011年3月至2013年6月期间,共计2827例呼吸系统感染性疾病患儿行IGRAs或TST检测。根据纳入和排除标准,最终1173例患儿纳入研究,其中IGRAs试验结果不确定者有101例,因此,共计1072例患儿纳入准确性统计分析(纳入和排除流程图见图1)。根据最终临床诊断将其分为结核病组205例和非结核病组867例。患儿临床资料见表1。
结核病组中,肺结核62例(30.2%),肺结核合并肺外结核125例(61.0%),肺外结核18例(8.8%);非结核病组中,累及气管及肺部者721例(83.2%),同时累及气管、肺部和呼吸系统以外的其他部位者146例(16.8%),包括合并肝功能损伤43例,胸腔积液29例,心肌损伤19例,关节炎9例,上颌窦炎或鼻炎9例,脑膜炎8例,胃炎7例,肾炎7例,中耳炎5例,胸腔内占位4例,胸膜炎4例,血管炎2例。
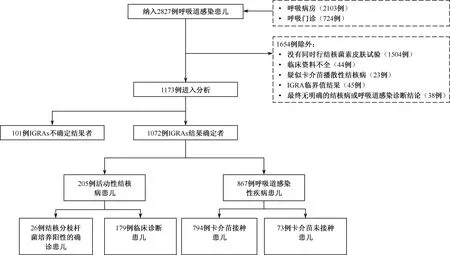
图1 研究对象纳入和排除流程
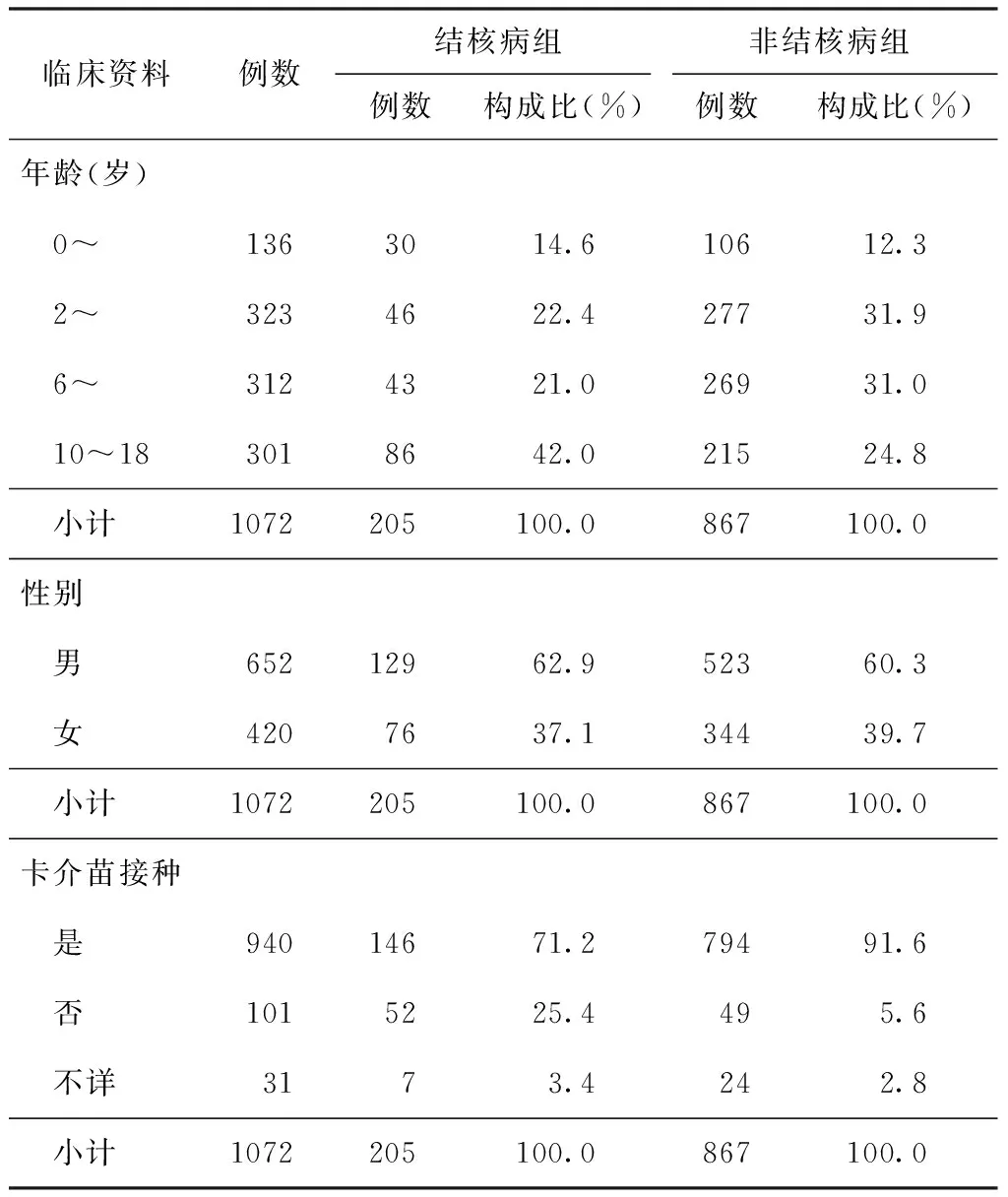
临床资料例数结核病组非结核病组例数构成比(%)例数构成比(%)年龄(岁) 0~1363014.610612.3 2~3234622.427731.9 6~3124321.026931.0 10~183018642.021524.8 小计1072205100.0867100.0性别 男65212962.952360.3 女4207637.134439.7 小计1072205100.0867100.0卡介苗接种 是94014671.279491.6 否1015225.4495.6 不详3173.4242.8 小计1072205100.0867100.0
结核病组中有26例(12.7%)为结核分枝杆菌培养阳性,培养阳性标本来源包括痰液4例、支气管灌洗液9例、胃液11例、胸腔积液1例、腹腔积液1例;12例(5.8%)为抗酸染色阳性的结核病患儿,阳性标本来源包括痰液2例、支气管灌洗液2例、胃液5例、病理活检3例。
(四)伦理学
本研究取得了我院伦理委员会的批准。
三、研究方法
1. TST:患儿于入院或者门诊就诊当天行TST,患儿前臂皮下注射0.1 ml(含5 IU的PPD),注射后48~72 h测量硬结平均直径(mm)。
TST阳性标准:无硬结或硬结平均直径<5 mm为阴性(-);5~9 mm为阳性(+);10~19 mm为中度阳性(++);≥20 mm为强阳性(+++);局部除硬结外还有水泡、破溃、淋巴管炎及双圈反应为极强阳性(++++)。
2.IGRAs:采集受试者外周静脉血2~4 ml,肝素抗凝,标本采集后室温放置,并于6 h内进行IGRAs。采用结核感染T细胞免疫斑点试验(T-SPOT.TB)试剂盒(英国Oxford Immunotec 公司生产)进行检测,具体操作及结果判断,按试剂盒说明书步骤进行。
IGRAs采用植物血凝素作为阳性对照抗原,用以评估受试者外周静脉血中T细胞的反应活性。
T-SPOT.TB结果判读:
(1)阳性判断标准:满足以下任一项即为阳性。①空白对照孔斑点数为0~5个,且“抗原A或抗原B孔斑点数-空白对照孔斑点数”≥6个;②空白对照孔斑点数为6~10个,且“抗原A或抗原B孔的斑点数为空白对照孔斑点数的2倍及以上”即判为阳性结果。
(2)阴性判断标准:阳性质控对照孔结果良好(斑点数≥20),但抗原A或抗原B孔斑点数均达不到阳性标准。
(3)不确定结果:阳性对照孔斑点数低于20个者。
(4)临界值结果:检测孔A或B斑点数在4~8之间。
四、统计学分析
分析参数包括敏感度、特异度、阳性预测值、阴性预测值、阳性似然比、阴性似然比、一致性等。IGRAs和TST敏感度和特异度比较采用McNemar检验,计数资料以百分比表示,以受试者工作特征(receiver operating characteristic, ROC)曲线评价诊断价值。两个试验的一致性采用一致性检验,用Kappa(K)值表示,K值>0.75表示一致性高,K值在0.40和0.75之间表示一致性中等,K值<0.40则表示一致性差。IGRAs试验结果不确定者,未进入准确性分析。采用SPSS 11.5软件进行统计学分析。
结 果
一、IGRAs和TST两种方法在各年龄组的准确性分析
1. 敏感度分析:在总的研究对象中,IGRAs的敏感度与TST接近,分别为85.4% (175/205)和81.5%(167/205),二者差异无统计学意义(P>0.05)。在0~岁组的活动性结核病患儿中,IGRAs的敏感度高于TST,分别为80.0% (24/30)和53.3%(16/30),但二者差异无统计学意义(P>0.05)。在其他年龄组中,两种方法的敏感度差异无统计学意义(P值均>0.05)(表2)。
在各年龄组间进行比较,IGRAs的敏感度差异无统计学意义(P>0.05);而TST在0~岁组的敏感度仅有53.3%,显著低于其他年龄组(P值均<0.01)。
在各年龄组中,IGRAs的阳性预测值和阳性似然比均高于TST;在0~岁组中,IGRAs的阴性预测值和阴性似然比均低于TST,在其他3个年龄组中数值接近(表2)。
在Mtb培养和抗酸染色阳性的38例结核病患儿中,36例IGRAs检测阳性,其敏感度为94.7%;28例为TST阳性,其敏感度为73.7%,二者差异有统计学意义(χ2=6.333,P<0.05)。其中26例Mtb培养阳性患儿IGRAs检测均为阳性(100.0%),12例抗酸染色阳性患儿中10例(83.3%)IGRAs检测阳性。在病原学阴性(Mtb培养和抗酸染色阴性)的167例结核病患儿中,IGRAs和TST的敏感度均为83.3%(χ2=0,P>0.05)。
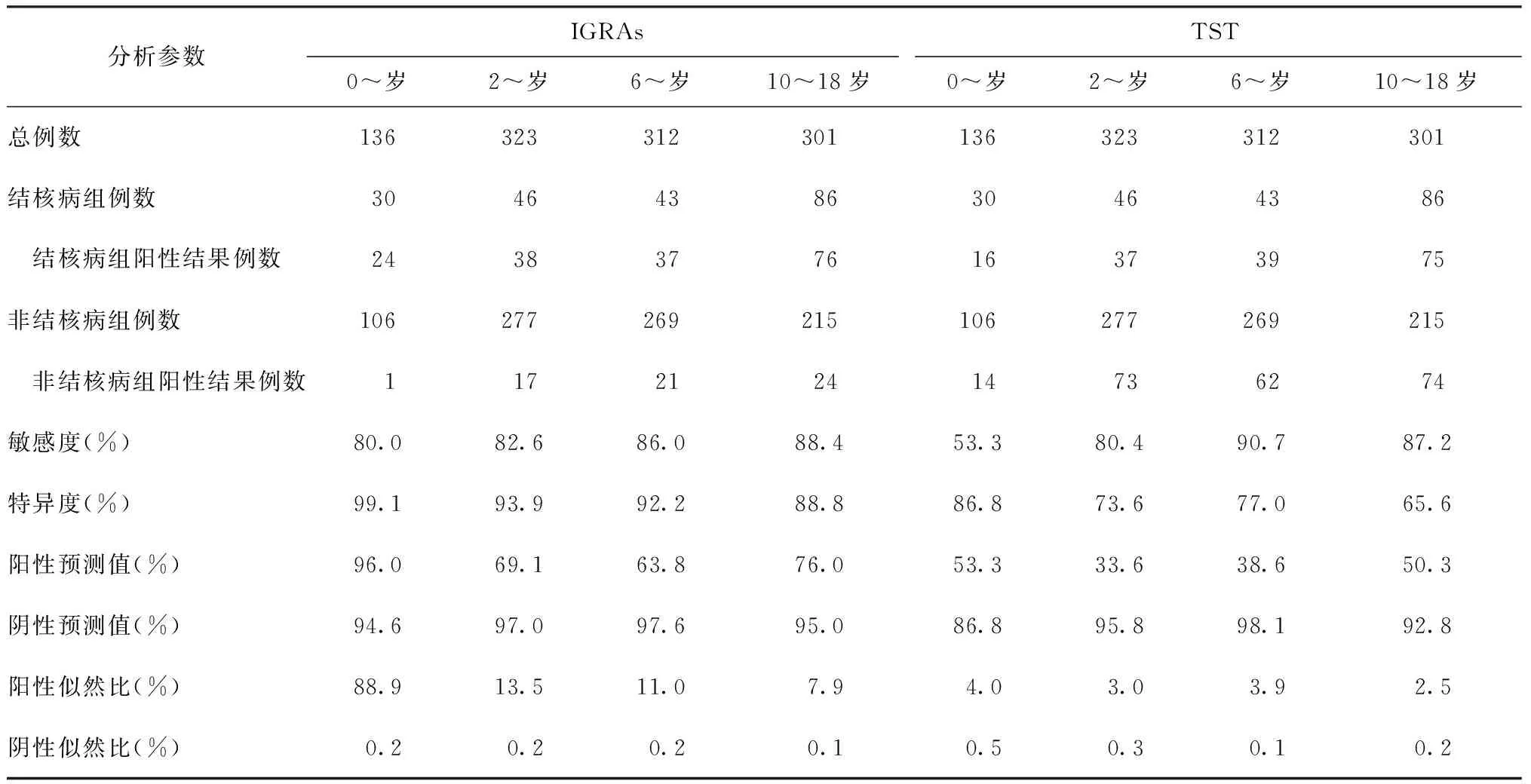
表2 不同分析参数在IGRAs和TST检测不同年龄组中的统计分析
注 在4个年龄组内,IGRAs与TST的敏感度比较,χ2值分别为4.800、0.072、0.453、0.054,P值均>0.05;在4个年龄组内,IGRAs和TST的特异度比较,χ2值分别为12.125、41.603、23.948、33.040,P值均<0.01
2. 特异度分析:IGRAs的特异度在各个年龄组均显著高于TST试验,P值均<0.01;随着年龄的增长,IGRAs和TST的特异度均逐渐降低,各年龄组间差异有统计学意义(P<0.01),见表2。
3. IGRAs和TST两种方法在各年龄组检测结果的ROC曲线下面积分析: ROC曲线下面积(AUC)显示,在各年龄组中, IGRAs的AUC均高于TST,(0~岁组,2~岁组,10~18岁组中,P值均<0.05;6~岁组中P>0.05)。而在各年龄组间进行比较,IGRAs的AUC在4个年龄间接近;6~岁组中,TST的AUC高于0~岁和10~18岁组(表3)。
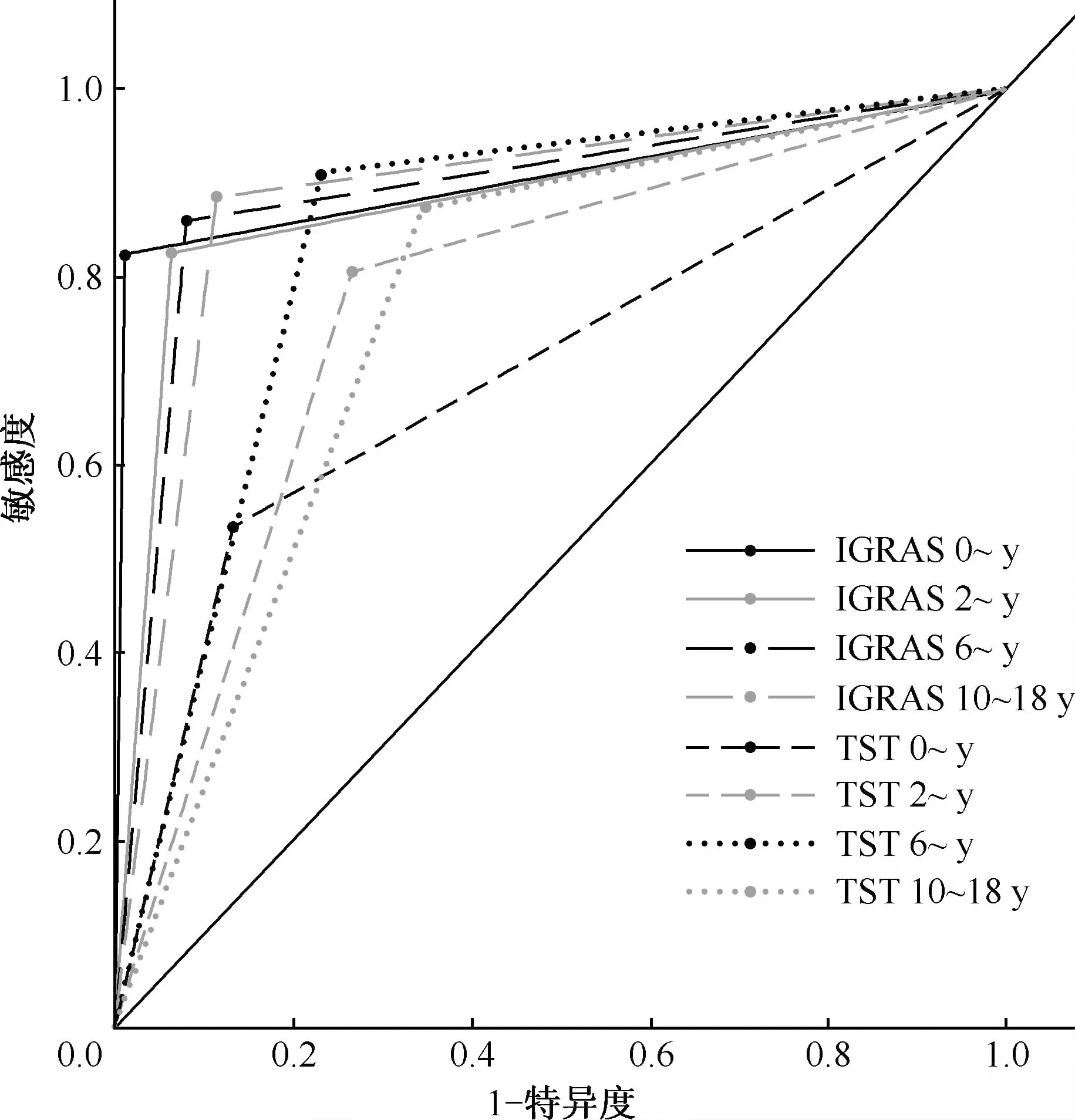
图2 IGRAs和TST的ROC曲线下面积
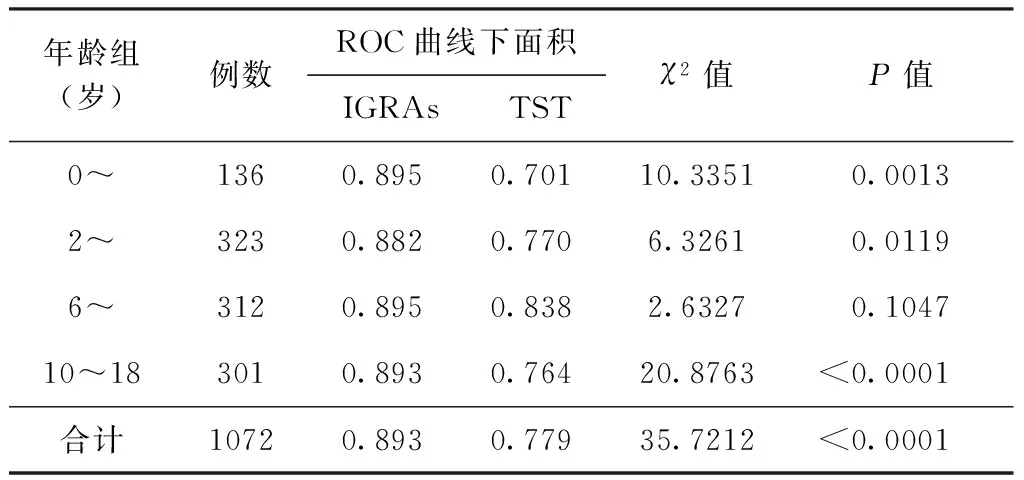
表3 IGRAs和TST在4个年龄组中及组间的ROC曲线下面积比较
二、IGRAs和TST两种方法检测结果在各年龄组的一致性分析
IGRAs和TST的一致性较差。在各年龄组间,K值均<0.40。在结核病组中,小年龄组的一致率最低,在0~岁组和2~岁组中两者一致率分别为53.3% (16/30)和67.4% (31/46)。IGRAs和TST检测结果不一致,以IGRAs检测阳性和TST检测阴性为主,在205例结核病患儿中,31例(15.1%)为IGRAs检测阳性而TST检测阴性;在0~岁组患儿中,该不一致结果比例高达36.7% (11/30)。
与之相反,在非结核病组中,IGRAs和TST一致率随年龄增长有降低趋势。在10~18岁组中一致率仅有74.0% (159/215)。IGRAs和TST检测结果不一致以IGRAs阴性和TST阳性为主,867例非结核病患儿中,TST阳性的患儿223例,而其中仅有54例(24.2%, 54/223)为IGRAs试验阳性(表4)。
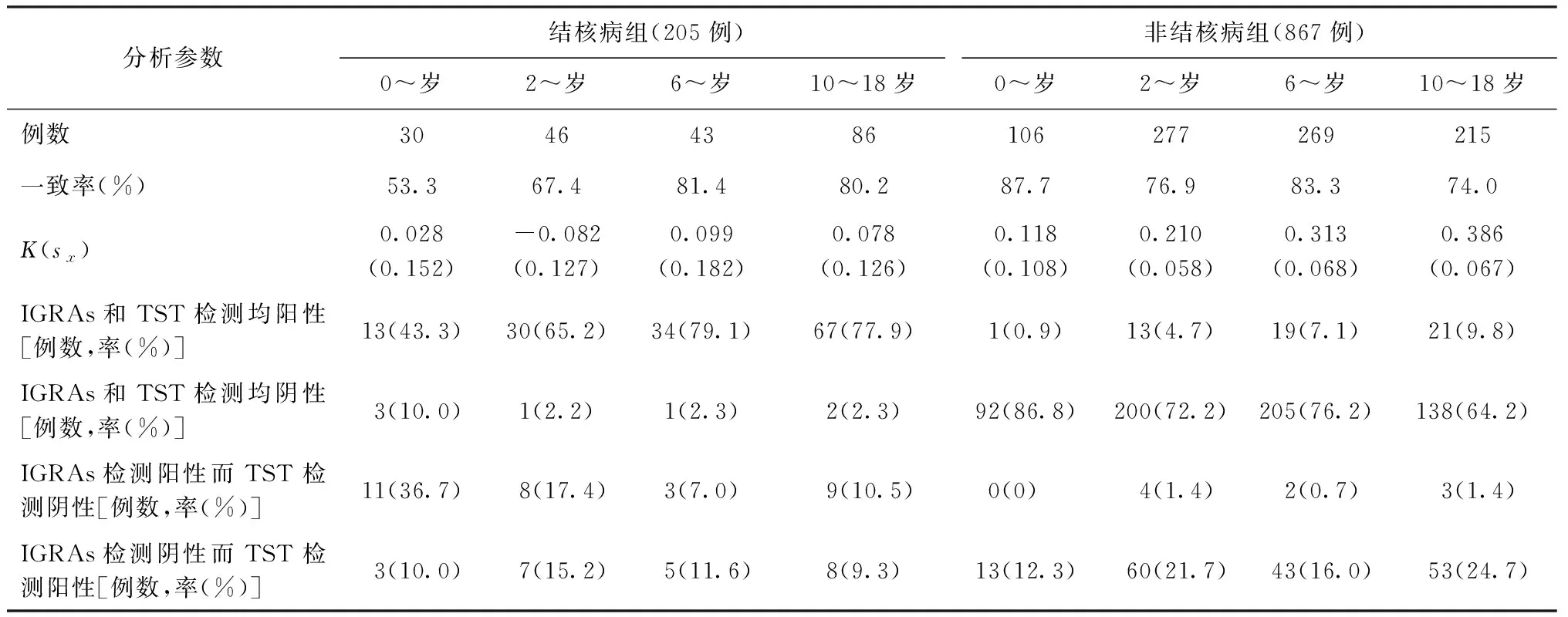
表4 不同分析参数在 IGRAs和TST检测结核与非病组中各年龄段的结果分析
注 一致率(%)=IGRAs和TST检测均阳性患儿的百分比+IGRAs和TST检测均阴性患儿的百分比
三、IGRAs检测在各年龄组中的不确定率
IGRAs检测不确定结果有101例,不确定率为8.6%(101/1173)。随着年龄增长,IGRAs不确定率逐渐降低,差异有统计学意义(0~岁组,10.5%;2~岁组,10.0%;6~岁组,8.0%; 10~18岁组,6.8%,χ2=859.9,P<0.01);其中10~18岁组的不确定率最低,显著低于其他年龄组(χ2值分别为405.2、553.0、562.8,P值均<0.01)。
101例患儿中6例(5.9%)为重症结核病、20例(19.8%)为重症支原体肺炎、4例(4.0%)为坏死性肺炎、3例(3.0%)为迁延性肺炎。
讨 论
由于儿童活动性结核病的临床症状多样,影像学特征不典型,病原学检查阳性率低,给疾病的早期诊断带来很大的困难和挑战,常常造成漏诊和误诊。因此,加强儿童活动性结核病的早期诊断极其重要。
儿童作为一个特殊的群体,其身体机能都处在不断成熟和完善过程中。因此,各年龄段儿童的免疫功能发育存在差别。IGRAs的原理基于检测机体内效应T细胞分泌的γ-干扰素。我院前期的研究数据也显示,不同年龄段儿童的T淋巴细胞亚群存在差异[7]。因此,本研究将年龄作为一个主要研究因素,分析IGRAs和TST在不同年龄阶段儿童中的诊断价值。
一、 IGRAs和TST两种方法在各年龄组的准确性分析
1. IGRAs和TST两种方法的敏感度及准确性分析:本研究结果显示,在活动性结核病患儿中,IGRAs检测的敏感度和AUC在各年龄组间差异无统计学意义。由此可见,IGRAs在儿童活动性结核病的辅助诊断中,在各年龄段均具有较好的准确性。在病原学确诊的结核病患儿中,IGRAs检测的敏感度显著高于TST。且IGRAs检测的阳性预测值和阳性似然比均高于TST,提示IGRAs试验是辅助诊断儿童结核病有效的指标。
在0~岁组儿童中,IGRAs试验的敏感度显著高于TST。在年龄越小的患儿中,IGRAs(+)和PPD(-)不一致结果比例越高,即TST的假阴性率、漏诊率越高。因此在小年龄组患儿中使用IGRAs可以弥补TST的假阴性结果的不足。
2. IGRAs和TST两种方法的特异度及准确性分析:IGRAs检测的特异度在各个年龄组均显著高于TST,在TST检测阳性的患儿中,仅24.2%为IGRAs检测阳性。提示IGRAs在呼吸系统感染患儿中,最大的临床应用价值在于可有效区分BCG和非结核分枝杆菌(NTM)病导致的PPD交叉反应还是Mtb感染的阳性结果。我国的BCG接种率较高,另外NTM的感染率也呈逐年上升趋势。已有一系列研究明确了上述两种因素对TST的影响。然而在进行潜伏结核感染筛查时,关于PPD阳性结果的判读,尚无可靠的标准来区分Mtb感染还是BCG接种或NTM感染所致。因此,临床医师往往根据TST硬结平均直径进行经验性判断:当硬结平均直径<10 mm时,考虑为BCG接种导致的交叉反应,而当硬结平均直径>15 mm时才考虑为结核分枝杆菌感染所致。然而有研究已经证明,TST的硬结平均直径并不是一个准确的诊断指标,大约50%受NTM感染的患儿其直径>15 mm[8]。因此,仅根据TST进行判断的话,会出现误诊的可能。另外,NTM感染的治疗与抗结核治疗方案也存在较大的差异。因此,当出现IGRAs检测阴性和PPD检测阳性结果时,应重点排除是否为BCG接种或NTM感染导致的PPD交叉反应。
在本研究中,IGRAs的特异度随年龄增长而逐渐降低,也从一定程度上反映了结核感染率随年龄增长的趋势。同时IGRAs阳性率随年龄增长的趋势与我国第四次全国结核病流行病学调查[9]数据一致。IGRAs检测的特异度与被检测人群的感染背景相关,即IGRAs检测结果阳性者很可能就是真正的潜伏结核感染者。被检测人群的Mtb感染率越高,IGRAs的特异度反而越低。虽然TST的特异度也随年龄的升高而显著降低,但其可能的原因除了Mtb感染率随年龄升高外,年长儿童感染NTM的风险也逐渐升高。因此,TST不能准确地反映被检测人群的Mtb感染率。已有研究表明,采用TST所得到的Mtb感染情况的调查结果可能过高地估计了我国Mtb感染的状况[10]。
二、各国关于IGRAs在儿童结核病诊断中的评价研究
关于IGRAs在儿童结核病诊断中的价值仍存在一些争议。第一,在确诊儿童结核病中其敏感度差别较大。有Meta分析结果表明,IGRAs在确诊结核病患儿中的敏感度可达80%,远高于临床诊断[11]。本研究结果IGRAs检测的敏感度为85.4%,与其结论一致。也有研究报道IGRAs在Mtb病原确诊儿童结核病中的敏感度仅为53%[12]。第二,关于年龄是否影响IGRAs检测的准确性也持有不同观点。Nicol等[4]研究结果显示,IGRAs在小年龄组儿童中的敏感度显著降低,而Critselis等[3]研究则提示通过IGRAs检测(采用QuantiFERON-TB Gold-In-Tube 试剂盒)小婴儿全血中的γ干扰素水平高于青少年,不受年龄影响。第三,IGRAs检测结果的不确定率在各研究中差别较大。文献报道IGRAs检测结果的不确定率的范围在0%~40%[13-15]。IGRAs检测结果不确定可能与低龄、免疫缺陷[16]、营养不良和寄生虫感染[17]等相关。本研究IGRAs检测的不确定率相对较高,其原因可能与纳入研究人群机体的免疫应答能力低有关。在本研究所纳入呼吸系统感染性疾病儿童中,包括重症支原体肺炎、坏死性肺炎等重症疾病,且小年龄组在重症疾病占的比例较高,这可能是导致机体的免疫应答能力降低的原因。然而,造成各研究结果不同的原因较多,包括IGRAs检测所使用试剂盒的不同,纳入的研究人群不同(如是否合并HIV感染、BCG接种情况),以及研究设计合理性和研究方法质量控制等。但关于上述因素与IGRAs结果的相关性仍需要扩大样本量进一步验证。
本研究也存在一定的局限性。首先,由于本研究中结核病患儿标本(痰液、支气管灌洗液、胃液、胸腔积液、腹腔积液、病理活检)的Mtb培养和抗酸染色的阳性率较低,采用敏感度在病原学确诊和临床诊断的结核病患儿中进行评价,存在一定的多重参照偏倚。因此,我们选择当前公认的儿童结核病临床综合诊断标准,并严格筛选患儿,尽量减小此类偏倚。其次,由于缺乏潜伏结核感染诊断的金标准,在呼吸系统感染患儿中可能会存在真正的潜伏结核感染者,采用此类患儿作为对照可能会低估上述试验的特异度。
综上所述,相比于TST,IGRAs在各年龄段儿童中具有较高的敏感度和特异度,在各年龄段儿童结核病的辅助诊断中具有一定的临床应用价值。
[1] Nelson LJ, Wells CD. Global epidemiology of childhood tuberculosis(Review).Int J Tuberc Lung Dis,2004,8(5):636-647.
[2] Khan EA, Starke JR. Diagnosis of tuberculosis in children: increased need for better methods(Review). Emerg Infect Dis, 1995,1(4):115-123.
[3] Critselis E, Amanatidou V, Syridou G, et al. The effect of age on whole blood interferon-gamma release assay response among children investigated for latent tuberculosis infection. J Pediatr,2012,161(4):632-638.
[4] Nicol MP, Davies MA, Wood K, et al. Comparison of T-SPOT.TB assay and tuberculin skin test for the evaluation of young children at high risk for tuberculosis in a community setting. Pediatrics,2009,123(1):38-43.
[5] 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会. 儿童肺结核的临床诊断标准和治疗方案(试行).中华儿科杂志,2006,44(4):249-251.
[6] American Thoracic Society. Diagnostic standards and classification of tuberculosis in adults and children. Am J Res Crit Med J,2000, 161 (4 Pt 1):1376-1395.
[7] Xiao J, Sun L, Wu XR, et al. Association of immunophenotypic characterization of peripheral lymphocytes with different clinical phenotypes of tuberculosis in Chinese Han children. Chin Med J,2012, 125(2): 275-280.
[8] Haimi-Cohen Y, Zeharia A, Mimouni M, et al. Skin indurations in response to tuberculin testing in patients with nontuberculous mycobacterial lymphadenitis. Clin Infect Dis,2001,33(10):1786-1788.
[9] 全国结核流行病学抽样调查技术指导组. 第四次全国结核病流行病学抽样调查报告. 中华结核和呼吸杂志,2002, 25(1):3-7.
[10] Gao L,Lu W,Bai L, et al.Latent tuberculosis infection in rural China: baseline results of a population-based, multicentre, prospective cohort study. Lancet Infect Dis,2015,15(3):310-319.
[11] Sollai S, Galli L, de Martino M, et al. Systematic review and meta-analysis on the utility of Interferon-gamma release assays for the diagnosis ofMycobacteriumtuberculosisinfection in children: a 2013 update. BMC Infect Dis, 2014,14(Suppl 1):S1-6.
[12] Schopfer K, Rieder HL, Bodmer T, et al. The sensitivity of an interferon-gamma release assay in microbiologically confirmed pediatric tuberculosis. Eur J Pediatr,2014,173(3):331-336.
[13] Blandinieres A, de Lauzanne A, Guerin-El KV, et al. QuantiFERON to diagnose infection byMycobacteriumtuberculosis: performance in infants and older children. J Infect, 2013,67(5):391-398.
[14] Basu RR, Sotgiu G, Altet-Gomez N, et al. Identifying predictors of interferon-gamma release assay results in pediatric latent tuberculosis: a protective role of bacillus Calmette-Gue-rin?: a pTB-NET collaborative study. Am J Respir Crit Care Med,2012,186(4):378-384.
[15] Carvalho AC, Schumacher RF, Bigoni S, et al. Contact investigation based on serial interferon-gamma release assays (IGRAS) in children from the hematology-oncology ward after exposure to a patient with pulmonary tuberculosis. Infection,2013,41(4):827-831.
[16] Haustein T, Ridout DA, Hartley JC, et al. The likelihood of an indeterminate test result from a whole-blood interferon-gamma release assay for the diagnosis ofMycobacteriumtuberculosisinfection in children correlates with age and immune status. Pediatr Infect Dis J,2009,28(8):669-673.
[17] Thomas TA, Mondal D, Noor Z, et al. Malnutrition and helminth infection affect performance of an interferon gamma-release assay. Pediatrics,2010,126(6):e1522-1529.
(本文编辑:范永德)
Performance of the interferon gamma release assay for diagnosis of tuberculosis in children in different ages
SUN Lin, TIAN Jian-ling, YIN Qing-qin, LI Jie-qiong,GUO Ya-jie, QI Hui, XIAO Jing, XU Fang, JIAO Wei-wei, SHEN Chen, SHEN A-dong.
Beijing Children’s Hospital Affiliated to Capital Medical University, Beijing Pediatric Research Institute, Key Laboratory of Major Diseases in Children and National Key Discipline of Pediatrics (Capital Medical University), Ministry of Education, Beijing Key Laboratory of Pediatric Respiratory Infection Diseases, Beijing 100045, China
SHEN A-dong, Email:shenad16@hotmail.com
Objective To analyze the performance of interferon gamma release assays (IGRAs) for diagnosis of tuberculosis in children in different age. Methods The diagnostic accuracy of IGRAs and TST were assessed in 205 children with active tuberculosis and 867 children with nontuberculous respiratory infection, who were referred to the Beijing Children’s Hospital during the period from March 2011 through June 2013. Sensitivity, specificity and concordance were calculated between different subgroups classified by different ages (136 cases in 0~y, 323 cases in 2~y, 312 cases in 6~y and 301 cases in 10~18y). The diagnostic accuracy was analyzed by the area under the curve (AUC).The criterion for significance was set asP<0.05. Results The sensitivity of IGRAs (85.4%,175/205) was higher than TST test (81.5%,167/205) in active TB children (χ2=1.128,P>0.05), especially who were younger than 1 year old (IGRAs: 80.0%, 24/30, TST: 53.3%, 16/30,χ2=0.03,P>0.05),but there was no statistical difference. And the specificity of IGRAs was much higher than that of TST in each of the age subgroups (0~y,99.1% vs.86.8%,χ2=12.125,P<0.01;2~y,93.9% vs.73.6%,χ2=41.603,P<0.01;6~y,92.2% vs.77.0%,χ2=23.948,P<0.01;10~18y,88.8% vs.65.6%,χ2=33.040,P<0.01). AUC of IGRAs (0.895, 0.882, 0.893) was much higher than that of TST (0.701, 0.770, 0.764) in 0~y, 2~y and 10~18y subgroups (P<0.05), and AUC of the two tests were similar in 6~y subgroup (IGRAs: 0.895, TST: 0.838,P>0.05).The two test obtained low concordance in the enrolled subjects,kappa<0.40. The AUC of four tests were no statistical difference (P>0.05). The overall proportion of indeterminate results was high (8.6%, 101/1173), the indeterminate rate of children older than 9 years old was significant lower than the other three groups (10.5% for 0~y,10.0% for 2~y,8.0% for 6~y,6.8% for 10~18y,χ2=859.9,P<0.01). Conclusion IGRAs is a specific and sensitive tool for diagnosis of active tuberculosis in children.
Interferon-gamma release tests; Tuberculosis/diagnosis; Child
10.3969/j.issn.1000-6621.2015.07.009
首都卫生发展科研专项 (2011-2009-05);“十二五”国家科技重大专项(2013ZX10003003-004)
100045首都医科大学附属北京儿童医院 北京市儿科研究所结核病研究室 教育部儿科重大疾病研究重点实验室 儿童呼吸系统感染性疾病研究北京市重点实验室
申阿东,Email:shenad16@hotmail.com
2015-01-28)

