两种γ干扰素释放试验及PPD试验结果在结核感染诊断中的比较
梁艳 王兰 张翠英 王志耘 侯英 阳幼荣 张俊仙 赵文娟 吴雪琼
·论著·
两种γ干扰素释放试验及PPD试验结果在结核感染诊断中的比较
梁艳 王兰 张翠英 王志耘 侯英 阳幼荣 张俊仙 赵文娟 吴雪琼
目的 研究2种γ干扰素(IFN-γ)释放试验(interferon-γ release assays,IGRA)和 PPD 试验在结核感染诊断中的相关性及应用价值。方法 对2010年178名驻京部队河南籍入伍新兵进行PPD试验,用结核分枝杆菌特异性重组培养滤液蛋白10(culture filtrate protein 10,CFP10)-早期分泌性靶抗原6(early secretory antigenic target 6,ESAT6)融合蛋白(重组CFP10-ESAT6 融合蛋白)-酶联免疫斑点试验(enzyme linked-immunospot assay,ELISPOT)检测新兵外周血释放 IFN-γ的效应 T淋巴细胞,并用结核分枝杆菌 CFP10-ESAT6 重组蛋白-化学发光酶免疫法(chemiluminescence enzyme immunoassay,CLEIA)检测其全血中 IFN-γ 水平。结果 178 名入伍新兵中,PPD试验、ELISPOT和CLEIA的阳性率分别为 39.89%(71/178)、31.46%(56/178) 和 21.35%(38/178)。前者阳性率显著高于后二者(χ2=14.3663,P<0.01),ELISPOT法阳性率也显著高于CLEIA法(χ2=4.6834,P<0.05)。在107名PPD试验阴性者中, ELISPOT、CLEIA法检测阳性者分别为33例(30.84%)、14例(13.08%),前者阳性率显著高于后者(χ2=9.8425,P<0.01)。在71例PPD阳性者中,ELISPOT、CLEIA法检测阳性者分别为23例(32.39%)、24 例(33.80%),两者差异无统计学意义(χ2=0.0318,P>0.05)。ELISPOT法和PPD试验的一致率为 54.49%(97/178,U=0.218,P>0.05);CLEIA法和PPD试验的一致率为 65.73% (117/178,U=3.227,P<0.01),ELISPOT和CLEIA法的一致率为66.29%(118/178,U=1.885,P>0.05);PPD试验、ELISPOT和CLEIA检测方法的一致率为 42.70%(76/178)。ELISPOT法检测的斑点数与PPD试验反应的硬结平均直径之间缺乏相关性(r=0.138 51,P>0.05);CLEIA 法检测的IFN-γ水平与PPD试验反应的硬结平均直径之间有低的相关性(r=0.252 44,P<0.01);ELISPOT检测的斑点数与CLEIA检测的IFN-γ水平之间也有低的相关性(r=0.2755,P<0.01)。在卡介苗接种者中,PPD试验检测的阳性率为50.00% (48/96),ELISPOT为22.92% (22/96),CLEIA为23.96%(23/96);在无卡介苗接种者中,PPD试验检测的阳性率为28.05% (23/82),ELISPOT为47.56%(39/82),CLEIA为17.07%(14/82)。结论 两种IGRA方法与PPD试验之间的一致性差、相关性低,用IGRA方法能够有效地筛查结核感染,而ELISPOT检测的阳性率高于CLEIA。
潜伏性结核/诊断; 干扰素γ释放试验; 结核菌素试验; 酶联免疫斑点测定; 免疫酶技术
结核病是慢性呼吸道传染病,目前我国约有5.5亿人感染了结核分枝杆菌[1]。结核菌素纯蛋白衍生物(PPD)皮肤试验是结核病辅助诊断的一种重要方法,但由于纯蛋白衍生物是多种抗原的混合物,所含抗原为致病性结核分枝杆菌、环境分枝杆菌及卡介苗(BCG)菌株所共有,其结果受到BCG接种及其他环境分枝杆菌感染的影响,诊断特异度低;由于我国约76%的新生儿接种了BCG[1],而PPD试验不能区分是结核感染还是BCG接种[2-3]。因此,目前结核潜伏感染的诊断缺乏“金标准”。笔者以结核分枝杆菌特异性重组培养滤液蛋白10(culture filtrate protein 10,CFP10)-早期分泌性靶抗原6(early secretory antigenic target 6,ESAT6)融合蛋白(重组CFP10-ESAT6融合蛋白)为刺激剂,建立了2种新的、结核特异的γ干扰素(IFN-γ)释放试验(interferon-γ release assays,IGRA):一种是酶联免疫斑点试验(enzyme linked-immunospot assay,ELISPOT),该方法能够检测外周血单个核细胞中分泌结核特异的IFN-γ的效应T淋巴细胞的斑点数[4-6];另一种是全血IFN-γ释放试验,用化学发光酶免疫法(chemiluminescence enzyme immunoassay,CLEIA)检测血浆中分泌的结核特异的IFN-γ水平。部队军事人员集中居住、训练,生活、工作中接触密切,入伍新兵来自全国各地,结核感染情况不同;因此,军事人员是结核感染的高危人群[7]。笔者研究PPD试验、ELISPOT和CLEIA 3种检测方法在诊断结核感染时的相关性及应用价值,为驻京部队入伍新兵中结核潜伏感染者筛查方法的选择提供实验依据,为发现高危人群,以及制定军队结核病预防、控制策略奠定基础。
对象和方法
一、研究对象
178名2010年驻京部队河南籍入伍新兵,均为男性,年龄17~24岁,平均年龄(19.2±1.7)岁,常规胸部X线检查均为阴性。本研究经解放军第三〇九医院伦理委员会审核并通过,同时征得受试对象同意。
二、研究方法
1. 标本采集:采集驻京部队河南籍入伍新兵静脉血2管,每管4 ml,均用肝素钠抗凝,一管用于ELISPOT检测,一管用于全血IFN-γ释放试验。
2. PPD试验:采集静脉血后,进行PPD试验。具体方法如下:吸取卡介菌PPD (50 IU/ml) 0.1 ml(5 IU),采用Mantoux法注射于前臂掌侧皮内。于注射后72 h检查注射部位反应,若硬结平均直径≥5 mm为阳性,5~9 mm为一般阳性(+),10~19 mm为中度阳性(++),≥20 mm为强阳性(+++)(硬结平均直径<20 mm,局部发生水疱或坏死也为强阳性)[8]。参加研究人员为经过专业培训的全军结核病防治队人员,负责查验双上臂有否BCG接种瘢痕;PPD试验后检查、测量PPD反应情况及硬结平均直径。
3.ELISPOT方法:采用上海铭源数康生物芯片有限公司的结核感染T细胞检测试剂盒(F-SPOT.TB),按说明书操作。简述如下:(1)外周血单个核细胞分离及计数:取4~5 ml外周血(抗凝),用淋巴细胞分层液分离、提取单个核细胞(PBMCs),调节细胞浓度至2×106/L。(2)分泌IFN-γ的T细胞检测:每个测试样本需要微孔板3孔:在阴性对照孔内加入完全细胞培养液50 μl;在阳性对照孔内加入阳性对照植物凝集素(phytohemagglutinin,PHA)50 μl;在2个测试孔内分别加入重组CFP10-ESAT6融合蛋白50 μl。分别在上述各孔内,加100 μl含有2×105个PBMCs的悬液,将微孔板置于37 ℃、含5% CO2的孵箱中孵育20 h;弃培养上清,加入200 μl于4 ℃下预冷的无菌蒸馏水裂解细胞10 min,用200 μl 1×PBST[磷酸盐缓冲液(PBS)-Tween20(PBST)]洗板3次,1 min/次,最后1次洗板后拍干;在每个孔中加入100 μl用PBS稀释的生物素标记抗体(1∶200稀释),于37 ℃下孵育1 h;洗板后,加入100 μl用PBS稀释的链亲合素-碱性磷酸酶(1∶200稀释),于37 ℃下孵育30 min;洗板后,每孔加入显色液100 μl,于37 ℃下闭光显色7~15 min;可见板底显示紫蓝色斑点,在96孔聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜板中加入双蒸水或去离子水终止反应,将板放入37 ℃烘箱中干燥30 min。使用酶联斑点分析仪或放大镜计数着色的斑点,每一个点代表一个分泌IFN-γ的T淋巴细胞。当阳性对照孔斑点数≥20个,阴性对照孔斑点数<13个,检测孔斑点数减去阴性对照孔斑点数≥16个,可判断所检测标本为阳性;阳性对照孔斑点数≥20个,当阴性对照孔斑点数≥13个、≤20个,检测孔斑点数为阴性对照孔斑点数的2倍,可判断所检测标本为阳性。
4. 全血IFN-γ释放试验(CLEIA):直接将肝素抗凝的全血与阳性对照PHA、CFP10-ESAT6融合蛋白,以及阴性对照完全细胞培养液共同孵育18~20 h;如果受试者感染过结核分枝杆菌,其外周血会有特异效应T淋巴细胞,在体外再次受到抗原刺激时会释放分泌IFN-γ并弥散至血浆中;用CLEIA的方法检测血浆中IFN-γ的水平来达到诊断的目的。根据前期研究,检测孔IFN-γ的水平减去阴性对照孔IFN-γ的水平≥396.5 pg/ml,可判断所检测标本为阳性[9]。
5. 统计学分析:应用SAS 6.12软件处理数据,定性资料的差异性分析用R×C表假设检验,两组定性资料的一致性检验用Kappa检验;正态分布的定量资料的差异性分析用单因因素方差分析,两两比较用Dunnettt检验,偏态分布的定量资料用秩和(Kruskal-Wallis)检验,两两比较用q检验;两组定量资料的相关分析用Pearson线性相关分析,P<0.05为差异有统计学意义。
结 果
一、入伍新兵PPD试验、ELISPOT和CLEIA检测结果
178名驻京部队河南籍入伍新兵的PPD试验、ELISPOT和CLEIA检测结果见表1。其中PPD试验阳性者71例(39.89%,71/178)、强阳性者4例(2.25%),ELISPOT阳性者56例(31.46%),CLEIA阳性者38例(21.35%),PPD试验阳性率显著高于2种IGRA试验(χ2=14.3663,P=0.0008),ELISPOT阳性率也显著高于CLEIA法(χ2=4.6834,P<0.05)。在107名PPD阴性者中,33例(30.84%,33/107)为ELISPOT阳性,14例(13.08%,14/107)为CLEIA阳性,ELISPOT阳性率显著高于CLEIA阳性率(χ2=9.8425,P<0.01);在71例PPD阳性者中,23例(32.39%,23/71)为ELISPOT阳性,24例(33.80%,24/71)为CLEIA阳性,两者差异无统计学意义(χ2=0.0318,P>0.05)。
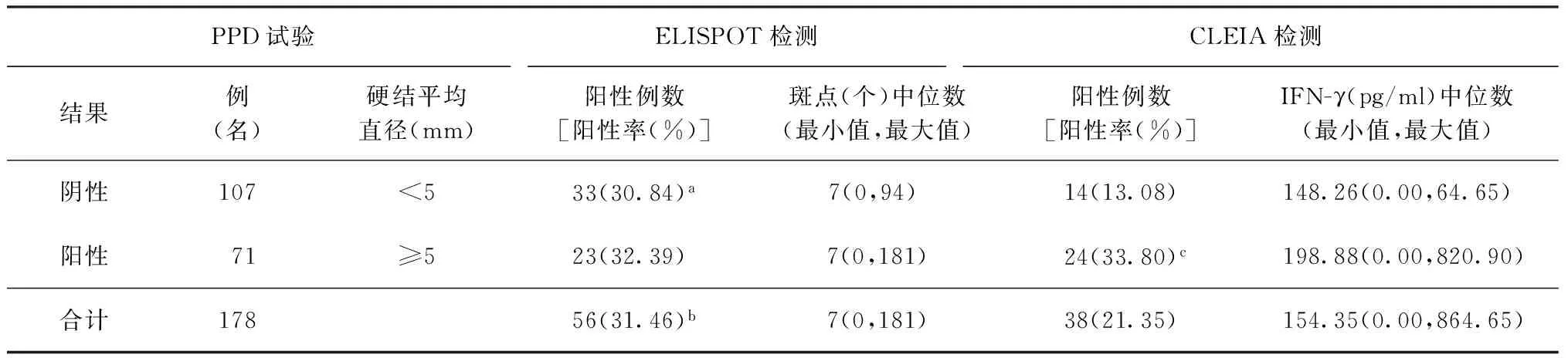
表1 2010年178名河南籍入伍新兵PPD试验、ELISPOT和 CLEIA检测结果
注a:与CLEIA法比较,χ2=9.8425,P<0.01;b:与CLEIA法比较,χ2=4.6834,P<0.05;c:与PPD试验阴性组比较,χ2=11.2931,P<0.01
二、入伍新兵PPD试验、ELISPOT和CLEIA检测结果的两两比较
71例PPD试验阳性者,ELISPOT检测阳性23例(32.39%)、阴性48名;107名PPD试验阴性者,ELISPOT检测阳性33例(30.84%)、阴性74例;两者的一致率为54.49%(97/178),两种检测结果一致性分析显示,ELISPOT与PPD试验之间缺乏一致性(U=0.218,P>0.05;Kappa=0.0161),结果见表2。两种检测结果相关性分析显示ELISPOT斑点数与PPD试验硬结平均直径之间缺乏相关性(r=0.138 51,P>0.05),其散点图见图1。

表2 2010年178名河南籍入伍新兵PPD试验和ELISPOT检测结果比较(例或名)
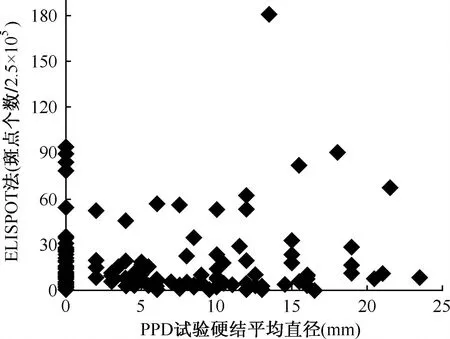
图1 2010年178名河南籍入伍新兵ELISPOT法和PPD试验检测结果的关系
71例PPD试验阳性者,CLEIA检测阳性与阴性者分别为24例(33.80%)、47名(66.20%);107名PPD试验阴性者,CLEIA检测阳性与阴性者分别为14例(13.08%)、93名(86.92%),两者的一致率为65.73%(117/178)。两种检测结果一致性分析显示,CLEIA与PPD试验之间的一致性差异具有统计学意义(U=3.227,P<0.01;Kappa=0.2248),结果见表3。两种检测结果相关性分析显示,CLEIA检测的IFN-γ水平与PPD试验硬结平均直径之间有相关性(r=0.252 44,P<0.01),其散点图见图2。

表3 2010年178名河南籍入伍新兵PPD试验和CLEIA法检测结果比较(例或名)
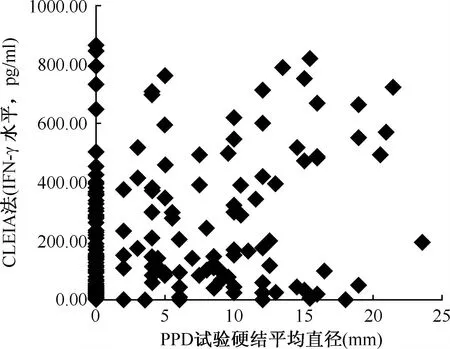
图2 2010年178名河南籍入伍新兵CLEIA法和PPD试验检测结果的关系
56例ELISPOT检测阳性者,CLEIA检测17例(30.36%)为阳性、39名为阴性;在122名ELISPOT阴性者中,CLEIA检测21例(17.21%)为阳性,101名为阴性;两者的一致率为66.29%(118/178)。两种检测结果一致性分析显示,ELISPOT与CLEIA、PPD试验之间缺乏一致性(U=1.885,P>0.05;Kappa=0.1440),结果见表4。两种检测结果相关性分析显示ELISPOT斑点数与CLEIA检测的IFN-γ水平相关(r=0.2755,P<0.01),其散点图见图3。
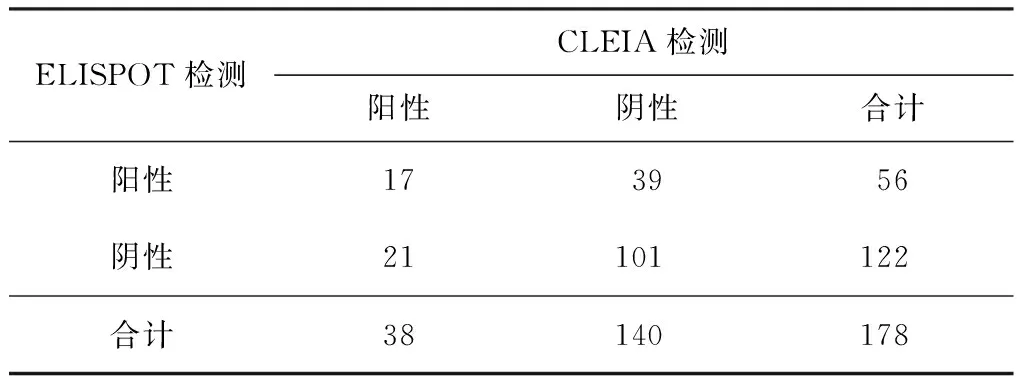
表4 2010年178名河南籍入伍新兵ELISPOT和 CLEIA检测结果比较 (例或名)
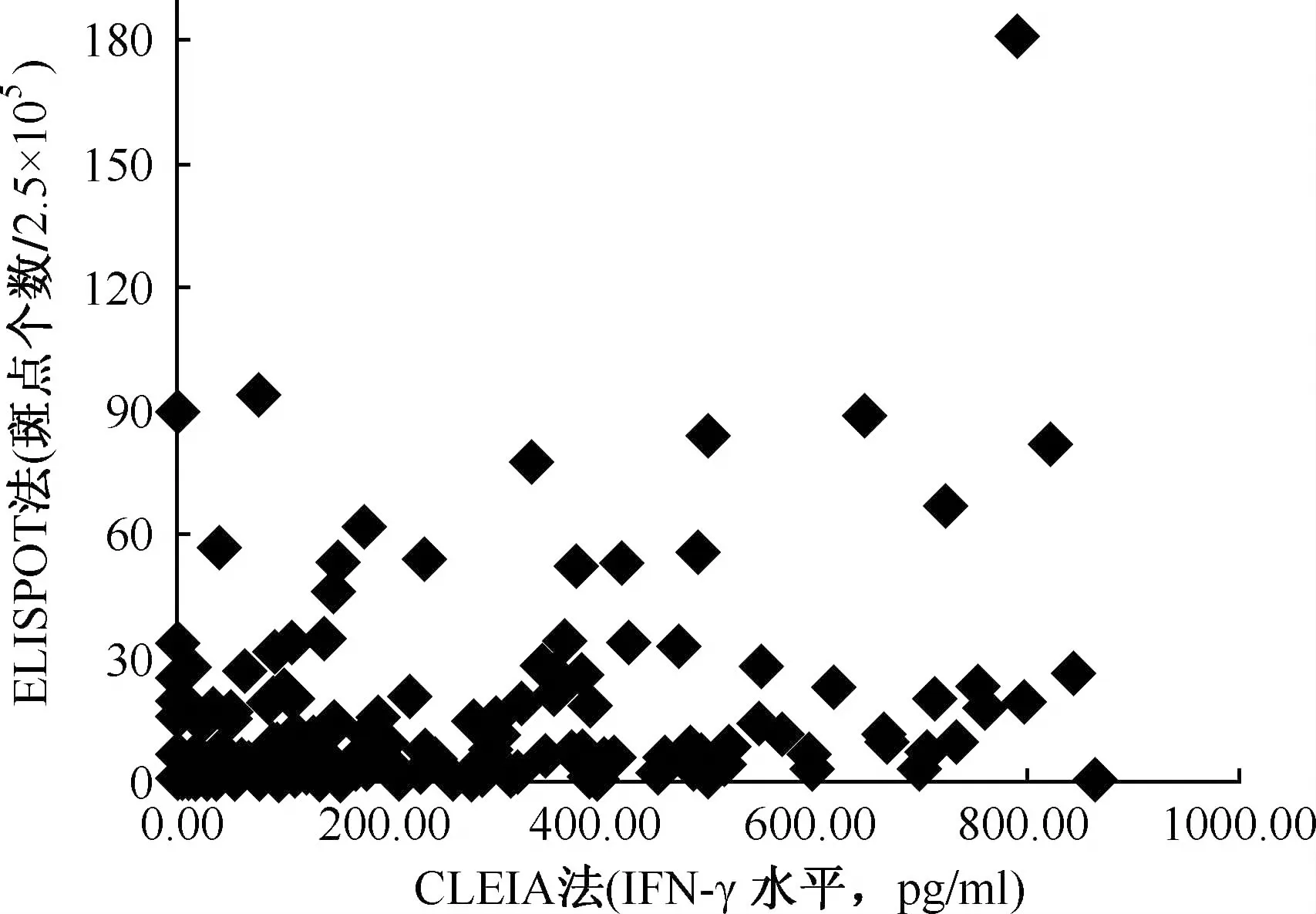
图3 2010年178名河南籍入伍新兵ELISPOT和CLEIA检测结果的关系
三、入伍新兵PPD试验、ELISPOT和CLEIA检测结果的比較
PPD试验、ELISPOT和CLEIA法检测同时阳性者有11例,同时阴性者有65名;3种方法中2种均阳性者有41例;1种方法为阳性者共有72例,其中PPD单阳35例,ELISPOT单阳28例,CLEIA单阳9例;2种IGRA方法联合检测的阳性率为43.82%(78/178),在107名PPD阴性者中和71例PPD阳性者中2种IGRA方法联合检测的阳性率分别为39.25%(42/107)和50.70%(36/71)。3种检测方法的一致率为42.70%(76/178),三者的检测结果差异具有统计学意义(χ2=14.3663,P<0.01),结果见表5。
四、BCG接种对入伍新兵PPD试验、ELISPOT和CLEIA检测结果的影响
根据手臂上是否有卡痕来判断是否接种了BCG。178名驻京部队河南籍入伍新兵中有卡痕者96名(53.93%),其中48例(50.00%)为PPD试验阳性,22例(22.92%)ELISPOT检测阳性,23例(23.96%)CLEIA检测阳性,PPD试验阳性率显著高于2种IGRA法(χ2=20.6769,P<0.01),但2种IGRA检测阳性率差异无统计学意义(χ2=0.029,P>0.05)。82名(46.07%)无卡痕,其中23例(28.05%)PPD试验阳性,39例(47.56%)ELISPOT检测阳性,14例(17.07%)CLEIA检测阳性;ELISPOT检测的阳性率显著高于CLEIA检测和PPD试验(χ2=18.3167,P<0.01),但CLEIA与PPD试验检测的阳性率差异无统计学意义(χ2=2.827,P>0.05),结果见表6。
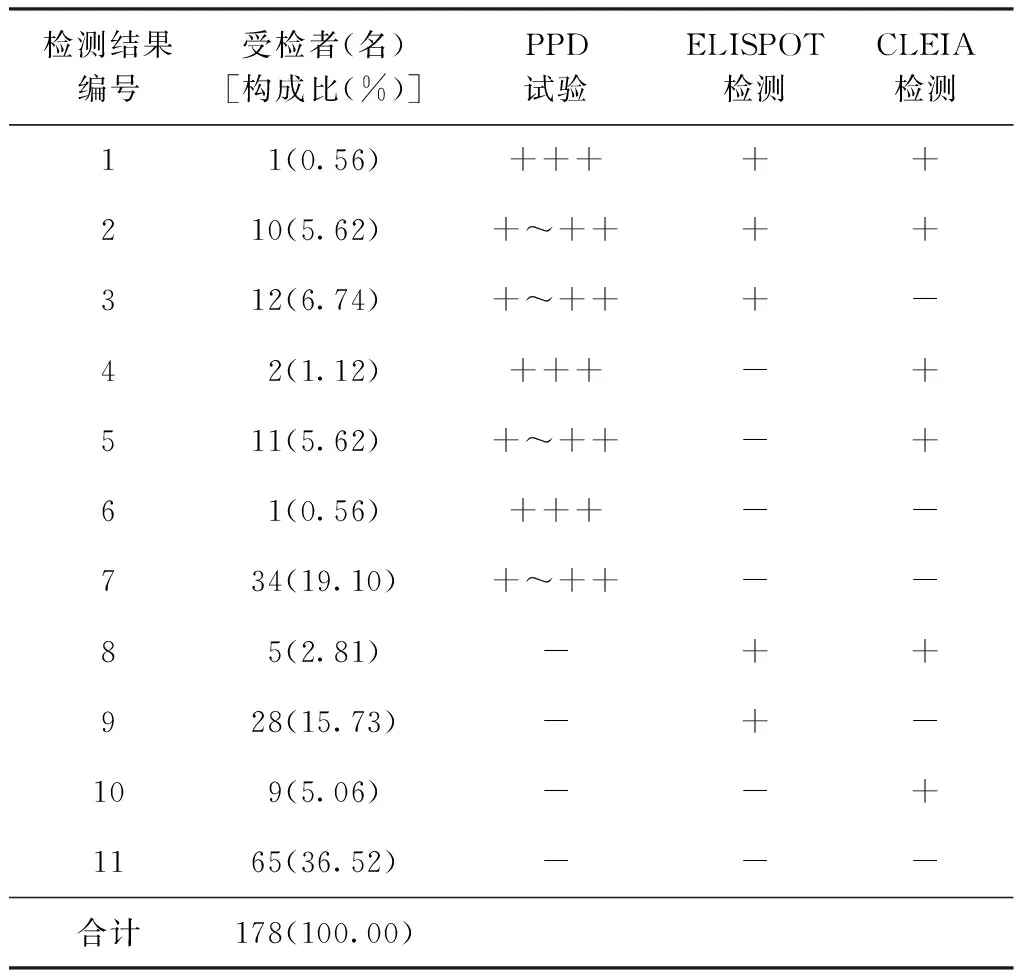
表5 2010年178名河南籍入伍新兵PPD试验、ELISPOT和 CLEIA检测结果比较
注 检验结果编号是指PPD试验、ELISPOT和CLEIA 3种检测结果的不同组合;“—” 代表阴性,“+” 代表一般阳性,“++”代表中度阳性,“+++”代表强阳性
讨 论
近年来,通过检测结核分枝杆菌抗原特异性IFN-γ水平来诊断结核感染已经被越来越多的国家所接受,与PPD试验比较,该技术最大的优势在于能区分结核分枝杆菌感染和BCG接种引起的免疫应答,而显著提高了检测的特异度,这对于BCG广泛接种的国家和地区意义尤其重大。
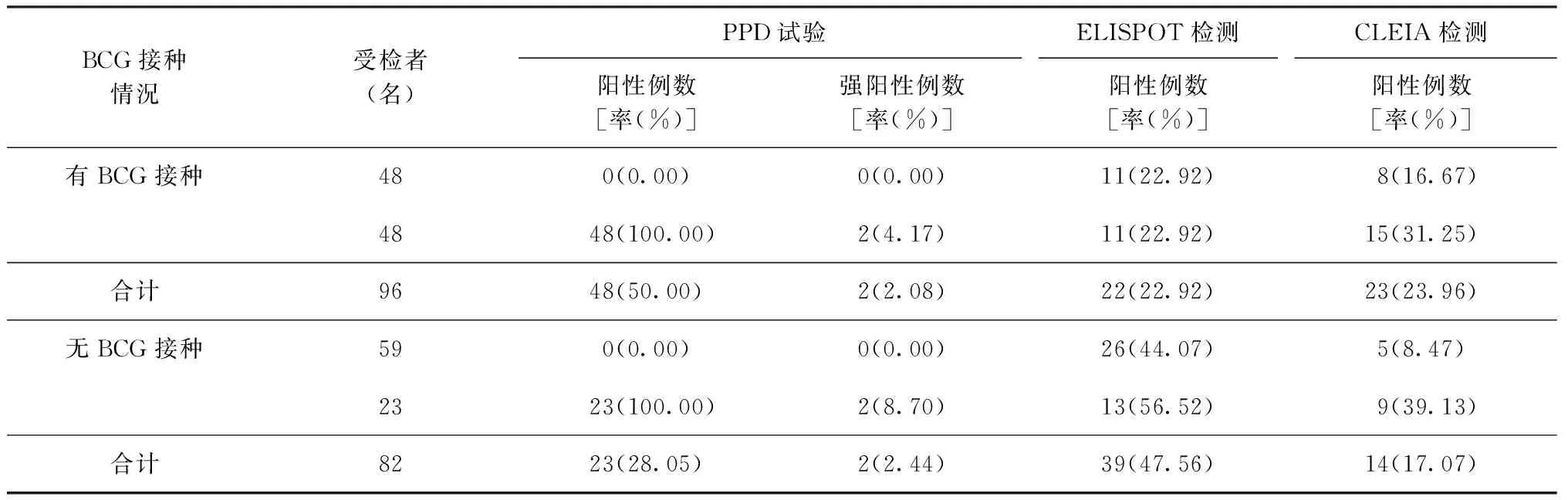
表6 BCG接种对PPD试验、ELISPOT和 CLEIA检测结果的影响
一、PPD试验和2种IGRA方法的检测结果分析
本研究的入伍新兵均是健康人群,实际包括了三类人员:正常人、BCG接种者和结核潜伏感染者,其PPD试验阳性率为39.89%,低于2003—2006年与2006—2009年驻京部队入伍新兵的PPD试验阳性率(分别为49.9%、53.1%)[10-11];但本研究ELISPOT检测的阳性率为31.46%,与笔者2009年应用ELISPOT检测的驻京部队入伍新兵结核潜伏感染率相似(30.7%)[6];应用全血CLEIA法检测的阳性率(21.35%)显著低于PPD试验和ELISPOT法,分析其可能原因如下:(1)用做抗原刺激剂的CFP10和ESAT6主要存在于结核分枝杆菌和牛结核分枝杆菌的基因组中,但在BCG和大多数环境结核分枝杆菌基因组中缺失RD1区,因此2种IGRA检测不受BCG接种的影响[12-14],其阳性率均显著低于PPD试验。(2)PPD反应是通过激活中心记忆性T淋巴细胞反应,它检测的主要是以前的、休眠的结核分枝杆菌感染,它的反应性比特异性IFN-γ反应持续的时间更长,可能也是导致应用PPD试验检测结核潜伏感染人群阳性率较高的原因之一[15]。(3)特异性IFN-γ应答是依赖于抗原介导的效应T淋巴细胞的存在,检测的是近期感染或“活动性”感染,IFN-γ的释放会随着结核分枝杆菌感染后时间的推移而逐渐地减弱,因此,2种IGRA法检测结核潜伏感染人群的阳性率较低[16]。(4)由于检测人群中包括BCG接种者,而本研究PPD试验所采用的是卡介菌PPD,因此,PPD试验阳性率显著高于IGRA法的阳性率。(5)ELISPOT法检测的阳性率显著高于CLEIA法,从方法学上来说,其原因可能在于ELIPOT技术是从单细胞水平进行检测,可及时捕获细胞周围分泌的细胞因子,从25万个PBMCs中检出每个分泌IFN-γ的细胞,敏感度更高[17]。此外,ELISPOT法重点检测活细胞的功能,即检测单个细胞分泌IFN-γ的能力及分泌IFN-γ的细胞频率;而CLEIA法是在群体细胞水平检测IFN-γ的分泌情况,重点检测IFN-γ的生成量,因此,结核潜伏感染者中虽然分泌IFN-γ的细胞数量较多,但分泌IFN-γ的水平较低。
二、PPD试验结果对ELISPOT和CLEIA检测的影响
PPD试验阴性和阳性的新兵中ELISPOT检测的阳性率分别为30.84%和32.39%,这与笔者课题组2009年的报道相似:在452例PPD试验阴性和455例阳性者的驻京部队入伍新兵中,分别有132例(29.2%)和146例(32.1%)ELISPOT检测阳性[6]。2次研究结果表明,PPD试验阴性和阳性者ELISPOT检测的阳性率和斑点数差异均无统计学意义,再次证明ELISPOT检测结果不受PPD试验结果的影响。但PPD试验阳性的新兵中CLEIA检测阳性率显著高于PPD试验阴性的新兵,这与笔者课题组2011年的报道一致[9],2次研究结果均表明,CLEIA检测阳性率受PPD试验结果的影响,这是因为PPD试验阳性人群中包括结核潜伏感染者,其分泌IFN-γ的水平高于PPD试验阴性人群。
三、PPD试验与2种IGRA检测结果的相关性
目前有许多研究显示PPD试验与IGRA结果之间的一致性差、相关性低[18-19],这与本研究结果是一致的。这3种方法检测机体免疫应答的原理不同,ELISPOT检测的是体外的致敏T淋巴细胞再次受到结核分枝杆菌特异性抗原刺激后释放IFN-γ的效应T淋巴细胞数;CLEIA检测的是体外的致敏T淋巴细胞再次受到结核分枝杆菌特异性抗原刺激后分泌IFN-γ的水平;而PPD试验的原理是迟发型变态反应,当体内致敏T淋巴细胞再次受到结核分枝杆菌特异蛋白刺激时会释放多种可溶性淋巴因子,导致血管通透性增加,巨噬细胞在局部集聚、浸润,在注射部位出现红肿、硬结等变态反应,其检测的是72 h局部出现红肿、硬结反应的平均直径。本研究ELISPOT与PPD试验检测结果缺乏一致性,其效应T细胞斑点数与PPD试验硬结平均直径之间也缺乏相关性,其原因在于虽然体外的致敏T淋巴细胞再次受到结核特异性抗原刺激后释放IFN-γ的T细胞数增加了,但是并不意味着其促使巨噬细胞集聚、浸润的反应程度也能成比例的增强,一部分结核潜伏感染者巨噬细胞可能对IFN-γ反应低或不反应,而出现PPD试验假阴性;此外,BCG接种者会导致PPD试验假阳性。CLEIA检测与PPD试验之间的一致性虽然具有一定的统计学意义,但Kappa值较小,一致率并不太高;CLEIA检测的IFN-γ水平与PPD试验反应的硬结平均直径之间的相关性也较低,其原因同上所述。
四、对2种IGRA检测结果一致性的分析
本研究2种IGRA结果的一致性差,ELISPOT斑点数与CLEIA检测的IFN-γ水平的相关系数较小,二者的相关性也较低。两者的差异主要是发生在PPD阴性的人群中,分析其可能原因如下:(1)由于PPD试验的敏感度低,导致部分结核潜伏感染者出现假阴性;而ELIPOT检测的是外周血单个核细胞在结核特异性抗原刺激下释放IFN-γ的效应T细胞数量,因为其单个核细胞是定量的,所以排除了个体之间T细胞数量不同的影响,检测的敏感度较高[20-21];CLEIA检测的是全血中致敏T细胞再次受到结核特异性抗原刺激后释放的IFN-γ水平,其单个核细胞是不定量的,且不同人的单个核细胞数也不同,其结果可能受到个体T细胞数量不同的影响,一部分T细胞数量较低或释放IFN-γ较少的个体也可能出现假阴性,使CLEIA检测的敏感度高于PPD试验、低于ELISPOT;(2)潜伏感染人群中PPD阴性者可能是由于其体内致敏T淋巴细胞再次受到结核分枝杆菌特异蛋白刺激后释放的细胞因子水平较低,不能引起血管通透性增加,也不能诱使巨噬细胞在局部集聚、浸润;但ELISPOT方法可捕捉到释放IFN-γ的效应T细胞,敏感度较高;而部分释放低水平IFN-γ的潜伏感染者CLEIA检测可能出现假阴性,这就导致了ELISPOT与CLEIA的检测结果不完全一致。
五、BCG接种对PPD试验、ELISPOT和CLEIA检测结果的影响
我国新生儿第一针免疫接种的就是BCG,本研究结果显示这批新兵的BCG接种率是53.93%。BCG接种人群PPD阳性率显著高于2种IGRA试验,而2种IGRA试验的阳性率则相近。这可能是由于PPD含有结核分枝杆菌和BCG的共同抗原,而导致PPD试验出现假阳性。由于做抗原刺激剂的CFP10和ESAT6基因主要存在于结核分枝杆菌和牛结核分枝杆菌基因组中,在BCG和大多数环境结核分枝杆菌基因组中RD1区缺失,因此2种IGRA试验具有较高的特异度,不受BCG接种的影响[6,9]。
本研究无BCG接种人群ELISPOT试验的阳性率均显著高于PPD试验和CLEIA方法,一方面说明ELIPOT对自然感染的检出率高于PPD试验和CLEIA,但也不排除假阳性的可能;另一方面说明PPD和CLEIA的敏感度不够,可能存在假阴性的问题。BCG接种人群PPD阳性率显著高于无BCG接种人群,说明部分人出生时接种的BCG仍有免疫原性;BCG接种人群ELISPOT的阳性率显著低于无BCG接种人群,而CLEIA在有或无BCG接种人群中的阳性率差异无统计学意义,均说明BCG接种对这两种IGRAs没有影响。
六、关于2种IGRA方法联合检测结果的分析
两种IGRA方法联合检测的阳性率为43.82%,略高于单独PPD试验的阳性率39.89%。其原因一方面是由于PPD试验的敏感度不够,目前PPD试验的敏感度只有70%~80%[22],存在假阴性;另一方面说明IGRA检测结果可能存在假阳性问题。
PPD试验检测2010年河南籍驻京部队入伍新兵结核潜伏感染的强阳性率为2.25%,比2003年至2006年驻京部队入伍新兵的PPD试验强阳性率(2.9%)略有降低[10]。
总之,2种IGRA方法与PPD试验之间一致性差、相关性低。但IGRA方法不受卡介苗接种的影响,因此用IGRA方法能够有效地筛查结核感染,而ELISPOT检测的阳性率高于CLEIA。
[1] 全国结核病流行病学抽样调查技术指导组. 第四次全国结核病流行病学抽样调查报告. 中华结核和呼吸杂志,2002, 25(1):3-7.
[2] Huebner RE, Schein MF, Bass JB Jr. The tuberculin skin test. Clin Infect Dis,1993, 17(6):968-975.
[3] Farhat M, Greenaway C, Pai M, et al. False-positive tuberculin skin tests: what is the absolute effect of BCG and non-tuberculous mycobacteria? Int J Tuberc Lung Dis,2006,10(11): 1192-1204.
[4] Porsa E, Cheng L, Graviss EA. Comparison of an ESAT-6/CFP-10 peptide-based enzyme-linked immunospot assay to a tuberculin skin test for screening of a population at moderate risk of contracting tuberculosis. Clin Vaccine Immunol,2007,14(6):714-719.
[5] Hill PC, Jackson-Sillah D, Fox A, et al. ESAT-6/CFP-10 fusion protein and peptides for optimal diagnosis ofMycobacteriumtuberculosisinfection by ex vivo enzyme-linked immunospot assay in the Gambia. J Clin Microbiol, 2005, 43(5): 2070-2074.
[6] Wu X, Li Q, Yang Y, et al. Latent tuberculosis infection amongst new recruits to the Chinese army: comparison of ELISPOT assay and tuberculin skin test. Clin Chim Acta,2009, 405(1/2):110-113.
[7] DiStasio AJ 2nd, Trump DH. The investigation of a tuberculosis outbreak in the closed environment of a U.S. Navy ship, 1987. Mil Med,1990,155(8): 347-351.
[8] 成诗明, 王国治, 王黎霞, 等. 结核菌素皮肤试验使用指导手册. 北京:人民卫生出版社,2014:27-35.
[9] Wu X, Hou Y, Liang Y, et al. Evaluation of a tuberculosis whole-blood interferon-γ chemiluminescent immunoassay among Chinese military recruits. Mol Diagn Ther,2011,15(6):341-346.
[10] 张翠英, 董恩军, 朱琳, 等. 驻京部队2003—2006 年新兵结核感染情况调查. 解放军预防医学杂志,2007,25(3):188-189.
[11] 董恩军, 张翠英, 张敬娟, 等. 某部2006—2009 年新兵结核感染状况调查. 武警医学院学报,2010,19(10):786-788.
[12] Harboe M, Oettinger T, Wiker HG, et al. Evidence for occurrence of the ESAT6 protein inMycobacteriumtuberculosisand virulentMycobacteriumbovisand for its absence inMycobacteriumbovisBCG. Infect Immun,1996,64(1):16-22.
[13] Menzies D, Pai M, Comstock G. Meta-analysis: new tests for the diagnosis of latent tuberculosis infection: areas of uncertainty and recommendations for research. Ann Intern Med, 2007, 146(5):340-354.
[14] Pai M, Zwerling A, Menzies D. Systematic review: T-cell-based assays for the diagnosis of latent tuberculosis infection: an update. Ann Intern Med, 2008, 149(3):177-184.
[15] 王兰,梁艳,吴雪琼,等. 2009年驻京部队入伍新兵结核感染及随访情况分析. 解放军医学杂志,2012,37(8):827-832.
[16] Mori T, Harada N, Higuchi K, et al. Waning of the specific interferon-gamma response after years of tuberculosis infection. Int J Tuberc Lung Dis, 2007, 11(9):1021-1025.
[17] 中华医学会结核病学分会,《中华结核和呼吸杂志》编辑委员会. γ-干扰素释放试验在中国应用的建议. 中华结核和呼吸杂志,2014,37(10):744-747.
[18] Carvalho AC, Pezzoli MC, El-Hamad I, et al. QuantiFERON-TB Gold test in the identification of latent tuberculosis infection in immigrants. J Infect, 2007, 55(2):164-168.
[19] Kim CH, Kim JY, Hwang YI, et al. Interferon-γ Enzyme-Linked Immunospot Assay in Patients with Tuberculosis and Healthy Adults. Tuberc Respir Dis (Seoul), 2014,76(1):23-29.
[20] 万荣, 李明武, 赖明红,等.结核感染T细胞斑点试验在老年肺结核中的诊断价值.中国防痨杂志, 2015,37(4): 348-352.
[21] 王立红,付秀华,张桂芝,等. 结核感染T细胞斑点试验在结核病诊断中的应用价值. 中国防痨杂志, 2013,35(12): 992-996.
[22] Doherty TM, Demissie A, Olobo J, et al. Immune responses to theMycobacteriumtuberculosis-specific antigen ESAT-6 signal subclinical infection among contacts of tuberculosis patients. J Clin Microbiol,2002,40(2):704-706.
(本文编辑:薛爱华)
The results comparison of two methods of Interferon-γ release assays with PPD skin test in TB infection diagnosis
LIANG Yan, WANG Lan, ZHANG Cui-ying, WANG Zhi-yun, HOU Ying, YANG You-rong, ZHANG Jun-xian, ZHAO Wen-juan, WU Xue-qiong.
Army Tuberculosis Prevention and Control Key Laboratory, Beijing Key Laboratory of New Techniques of Tuberculosis Diagnosis and Treatment, Institute of Tuberculosis Research, the 309th Hospital of PLA, Beijing 100091, China
WU Xue-qiong, Email: wu-xueqiong@263.net
Objective To analyze the relevance and application value of 2 kinds of interferon gamma (IFN-gamma) release test (IGRA) and purified protein derivative (PPD) skin test. Methods A total of 178 new recruits to the army from Henan province received intradermally injected with purified protein derivative PPD skin test and to detect IFN-γ t lymphocytes in peripheral blood with enzyme linked-immunospot assay (ELISPOT) assay and IFN-γ in whole blood with chemiluminescence enzyme immunoassay (CLEIA) with recombinant CFP-10/ESAT-6 fusion protein (rCFP-10/ESAT-6) as a stimulus. Results The prevalence of Latent TB infection (LTBT), as estimated by PPD skin test, ELISPOT assay and CLEIA, was 39.89% (71/178), 31.46% (56/178) and 21.35% (38/178) of new recruits, respectively. The positive rate by PPD skin test is significant higher than that by two methods of IGRA (χ2=14.3663,P<0.01),the positive rate by ELISPOT is significant higher than that by CLEIA (χ2=4.6834,P<0.05). Of 107 PPD-negative volunteers, 33 (30.84%) were ELISPOT-positive and 14 (13.08%) were CLEIA-positive, respectively, the positive rate by ELISPOT is higher than that by CLEIA (χ2=9.8425,P<0.01). Of 71 PPD-positive volunteers, 23 (32.39%) were ELISPOT-positive and 24 (33.80%) were CLEIA-positive, respectively, there was no statistically significant difference (χ2=0.0318,P>0.05). Agreement between PPD skin test and ELISPOT assay was 54.49% (97/178,U=0.218,P>0.05); agreement between PPD skin test and CLEIA was 65.73% (117/178,U=3.227,P<0.01); agreement between ELISPOT assay and CLEIA was 66.29% (118/178,U=1.885,P>0.05). Overall agreement among three tests was 42.70% (76/178). There was no correlation between spot formation cells detected by ELISPOT with average diameter detected by PPD skin test (r=0.138 51,P>0.05). There are low correlation between IFN-γ level detected by CLEIA with average diameter detected by PPD skin test(r=0.252 44,P<0.01); There are low correlation between spot formation cells detected by ELISPOT with IFN-γ level detected CLEIA (r=0.2755,P<0.01). 50.00% (48/96) of PPD-positive new recruits, 22.92% (22/96) of ELISPOT-positive new recruits and 23.96% (23/96) of CLEIA-positive new recruits found the BCG vaccination scars on their arms; while 28.05% (23/82) of PPD-positive new recruits, 47.56% (39/82) of ELISPOT-positive new recruits and 17.07% (14/82) of CLEIA-positive new recruits had not BCG scars. Conclusion There was low correlation and poor agreement between two methods of IGRA assays and PPD skin test, but IGRA may be more accurate methods for screening TB infection in countries with high coverage of BCG vaccination, the sensitivity of ELISPOT is higher than that of CLEIA.
Latent tuberculosis/diagnosis; Interferon-gamma release tests; Tuberculin test; Enzyme-linked immunospot assay; Immunoenzyme techniques
10.3969/j.issn.1000-6621.2015.07.006
“十二五”国家重大科技专项(2013ZX10003003-005);“十二五”全军医学科研重点项目(BWS11J050);北京市科技创新基地培育与发展工程专项项目(Z141107004414021)
100091 北京,解放军第三〇九医院全军结核病研究所 全军结核病防治重点实验室 结核病诊疗新技术北京市重点实验室
吴雪琼,Email:wu-xueqiong@263.net
2015-03-05)

