神经营养素-3基因转染小胶质细胞及其表达
张福杰,戚超,赵夏,邢明磊,毕昆巍,于腾波
(青岛大学附属医院骨科,山东 青岛 266003)
神经营养素-3基因转染小胶质细胞及其表达
张福杰,戚超,赵夏,邢明磊,毕昆巍,于腾波
(青岛大学附属医院骨科,山东 青岛 266003)
目的 用神经营养素-3(NT-3)基因转染小胶质细胞并检测其表达情况。方法 小胶质细胞分离纯化后,分为非转染组、空转染组及转染组,非转染组小胶质细胞不经质粒转染,空转染组及转染组分别将空质粒pcDNA3.1及真核重组质粒pcDNA3.1/NT-3转染小胶质细胞。然后经过G418筛选后,采用RT-PCR方法检测3组小胶质细胞中的NT-3 mRNA水平,酶联免疫吸咐法(ELISA法)检测各组细胞培养液的吸光度值及NT-3蛋白的浓度。结果 RT-PCR检测显示,转染组可得到一250 bp的基因片段。ELISA法检测显示,转染组细胞培养液的吸光度值明显高于非转染组及空转染组,差异有显著性(F=57.23,t=14.28、12.93,P<0.05)。转染组细胞培养液NT-3蛋白浓度亦明显高于非转染组及空转染组,差异有显著性(F=49.56,t=15.32、11.47,P<0.05)。结论NT-3基因成功转染小胶质细胞,并获得高效表达。
神经营养素-3;转染;小胶质细胞
神经营养素-3(NT-3)是神经营养素家族的重要一员,是一种相对分子质量较小的蛋白质,广泛分布于中枢及外周神经系统,不仅在神经系统的发育和分化过程中起重要作用,而且对于损伤神经元的轴突再生和功能恢复起着至关重要的作用[1]。小胶质细胞是神经胶质细胞的一种,它相当于中枢神经系统的巨噬细胞,在中枢神经系统损伤或炎症时增殖并聚集于受损部位,发挥神经保护和神经损伤的双重作用[2]。本实验通过脂质体介导真核重组质粒转染小胶质细胞的方式将NT-3基因转入小胶质细胞,并检测小胶质细胞中NT-3基因的表达水平,为将来转基因小胶质细胞应用于脊髓损伤治疗的研究奠定基础。
1 材料与方法
1.1材料
妊娠Fisher大鼠(青岛市药检所),真核重组质粒pcDNA3.1/NT-3(北京赛百盛生物工程公司),细胞培养基、Lipofectamine 2000(Invitrogen公司),胰蛋白酶、G418(Sigma公司)。
1.2实验方法
1.2.1小胶质细胞的分离、培养、纯化 取妊娠Fisher大鼠,无菌条件下取出胚胎,在解剖显微镜下将胚鼠颅骨剥去,完整取出胎脑,去除脑膜和血管,用PBS缓冲液冲洗后剪去脑干,仅留大脑半球和大脑(胼胝体予以保留)。脑组织转移至小瓶中剪碎,反复轻柔吹打,经胰酶消化后将滤液注于离心管,加入DMEM/F12完全培养液终止消化,离心10 min弃去上清液,沉淀物静置30 min,以差速贴壁去除成纤维细胞。吸取细胞悬液20 mL,接种于细胞培养瓶中,置于37 ℃、体积分数0.05 CO2条件下培养24 h。用D-Hanks溶液配制盐酸利多卡因注射液至浓度为12 mmol/L,调整pH至7.3待用。吸除混合胶质细胞培养瓶中的培养液,加入已配制的盐酸利多卡因溶液,继续培养10 min,轻轻摇晃2 min,显微镜下观察见大量细胞悬浮后,离心收集细胞。将收集的细胞接种于培养瓶中,置于37 ℃、体积分数0.05 CO2条件下继续培养至第2天,完全换液一次,去除未贴壁的细胞,即获得纯化的小胶质细胞。
1.2.2脂质体Lipofectamine 2000介导NT-3转染小胶质细胞 将分离纯化的小胶质细胞经胰酶消化后,重悬于培养液中,调整细胞密度为1×108/L。取2 mL转种于培养皿中,在37 ℃、体积分数0.05的CO2条件下培养24 h后,细胞融合达到80%。将4 μg重组质粒pcDNA3.1/NT-3及10 μL脂质体Lipofectamine 2000分别加入至250 mL的Opti-MEM培养基中,获得溶液A、B。将A、B液混匀后置于室温下 20 min,将用PBS缓冲液再次洗涤的细胞均匀滴加于细胞培养基中,轻轻混匀,在37 ℃、体积分数0.05的CO2条件下培养24 h。用G418对培养液进行筛选,每4 d换液一次,共筛选3次。存活细胞培养、增殖后进行检测。以未经质粒转染的小胶质细胞(非转染组)及空质粒pcDNA3.1转染的小胶质细胞(空转染组)作为对照。
1.3检测指标及方法
1.3.1小胶质细胞NT-3 mRNA水平检测 采用逆转录-多聚酶链反应(RT-PCR)方法。提取重组质粒pcDNA3.1/NT-3转染后的小胶质细胞(转染组)总mRNA,用Invitrogen试剂盒进行RT-PCR,94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸1 min,30个循环,72 ℃延伸5 min。以同样的方法测定非转染组及空转染组的NT-3 mRNA水平。
1.3.2NT-3蛋白的分泌情况检测 采用酶联免疫吸咐法(ELISA法)。3组小胶质细胞用胰酶消化后,按每个培养皿5×105个细胞的标准分别接种到8个培养皿中,分别加入细胞培养液2 mL,然后在37 ℃、体积分数0.05的CO2条件下培养24 h。取3组细胞培养液,用ELISA检测仪测定吸光度值及NT-3蛋白浓度。
1.4统计学方法
2 结 果
2.1各组小胶质细胞NT-3 mRNA水平比较
RT-PCR结果显示,转染组NT-3 mRNA表达呈阳性,可扩增得到一约250 bp的条带,而非转染组和空转染组NT-3 mRNA表达呈阴性(图1)。
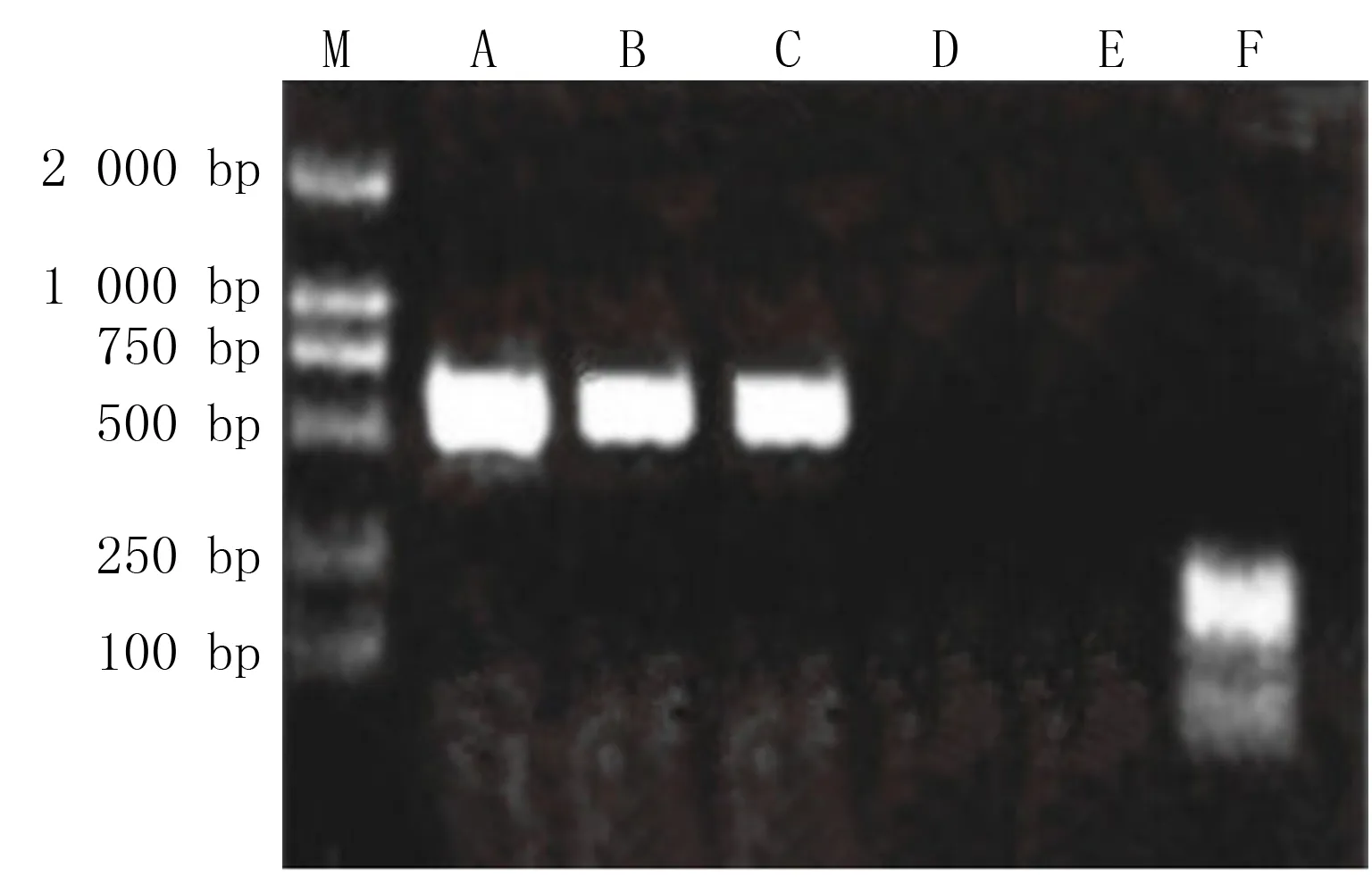
M:Marker;A、B、C分别为非转染组、空转染组及转染组β-actin;D:非转染组小胶质细胞NT-3 mRNA;E:空转染组小胶质细胞NT-3 mRNA;F:转染组小胶质细胞NT-3 mRNA。
2.2各组细胞培养液中NT-3蛋白的分泌情况
ELISA检测结果显示,非转染组、空转染组及转染组小胶质细胞培养液的吸光度值分别为0.59±0.02、0.60±0.03、2.49±0.09,转染组高于非转染组与空转染组,差异有显著意义(F=57.23,t=14.28、12.93,P<0.05);非转染组和空转染组之间比较差异无显著性(t=1.12,P>0.05)。3组细胞培养液的NT-3蛋白浓度分别为(3.93±0.35)、(4.12±0.27)、(15.56±1.05)ng/L,非转染组和空转染组之间比较差异无显著性(t=1.56,P>0.05);转染组高于非转染组与空转染组,差异有显著性(F=49.56,t=15.32、11.47,P<0.05)。
3 讨 论
脊髓损伤是中枢神经系统的一种严重创伤,给家庭和社会造成巨大的精神和经济负担[3]。脊髓损伤后的功能修复一直是医学界的难题,目前人们也在致力于寻求有效的治疗方法攻克这一难题。脊髓损伤后的病理改变有神经元损伤、轴突中断及出血等,近年来研究显示脊髓损伤后功能恢复差的一个重要原因就是神经营养因子缺乏,而其中NT-3的缺乏是一个不可忽视的因素。
NT-3是中枢及外周神经系统神经元发育、分化、存活和再生的重要营养因子。NT-3分泌后能通过p75NTR和Trks受体激活其下游信号通路,促进轴突生长和血管再生,因此,NT-3在脊髓损伤后的功能恢复方面发挥重要作用[4]。WEISHAUPT等[5]研究结果显示,脊髓损伤后NT-3基因表达明显增加,从而有利于脊髓损伤的修复。NT-3可刺激神经前体细胞分化为新的神经元,并促进神经元的存活,还可通过提高细胞Ca2+平衡能力和自由基清除能力,减轻局部缺血及自由基造成的神经元损伤。ZHANG等[6]研究表明,NT-3可以通过抵御中枢神经系统的缺血性或再灌注性损伤,发挥神经系统的保护作用。
小胶质细胞是中枢神经系统重要的免疫细胞,生理条件下处于静止状态,当中枢神经系统受到损伤时,小胶质细胞可经过多种信号途径,如PTK途径、PLA2途径、MAPK超家族的信号转导途径被迅速激活,引发T细胞介导的免疫反应,同时发挥巨噬细胞的吞噬作用,参与炎症、损伤等病理过程。它可以吞噬坏死的细胞及髓鞘,灭活细胞裂解后释放的毒性物质,为神经元提供一个相对适合的微环境,促进组织修复。小胶质细胞在激活T淋巴细胞同时,还可激活中性粒细胞及其他神经胶质细胞,促进细胞因子和生长因子的分泌,从而有利于中枢神经系统损伤组织的再生[7]。于腾波等[8]研究证明,小胶质细胞移植可以促进脊髓损伤大鼠后肢运动功能的恢复。
目前,脊髓损伤治疗的研究中,基因修饰的细胞移植渐成主流。WANG等[9]报道,NT-3基因修饰的骨髓间充质干细胞移植可促进脊髓功能的恢复。施新革等[10]应用阳离子脂质体介导NT-3转染大鼠雪旺细胞,结果显示NT-3基因成功转染雪旺细胞并高效表达。因此,本文尝试将NT-3基因转入小胶质细胞,研究其在小胶质细胞中的表达情况。
本实验RT-PCR结果显示,转染组小胶质细胞NT-3 mRNA水平明显升高,表明转染组小胶质细胞NT-3基因在转录水平上获得良好表达;ELISA法结果显示,转染组细胞培养液吸光度值及NT-3蛋白浓度显著增加,表明转染组小胶质细胞可高效表达NT-3蛋白。本实验从基因转录及翻译水平上检测NT-3基因的表达情况,结果更准确可靠。
综上所述,NT-3基因成功转染小胶质细胞,并获得了高效表达,从而为进一步将NT-3基因修饰的小胶质细胞应用于脊髓损伤的治疗提供了实验依据。但是,NT-3基因修饰的小胶质细胞移植到脊髓损伤部位后,对受损脊髓功能恢复的作用还需要进一步的研究。
[1] LYKISSAS M G, BATISTATOU A K, CHARALABOPOULOS K A, et al. The role of neurotrophins in axonal growth, guidance, and regeneration[J]. Current Neurovascular Research, 2007,4(2):143-151.
[2] 安海勇,程光,白俊清. 小胶质细胞在中枢神经系统损伤作用机制的研究进展[J]. 中国医药导报, 2013,10(9):31-33,39.
[3] 孙中仪,陈伯华,胡有谷,等. 中国脊柱脊髓损伤数据库对急性脊髓损伤病人的分析价值[J]. 青岛大学医学院学报, 2012,48(2):115-117.
[4] 张冉,龙双涟. 神经营养素-3及其在脊髓损伤修复中的作用[J]. 中南医学科学杂志, 2013,41(2):196-200,210.
[5] WEISHAUPT N, MASON A L, HURD C, et al. Vector-induced NT-3 expression in rats promotes collateral growth of injured corticospinal tract axons far rostral to a spinal cord injury[J]. Neuroscience, 2014,272:65-75.
[6] ZHANG J, SHI Q, YANG P, et al. Neuroprotection of neurotrophin-3 against focal cerebral ischemia/reperfusion injury is regulated by hypoxia-responsive element in rats[J]. Neuroscience, 2012,222:1-9.
[7] LOANE D J, BYRNES K R. Role of microglia in neurotrauma[J]. Neurotherapeutics: the Journal of the American Society for Experimental NeuroTherapeutics, 2010,7(4):366-377.
[8] 于腾波,寇德伟,程永帅,等. 活化小胶质细胞移植治疗大鼠脊髓损伤的疗效初探[J]. 中华创伤杂志, 2008,24(5):373-377.
[9] WANG L J, ZHANG R P, LI J D. Transplantation of neurotrophin-3-expressing bone mesenchymal stem cells improves recovery in a rat model of spinal cord injury[J]. Acta Neurochirurgica, 2014,156(7):1409-1418.
[10]施新革,宗海斌,董玉珍,等. 阳离子脂质体介导神经营养因子-3在大鼠雪旺细胞中的表达[J]. 军医进修学院学报, 2011,32(9):956-958,964.
(本文编辑 黄建乡)
作者书写论文分类号须知
为便于论文分类索引,本刊增设论文分类号。按《中国图书馆分类法》(第4版)标注,一般只标注1个即可,若一篇论文涉及多个学科,在主分类号之后还可以标注1~3个相关学科的分类号。论文分类号放在中文关键词的下方,单独起行,不需标注英文分类号。例如:“骨质疏松病人腰背痛情况的临床调查”一文,在关键词下方标注:中图分类号 R681.5+5。请作者来稿时遵照执行。
TANSFECTION OF NEUROTROPHIN-3 GENE TO MICROGLIA AND ITS EXPRESSION
ZHANGFujie,QIChao,ZHAOXia,XINGMinglei,BIKunwei,YUTengbo
(Department of Orthopedics, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
ObjectiveTo transfect neurotrophin-3 (NT-3) gene into microglia and test its expression.MethodsMicroglia were separated, purified and randomized to three groups as non-transfection group, empty-transfection group, transfection group. In non-transfection group, the microglia were not transfected by plasmid, and in empty-transfection group and transfection group, pcDNA3.1 and pcDNA3.1/NT-3 were transfected to microglia, respectively. After G418 screening, the level of NT-3 mRNA in microglia in the three groups was detected using RT-PCR, and the absorbance and NT-3 protein concentration in each group were measured employing enzyme-linked immunoassay sensitive assay (ELISA).ResultsRT-PCR showed a 250 bp segment obtained in the transfection group. ELISA showed that the absorbance in the cell culture fluid in transfection group was higher than that in both non-transfection and empty-transfection groups (F=57.23;t=14.28,12.93;P<0.05), and NT-3 protein concentration was also higher (F=49.56;t=15.32,11.47;P<0.05).ConclusionNT-3 gene was successfully transfected to microglia, and obtained efficient expression.
neurotrophin-3; transfection; microglia
2015-04-29;
2015-08-26
青岛市民生计划项目(13-1-3-26-nsh)
张福杰(1990-),男,硕士研究生。
于腾波(1970-),男,博士,主任医师,博士生导师。
Q784
A
1008-0341(2015)06-0661-03

