尼可地尔对吡柔比星化疗中心脏毒性的预防作用
黄伶茜,吴建语,李绍龙
(钦州市第二人民医院肿瘤科,广西 钦州 535000)
尼可地尔对吡柔比星化疗中心脏毒性的预防作用
黄伶茜,吴建语,李绍龙
(钦州市第二人民医院肿瘤科,广西 钦州 535000)
目的 探讨在非霍奇金淋巴瘤化疗中,应用尼可地尔预防吡柔比星心脏毒性的临床效果。方法 非霍奇金淋巴瘤化疗病人32例,随机分为研究组和对照组,每组16例。两组病人均应用CHOPE方案化疗,研究组加用尼可地尔。于化疗2、4、6个周期后,分别观察两组病人超声心动图、心电图ST段及T波、肌钙蛋白等变化以及非血液性毒性反应。结果 随着化疗周期的延长,两组病人的左心室射血分数(LVEF)均下降,在化疗4、6个周期后,对照组病人的LVEF明显低于研究组(t=9.56、11.26,P<0.05)。化疗6个周期后,对照组病人ST段及T波异常发生率、肌钙蛋白异常发生率明显高于研究组(χ2=6.46、6.46,P<0.05)。两组病人均未出现严重的非血液性毒性反应。结论 尼可地尔能够预防吡柔比星的心脏毒性,且毒副作用可耐受,有望为临床防治吡柔比星的心脏毒性提供一种新方法。
尼可地尔;吡柔比星;淋巴瘤,非霍奇金;药物毒性;心脏;化学预防
柔红霉素作为第一个蒽环类抗癌药物面世后,蒽环类药物在恶性肿瘤的化学治疗中发挥了重要作用,广泛应用于非霍奇金淋巴瘤、胃癌、乳癌、白血病等恶性肿瘤的治疗[1]。吡柔比星(THP)作为重要的蒽环类抗癌药物,其治疗具有明显的剂量-效应线性关系,但是,随着剂量的累积,不良反应的发生率也不断增加,尤其是心脏毒性具有累积效应,影响了THP的长期应用。如何防治THP的心脏毒性,尤其是药物相关性心肌损害的发生,已经成为应用THP需要考虑的首要问题[2]。本研究旨在探讨应用尼可地尔防治THP引起的心脏毒性的临床效果。
1 资料与方法
1.1病例选择
2011年8月1日—2013年8月1日,选择我科收治的非霍奇金淋巴瘤化疗病人32例,诊断均符合《内科肿瘤学》的诊断及疗效标准[1]。其中男22例,女10例,年龄32~70岁,中位年龄47岁。临床分期:ⅡB期3例,ⅢA期3例,ⅣA期20例,ⅣB期6例。均为初治者,ECOG评分为0~1分。既往无心脏疾病。化疗前均无心、肝、肾等重要器官器质性病变,血常规、心电图、超声心动图、心肌酶谱、肝肾功能正常,均无尼可地尔使用禁忌证。将病人随机分为研究组和对照组,每组16例。两组病人一般临床病理特征差异均无统计学意义(P>0.05)。研究经我院伦理委员会批准,并获病人知情同意。
1.2治疗方法
两组病人均接受以环磷酰胺(CTX)、THP、长春新碱(VCR)、泼尼松(Pred)、依托泊苷(VP16)组成的CHOPE方案化疗:CTX 800~1 000 mg/d静滴,第1天;THP 40~70 mg/d静推,第1天;VCR2 mg/d静推,第1天;Pred 60 mg/d口服,第1~7天;VP16 100 mg/d静滴,第1~3天;常规水化碱化利尿。21 d为1个化疗周期,共化疗6个周期。研究组加用尼可地尔片(喜格迈,日本中外制药株式会社生产),每次5 mg,每天3次,从化疗开始前1 d口服,服用至化疗用药结束。
1.3观察指标
分别于化疗前及化疗2、4、6个周期结束24 h检查肌钙蛋白,2 d后复查超声心动图、心电图,观察左心室射血分数(LVEF)、ST段及T波改变、有无心律失常等。评价非血液性毒性反应。
1.4统计学方法
2 结 果
2.1超声心动图变化
随着化疗周期数的增加,两组病人的LVEF均下降,化疗6个周期后与化疗2、4个周期后比较,差异均有显著性(F=10.38、15.46,P<0.01)。在化疗4、6个周期后,对照组LVEF与研究组比较,差异均有显著性(t=9.56、11.26,P<0.05)。见表1。
2.2心电图变化
化疗6个周期后,对照组病人ST段及T波异常的发生率明显高于研究组(χ2=6.46,P<0.05);化疗2、4个周期后,两组差异无显著性。见表2。
2.3肌钙蛋白的变化
化疗6个周期后,对照组病人肌钙蛋白异常发生率高于研究组(χ2=6.46,P<0.05)。见表3。
2.4毒副作用
两组病人的主要非血液性毒性反应有恶心呕吐、血压下降、心率减慢、咳嗽和头痛等,但两组均未出现心率<50 min-1、低血压、Ⅱ~Ⅲ度房室传导阻滞、急性左心衰、严重心律失常和血管性水肿等。两组病人均未出现预期以外的非血液性毒性反应,无病人因不良反应终止化疗、减低剂量或退组。
3 讨 论
THP有稳定的平面四元环,与拓扑异构酶Ⅱ结合后抑制其功能,从而导致脱氧核糖核酸断裂使细胞坏死[3]。在金属离子(例如Fe2+)存在时,THP容易发生氧化还原反应,自由基从氧和(或)类脂分子上游离出来,这些游离出来的自由基与THP的心脏毒性相关。但近年的研究显示,在成熟的心肌细胞中,脱氧核糖核酸复制很少进行。因此,THP引起的心脏毒性可能有其他的机制。目前认为其可能的机制为:①脂质和氧自由基的过氧化作用,这是主要的致病机制;②Fe2+代谢紊乱;③Ca2+减少降低心肌细胞兴奋-收缩耦联反应;④细胞凋亡。THP的心脏毒性按发生的时间可分为急性、亚急性、慢性、延迟性心脏毒性反应。临床主要表现为心功能不全和心律失常[4]。因此,早期对心脏毒性反应进行干预性治疗,减少THP的心脏毒性是十分必要的[5]。本研究旨在探讨尼可地尔对THP所致心脏毒性的保护作用。
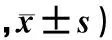
表1 两组病人化疗前后LVEF比较(n=16,χ/%

表2 两组化疗前后心电图ST段及T波异常发生率比较(n=16,χ/%)

表3 两组化疗前后肌钙蛋白异常发生率比较(n=16,χ/%)
尼可地尔是一种人工合成的烟酰胺衍生物,化学名称为N(2-羧乙基)烟酰胺硝酸盐(酯),是一种K+通道开放剂[6]。本文结果显示,在化疗4、6个周期后,研究组LVEF显著高于对照组,提示心功能改善,心肌收缩力增强。尼可地尔可能是通过以下机制发生作用:①激活心肌细胞上三磷酸腺苷调节的K+通道,K+外流增加导致电压依赖性Ca2+通道的活性下降,Ca2+内流减少引起细胞膜除极,持续Ca2+内流减少导致电压依赖性Ca2+通道关闭,促进Na+-Ca2+交换开放,细胞Ca2+外流增加,使缺血区心肌收缩力增强,血管平滑肌舒张,血管阻力下降,改善缺血低氧心肌细胞的血氧供应,从而改善心脏功能;②心肌细胞内的鸟苷酸环化酶被激活,环鸟苷酸浓度增高导致血管平滑肌痉挛减轻,血管舒张,降低心脏前后负荷,抑制心肌肥厚的发生,并在一定程度上逆转心室重构;③直接扩张动、静脉,减轻心脏前后负荷,改善心脏功能;④拮抗二磷酸腺苷诱导的血小板聚集,降低血液黏稠度,改善缺血区的血液供应,提高顿抑心肌的供血供氧,改善心脏代谢[7]。治疗中病人未出现明显不能耐受的不良反应,说明尼可地尔安全、有效。
本文研究结果表明,尼可地尔能够改善THP的心脏毒性,提高含THP方案化疗的非霍奇金淋巴瘤病人的生存质量。但由于本研究为小样本的前瞻性研究,且随访时间较短,尚需要增大样本量进行更长时间研究,以更好地指导临床治疗[8]。另外,对于尼可地尔预防延迟性心脏毒性的作用,正在进一步的随访观察中。
[1] 孙燕. 内科肿瘤学[M]. 北京:人民卫生出版社, 2000:830.
[2] 张明岩,安晶红,紫淼,等. 阿霉素在临床应用中心脏毒性的研究进展[J]. 哈尔滨医药, 2008,28(5):55-56.
[3] FISHER P W, SALLOUM F, DAS A, et al. Phospho dieste-rase-5 inhibition with sildenafil attenuates cardiomyocyte apoptosis and left ventricular dysfunction in a chronic model of doxorubicin cardio toxicity[J]. Circulation, 2005,111(13):1601-1610.
[4] JONES R L, SWANTON C, EWER M S. Anthracyeline eardio toxicity[J]. Expert Opin Drug Saf, 2006,13(5):791-809.
[5] KIM S Y, KIM S J, KIM B J, et al. Doxorubicin-induced reactive oxygen species generation and intracellular Ca2+increase are reciprocally modulated in rat cardiomyocytes[J]. Exp Mol Med, 2006,38(5):535-545.
[6] 张彦,孙道媛,田建会. 尼可地尔对行PCI不稳定型心绞痛病人心肌保护作用[J]. 齐鲁医学杂志, 2013,27(3):238-240.
[7] 周温. 尼可地尔治疗冠心病慢性心力衰竭疗效观察[J]. 海南医学, 2012,23(4):18-20.
[8] 黄文君,赵春亭. 硼替佐米致周围神经病变病人神经生长因子的变化[J]. 青岛大学医学院学报, 2014,50(4):292-295.
(本文编辑 马伟平)
PREVENTION EFFECT OF NICORANDIL ON CARDIOTOXICITY CAUSED BY PIRARUBICIN CHEMOTHERAPY
HUANGLingqian,WUJianyu,LIShaolong
(Department of Oncology, Qinzhou Second People’s Hospital, Qinzhou 535000, China)
ObjectiveTo investigate the application of Nicorandil in preventing cardiotoxicity caused by Pirarubicin in chemotherapy of non-Hodgkin’s lymphoma.MethodsThirty-two patients receiving chemotherapy for non-Hodgkin’s lymphoma were equally randomized to study group and control group. CHOPE chemotherapy regimen was applied to both groups, and Nicorandil was added to the study group. After two, four and six cycles of the therapy, the changes of echocardiogram, ST segment and T wave of ECG, cardiac troponin and other non-blood toxicity were observed.ResultsWith the extension of chemotherapy cycle, left ventricular ejection fraction (LVEF) in both groups declined, and after four and six cycles of the therapy, the LVEF in the control group was much lower (t=9.56,11.26;P<0.05). After six cycles of chemotherapy, the incidence of abnormal ST segment and T wave as well as troponin was higher in the control group than that in the study group (χ2=6.46,P<0.05). No non-hematological toxic reactions were observed in both groups.ConclusionNicorandil, it’s side effects are tolerated, can prevent cardiotoxicity caused by Pirarubicin, and is expected to become a new method for clinical prevention and cure of cardiotoxicity caused by Pirarubicin.
nicorandil; pirarubicin; lymphoma, non-Hodgkin; drug toxicity; heart; chemoprevention
2015-05-18;
2015-08-04
黄伶茜(1981-),女,主治医师。
R733.41
A
1008-0341(2015)06-0644-03

