3D打印钛孔结构与实体钛结构椎体的体外生物力学测试分析
张伟彬 陈扬 杨欣建 白雪岭 杨泽雨 夏晓龙 钱文彬 蓝涛
·实验研究论著·
3D打印钛孔结构与实体钛结构椎体的体外生物力学测试分析
张伟彬 陈扬 杨欣建 白雪岭 杨泽雨 夏晓龙 钱文彬 蓝涛
目的 通过对3D打印钛孔结构与实体钛结构椎体植入猪腰椎后进行体外生物力学测试,评价其活动范围情况及即刻生物力学稳定性。方法 选取18具新鲜成年猪脊柱标本(L1~L6)随机分配到以下三组:对照组(未置换)、钛孔结构椎体置换组(取出L3椎体行钛孔结构椎体植入,简称钛孔结构组)、实体钛结构椎体置换组(取出L3椎体行实体钛结构椎体植入,简称实体钛组)。测试标本的前屈、后伸、侧屈、轴向旋转角位移运动变化。结果 实体钛组、钛孔结构组分别与对照组在各方位角位移运动范围比较,差异均有统计学意义(均P<0.05);钛孔结构组与实体钛组在各方位的角位移运动范围比较,差异均无统计学意义(均P>0.05),且两种固定状态下各方位的即刻稳定指数比较,差异均无统计学意义(均P>0.05)。结论 两种3D打印人工椎体方法均能获得良好的即刻稳定性,但3D打印的钛孔结构人工椎体在融合方面优于实体钛结构。
计算机辅助;成像,三维;钛;修复外科手术;生物力学;内固定器
重度腰椎骨折、结核或肿瘤可致椎体及周围结构严重破坏并造成椎管内硬膜囊及神经根受压[1-3]。临床上,通常需要采用椎体全切术把病变椎体及周围病灶清除,取自体髂骨块或钛笼进行填充重建椎体高度和生物力学稳定性。然而自体髂骨块取材有限,并对骨盆完整性产生影响很大,患者术后多有不适感。钛笼植入有对相邻椎体切割及嵌入椎体的可能[4]。3D打印钛孔结构椎体的设计理念是运用计算机辅助技术结合影像学资料为患者设计高匹配度的个性化人工椎体,通过快速成型技术打印植入物,恢复椎间高度,维持脊柱生理弧度力线,提供受累椎节的初始稳定性及促进骨性融合固定。
2014年深圳市第二人民医院脊柱外科研制了3D打印钛孔结构与实体钛结构的人工椎体。本研究通过对这两种椎体植入猪腰椎后进行体外生物力学测试,评价活动范围情况及即刻生物力学稳定性。
材料与方法
一、研究对象
选用新鲜成年猪脊柱标本18具,各标本的一般资料(大小、年龄等)比较,差异均无统计学意义(均P>0.05)。于胸腰段及腰骶段交界处离断椎间盘、韧带及关节囊,取出L1~L6腰椎标本。保留骨结构、椎间盘、关节囊及所有韧带,剔除标本的肌肉、脂肪等软组织。用咬骨钳咬除标本L1和L6部分关节突、横突及棘突结构。多层保鲜膜包裹标本,置于<-20 ℃冰箱中密封保存。测试前将标本室温放置自然解冻12 h。18具新鲜成年猪腰椎标本数字随机法分为以下三组:对照组(未置换,L1~L6完整猪腰椎标本,6具标本)、钛孔结构椎体置换组(取出L3椎体行钛孔结构椎体植入,简称钛孔结构组,6具标本)、实体钛结构锥体置换组(取出L3椎体行实体结构椎体植入,简称实体钛组,6具标本)[5,6]。
二、置换标本制作方法
行L3椎体全切除术,并刮磨邻近椎体椎间盘及终板,行3D打印钛孔椎体或实体钛椎体置换,不破坏后方韧带复合体,置换后上下两端各2个螺钉与上下椎体固定(图1)。
三、仪器
1. 万能材料试验机 Instron-E10000(中国科学院深圳先进技术研究院)。
2. 光学定位系统 Polaris Hybrid Spectra(中国科学院深圳先进技术研究院)。
3. 若干Marker刚体。
四、实验方法
在对照组、钛孔结构组和实体钛组的各节段椎体通过螺钉固定延伸钢板,在延伸钢板上固定Marker光学定位工具(由4个红外反光小球组成,能追踪椎体6个自由度运动),用自凝牙托粉和自凝牙托水混合均匀后在夹具中包埋两端椎体,并将夹具固定在万能材料试验机上、下端固定,上端施加偏心载荷,使标本产生6个方向的运动[7]。
对标本分别施加前屈、后伸、左侧屈、右侧屈、左旋、右旋6种纯力矩分别为2、2、5、5、8、8 N·m,模拟脊柱生理活动;加载、卸载循环共3次,在第3次加载后进行测试,以消除韧带、关节囊等软组织粘弹性和脊柱蠕变运动的影响,测试过程保持轻柔,以免造成韧带、关节囊或骨结构的损坏[7,8]。利用万能材料试验机和光学定位系统同步记录施加力矩、各节段椎体空间角度的随时间变化曲线,依次测量各节段椎体的运动范围。按以下顺序进行生物力学测试:对照组→钛孔结构组→实体钛组。予生理盐水维持标本湿润,防止组织脱水变性(图2)。
五、观察指标
三组标本在前屈、后伸、左侧屈、右侧屈、左旋、右旋时椎体的角位移运动范围。用即刻稳定指数反映两种人工椎体置换方法的即刻稳定性。即刻稳定指数=(对照组角位移运动范围-人工椎体置换组角位移运动范围)/对照组角位移运动范围[5]。
六、统计学分析

abc图1 3D打印实体钛结构人工椎体(左侧)和3D打印钛孔结构人工椎体(右侧) a:正面观;b:侧面观;c:背面观
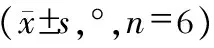
表1 三组标本(L1~L6)角位移运动范围比较
注:与对照组比较,*P<0.05

abc图2 体外生物力学测试 a:对照组;b:钛孔结构组;c:实体钛组
结 果
实体钛组、钛孔结构组分别与对照组在各方位角位移运动范围比较,差异均有统计学意义(均P<0.05)。钛孔结构组与实体钛组各方位角位移运动范围相比,差异均无统计学意义(均P>0.05,表1)。且两组固定状态下各方位的即刻稳定指数比较,差异均无统计学意义(均P>0.05,表2)。
讨 论
传统的椎体全切术,将病灶累及节段椎体切除后填充自体髂骨块,其存在取材不足、植入物易松动和易移位等缺点。Kang等[9]和Lau等[10]研究显示使用钛笼填充同种异体骨替代自体髂骨块,但亦有植入物移位及嵌入椎体等风险。
3D打印人工椎体使用的是由生物相容性高的钛合金材料制成,其特征是:①个性化的优异性能。较自体髂骨块及钛笼而言,3D打印技术制造人工椎体接近患者椎体[11],支撑力学结构更立体,接触表面完全嵌合相邻的椎体,接触面宽,钛孔结构椎体通过多孔结构间填充同种异体骨,足以承受生理载荷,对维持椎间高度起到了重要作用。②接触表面平面化。传统的钛笼植入需术中测量后进行人工修剪钛笼高度,由于两端不齐,其金属切割作用对相邻椎体表面骨皮质造成损害,长期有嵌入椎体的风险。3D打印人工椎体的接触表面采用平面设计,使接触面受力均匀,减少对相邻椎体的切割作用。③内固定的独创性。内固定需要具有提供早期稳定、促进骨性融合的作用,最终脊柱稳定依赖于骨性融合。3D打印人工椎体作为新型的内固定器,由于其能对相邻椎节有良好的支撑和通过上下端两侧孔向相邻椎体置钉固定牢靠,取得良好的即刻稳定性。钛孔结构的设计可诱导骨长入,并具有增强细胞黏附、促进细胞分化等功能[12];骨性融合后能更好地维持脊柱
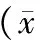
表2 钛孔结构组与实体钛组的即刻稳定指数比较±s,n=6)
长期稳定性。④无钛笼及自体髂骨块移位情况发生。3D打印人工椎体独特的人工椎体-椎体间置钉方式,通过人工椎体上下端两侧孔向相邻椎体置钉,能有效地增加后伸稳定性,避免其向椎管内移位情况发生。⑤缩短手术时间。3D打印人工椎体采用术前设计及制造的方式,减少了自体髂骨块取骨时间、钛笼的测量及修剪时间,减少了术中出血。对于重度腰椎骨折、结核或肿瘤的患者,缩短手术时间和减少术中出血无疑为耗时长的椎体全切术增强了手术安全性。
Kaigle等[13]在解剖学及生物力学方面研究表明:猪的腰椎椎体形态及该节段的脊柱结构与人类相似,一定载荷下,与人的生物力学行为相近,证实了猪脊柱作为离体生物力学测试模型的有效性。本实验结果说明成年猪脊柱标本在3D人工椎体内固定后各方位角位移运动范围减小,两种人工椎体置换后均能提高脊柱在在前屈、后伸、左侧屈、右侧屈、左旋、右旋6个方向的生物力学稳定性;3D打印钛孔结构与实体钛结构椎体在维持脊柱的即刻稳定性方面效果相当。Yang等[14]在山羊颈椎模型上通过EBM技术制作的新型人工椎体能很好地维持颈椎的稳定性,并检测到多孔金属结构中有良好的骨长入。鉴于3D打印钛孔结构设计可诱导骨长入,通过多孔结构间填充同种异体骨,促进人工椎体-椎体间骨性融合,能有效支撑椎间高度及维持脊柱长期稳定性。
综上所述,两种3D打印人工椎体方法均能获得良好的即刻稳定性,但3D打印的钛孔结构在远期骨融合方面优于实体钛结构。另外,本研究只进行了两种人工椎体植入后不同姿态的角位移运动的测定,后期研究还需要完善人工椎体的屈服强度、刚度等生物力学指标测定。对两节段以上的椎体全切术,3D打印钛孔结构人工椎体通过人工椎体-椎体间置钉内固定方式把持力度不够,需要进一步研究通过调整置钉角度联合使用同样置钉于相邻椎体的钢板内固定术的方法。
[1] Eismont FJ, Bohlman HH, Soni PL, et al. Pyogenic and fungal vertebral osteomyelitis with paralysis[J]. J Bone Joint Surg Am, 1983,65(1):19-29.
[2] Kaneda K, Abumi K, Fujiya M. Burst fractures with neurologic deficits of the thoracolumbar-lumbar spine. Results of anterior decompression and stabilization with anterior instrumentation[J]. Spine (Phila Pa 1976), 1984,9(8):788-795.
[3] Knop C, Blauth M, Bühren V, et al. [Surgical treatment of injuries of the thoracolumbar transition. 1:Epidemiology][J]. Unfallchirurg, 1999,102(12):924-935.
[4] 贾龙,郑燕平,刘新宇,等.颈前路减压cage 融合术与自体髂骨块植骨钛板内固定术治疗脊髓型颈椎病的中期疗效[J].中国脊柱脊髓杂志,2011,21(1):28-32.
[5]李晓辉,宋跃明,段宏.颈椎植入性融合器PDLLA Cage的制备及置入山羊颈椎后的体外生物力学分析[J].中国组织工程研究与临床康复,2009,13(52):10211-10217.
[6] 易国良,宋西正,王文军,等.脊柱外固定器治疗相邻双节段腰椎骨折的生物力学测试[J].中国组织工程研究,2013,17(9):1586-1591.
[7] Tai CL, Hsieh PH, Chen WP, et al. Biomechanical comparison of lumbar spine instability between laminectomy and bilateral laminotomy for spinal stenosis syndrome- an experimental study in porcine model[J]. BMC Musculoskelet Disord, 2008,9(14):1-9.
[8] 娄朝晖,陈安民,陈建桥,等.生物陶瓷人工椎体以及脊柱前路解剖型钢板重建椎体的生物力学评价[J].中国组织工程研究与临床康复,2008,12(9):1605-1608.
[9] Kang CN, Cho JL, Suh SP, et al. Anterior operation for unstable thoracolumbar and lumbar burst fractures: tricortical autogenous iliac bone versus tita-nium mesh cage[J]. J Spinal Disord Techniques, 2013,26(7):E265-271.
[10]Lau D, Song Y, Guan Z, et al. Radiological outcomes of static vs expandable titanium cages after corpec-tomy: a retrospective cohort analysis of subsidence[J]. Neurosurgery, 2013,72(4):529-539.
[11] Wu AM, Shao ZX, Wang JS, et al. The accuracy of a method for printing three-dimensional spinal models[J]. PLoS One, 2015,10(4):1-11.
[12] Xue W, Krishna BV, Bandyopadhyay A, et al. Processing and biocompatibility evaluation of laser processed porous titanium[J]. Acta Biomater, 2007,3(6):1007-1018.
[13] Kaigle AM, Holm SH, Hansson TH. 1997 Volvo Award winner in biomechanical studies. Kinematic behavior of the porcine lumbar spine: a chronic lesion model[J]. Spine(Phila Pa 1976), 1997,22(24):2796-2806.
[14] Yang J, Cai H, Lv J, et al.Invivostudy of a self-stabilizing artificial vertebral body fabricated by electron beam melting[J]. Spine (Phila Pa 1976), 2014,39(8):E486-492.
Comparison ofinvitrobiomechanical study of porous and entity 3D printing titanium artificial vertebral body.
ZHANGWeibin*,CHENYang,YANGXinjian,BAIXueling,YANGZeyu,XIAXiaolong,QIANWenbin,LANTao.
*GraduteSchoolofGuangdongMedicalUniversity,Zhanjiang524023,China
CHENYang,E-mail:drchenyang@163.com
Objective To evaluate the range of activity and immediate biomechanical stability through theinvitrobiomechanical test by replacement of the 3D printing porous titanium vertebral body and the 3D printing entity titanium vertebral body in porcine models. Methods Eighteen fresh similar porcine spinal specimens (L1-L6) were divided into 3 groups randomly: control group (without replacement), porous titanium vertebral body replacement group (L3replacement with porous titanium vertebral body), and entity titanium vertebral body replacement group (L3replacement with entity titanium vertebral body). The displacement and angle variation in flexion, extension, left/right lateral bending and left/right torsion were tested respectively. Results The results of displacement and angle variation in porous titanium vertebral body replacement group and entity titanium vertebral body replacement group were significantly different from those in control group in forward flexion, extension, left/right lateral bending (allP>0.05). Comparison of the angle variation displacement in porous titanium vertebral body replacement group and entity titanium vertebral body replacement group showed no statistically significant difference (allP>0.05), and the comparison of immediate stability index between porous titanium vertebral body replacement group and entity titanium vertebral body replacement group was had no significant difference (allP>0.05). Conclusion Two replacement methods of 3D printing artificial vertebral body can guarantee the immediate stability of spine biomechanics, but 3D printing porous titanium vertebral body is superior to entity titanium vertebral body in fusion.
Computer-aided design; Imaging, three-dimensional; Titanium; Reconstructive surgical procedures; Biomechanics; Internal fixators
10.3969/j.issn.1674-8573.2015.06.001
2014年深圳市卫生计生系统科研项目(201401016);深圳市未来产业专项资金(CXZZ20140414170821148)
524023 广东湛江,广东医学院研究生院(张伟彬);深圳市第二人民医院脊柱外科(陈扬、杨欣建、杨泽雨、夏晓龙、钱文彬、蓝涛);中国科学院深圳先进技术研究院 转化医学研究与发展中心(白雪岭)
陈扬,E-mail:drchenyang@163.com
2015-05-10

