参一胶囊联合新辅助化疗对进展期食管癌患者手术风险及预后的影响
周建华
(湖北省十堰市郧阳区中医医院,湖北 十堰 442500)
我国为食管癌高发区,男性和女性食管癌发病率及罹患食管癌的死亡率均居世界第一[1]。食管解剖结构特殊,食管癌早期的症状并不明显,在明确诊断的食管癌患者中,早期患者不足20%,而进展期食管癌患者单纯手术治疗往往预后不良,且外科技术的改进并未改善进展期食管癌患者的术后生存率[2]。随着术前新辅助化学治疗(简称化疗)在临床的不断应用,进展期食管癌患者的生存率明显提高,但化疗不良反应较多,严重影响患者的生存质量。参一胶囊是一种新的中药肿瘤新生血管抑制剂,具有抑瘤作用和抗转移作用[3]。笔者观察并分析了我院普外科应用参一胶囊联合新辅助化疗治疗进展期食管癌患者的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择我院普外科2012年1月至2014年1月收治的进展期食管癌患者207例,参考2009年美国癌症联合会(AJCC)制订的第7版食管癌分期标准[4]进行分期。纳入标准:经影像学检查(钡餐、胸腹部CT、超声胃镜或电子内镜)发现食管及周围占位病变;组织病理学检查明确诊断为食管癌;肿瘤TNM分期为T3~T4a期;均签署知情同意书。排除标准:TNM分期为T1~T2期;凝血功能异常;手术、化疗及相关治疗禁忌证;多次接受放化疗。将207例患者随机分为治疗组99例和对照组108例。治疗组患者中,男65 例,女 34例;年龄 48~76 岁,平均(61.6±7.6)岁。对照组患者中,男70例,女 38例;年龄 50 ~79 岁,平均(63.5 ±8.4)岁。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
两组患者均接受术前食管癌紫杉醇、顺铂方案+根治手术治疗+术后紫杉醇、顺铂化疗方案。第1天予紫杉醇注射液(北京双鹭药业股份有限公司,国药准字H20066640,规格为每支5 mL∶30 mg)静脉滴注,剂量为135 mg/m2;顺铂注射液(齐鲁制药有限公司,国药准字H37021358,规格为每支10 mg)静脉滴注,单次用量30 mg/m2。用药1 d,休息21 d后进行根治手术。根据患者肿瘤情况,采取气管内全身麻醉,切除范围扩展不少于肿瘤上下缘4~5 cm,吻合食管,行食管旁、隆突下、贲门旁、胃小弯侧、胃左动脉旁及腹腔动脉旁淋巴结清扫术。共计经左颈联合胸腔镜、腹腔镜行食管癌根治术94例,经左颈部、右侧胸腹部三切口行食管癌根治术25例,右胸腹部进路行二切口食管癌根治术47例,经左胸单切口进路行食管癌根治术34例,开胸探查术7例。在食管癌根治手术后采取紫杉醇+顺铂方案进行化疗,给予紫杉醇135 mg /m2、顺铂 30 mg/m2静脉滴注,用药 1 d。治疗组患者在此基础上加用参一胶囊(吉林亚泰制药股份有限公司,国药准字Z20030044,规格为每粒10 mg),于第1次化疗前1周开始口服,每次20 mg,每日2次。所有患者均给予对症支持治疗,根据患者病情及手术情况,给予充分的营养支持,观察患者血常规、凝血时间、肝肾功能的变化,及时处理各种并发症,紫杉醇化疗前常规给予抗过敏预处理,顺铂和卡铂化疗时及时给予水化处理,必要时止吐、镇痛。
1.3 观察指标及疗效判定标准
采用世界卫生组织(WHO)关于实体瘤疗效评价标准评价临床疗效,时间节点为术后化疗30 d结束时。完全缓解(CR):患者肿瘤实体完全消失,临床症状好转,无新病灶产生;部分缓解(PR);肿瘤实体最大直径与最大垂直直径乘积较治疗前缩小超过50%,转移淋巴结无变化;无效(SD):肿瘤实体最大直径与最大垂直直径乘积较治疗前缩小不超过50%,增大不超过25%;进展(PD):治疗后肿瘤实体最大直径与最大垂直直径乘积较治疗前增大超过25%。CR+PR=缓解。
观察并记录两组患者的平均手术时间、手术中的平均出血量、术后平均带管天数、平均胸腔积液引流量、胸腔感染、切口愈合情况,围术期并发症次数,肿瘤消退情况。治疗前后检查血常规、肝肾功能和心电图,按化疗药物急性及亚急性毒性分级标准统计,观察并记录骨髓抑制、消化道反应、过敏反应、皮肤反应等临床常见不良反应。随访3年,记录患者肿瘤复发及死亡情况。
1.4 统计学处理
2 结果
结果见表1至表4。
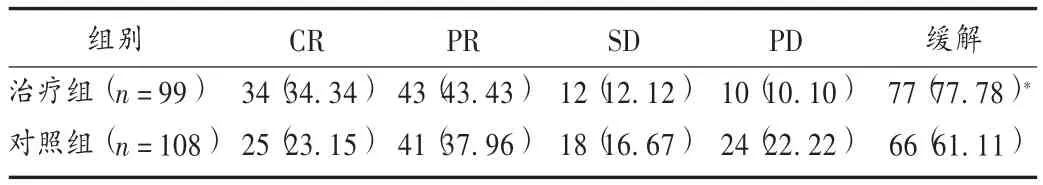
表1 两组患者临床疗效比较[例(%)]
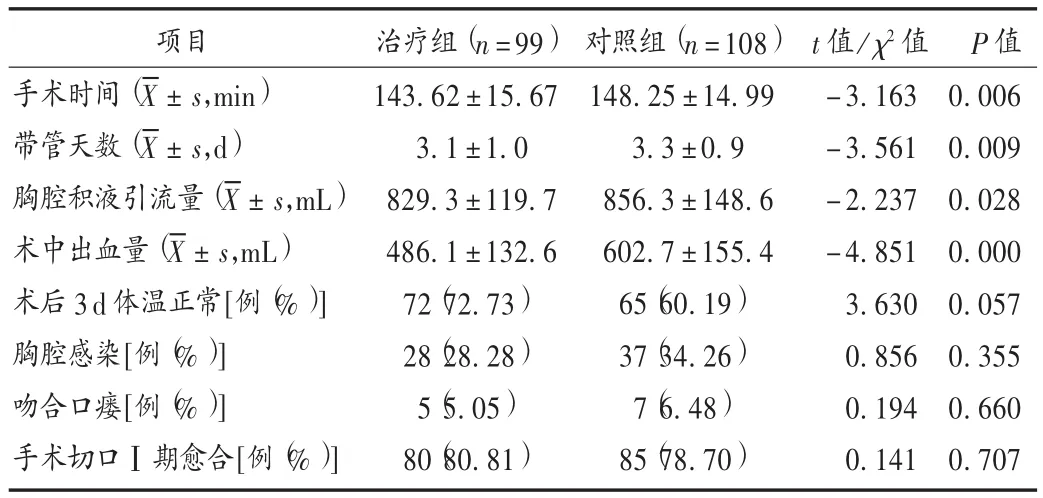
表2 两组患者手术情况比较

表3 两组患者不良反应比较 [例(%)]
3 讨论
随着外科技术的不断进步,食管癌根治术成功率不断上升,但复发转移情况改善不大[4],长期生存率在数十年中并无本质提升,5年生存率不足10%[5]。20世纪90年代,学者们认识到外科手术前后的综合性治疗对于提高食管癌患者的生存率至关重要,故辅助化疗被引入到食管癌的临床治疗[6]。无论哪种方案,其化疗的不良反应,尤其是复治患者存在严重的迟发性和蓄积性骨髓抑制,会造成患者对化疗的耐受性和依赖性较低,目前的研究证实,现有的化疗手段配合中药治疗可达到较好疗效。
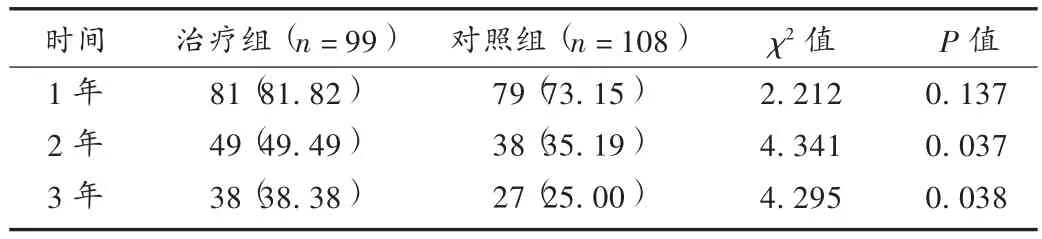
表4 两组患者随访生存率比较 [例(%)]
参一胶囊是具有培元固元、补益气血的功效,通常与化疗联合应用治疗多种癌症[7]。该药以人参皂苷为主要成分,中医认为,人参大补元气、固脱生津、益气养血,是治疗虚证的要药[8]。现代药理学研究证明,人参有抑癌作用,对多种癌症有良好的治疗效果,且能提高免疫功能,减轻化疗药物的不良反应[9]。
本研究结果显示,加用参一胶囊辅助食管癌化疗的患者治疗,围术期情况尤其是手术时间、带管天数、胸腔积液引流量、术中出血量均好于对照组,大量肿瘤细胞被清除,肿瘤对局部组织的浸润、黏连减少,降低了手术的难度。经过综合治疗,患者获得临床缓解的几率增大。本研究中治疗组患者化疗所致骨髓抑制等不良反应基本消失或稳定,且手术中局部组织浸润、黏连减少,有效降低了手术操作中的风险,有利于患者术后康复疗养。且随访发现,治疗组远期疗效明显优于对照组。本研究结果显示,参一胶囊加新辅助化疗方案可降低患者手术风险,围术期应用安全性高,且化疗不良反应可控制。
综上所述,参一胶囊联合常规化疗治疗进展期食管癌能提高临床疗效和患者远期的生存率,改善患者围术期的情况,降低化疗药物的不良反应,值得临床推广。
参考文献:
[1]张思维,张 敏,李光琳,等.2003~2007年中国食管癌发病与死亡分析[J].中国肿瘤,2012,21(4):241-247.
[2]姚食安 .中药防治食管癌前病变[J].中国药业,2001,10(10):53.
[3]Law S,Fok M,Chow S,et al.Preoperative chemotherapy versus surgical therapy alone for squamous cell carcinoma of the esophagus:a prospective randomized trial[J].Thorac Cardiovasc Surg,1997,114(2):210-217.
[4]李 华,刘 辉,吴义言,等.非手术食管癌同步放化疗的临床疗效[J].中国新药与临床杂志,2010,29(12):938-941.
[5]周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,2003:29-30,45-47.
[6]李 贞,陆洪梅,周孟强.紫杉醇联合顺铂治疗晚期食管癌的疗效观察[J].中华肿瘤防治杂志,2005,12(12):957.
[7]Thallinger CM,Kiesewetter B,Raderer M,et al.Pre-and postoperative treatment modalities for esophageal squamous cell carcinoma[J].Anticancer Res,2012,32(11):4 609-4 627.
[8]林洪生,朴柄奎,李树奇.参一胶囊治疗肺癌Ⅱ期临床试验总结[J].中国肿瘤临床,2002,29(4):276-279.
[9]杨 冉,韩金利,张卫民,等.新辅助化疗在进展期食管癌中的疗效分析[J].中国肿瘤临床,2014,41(2):119-122.

