促红细胞生成素与甲基强的松龙对星形胶质细胞的作用研究
郝彦明,王洪震 ,贾正平 ,徐又佳,俞 晨
(1.江苏省昆山市第一人民医院关节科,江苏 苏州 215300; 2.苏州大学附属第二医院骨科,江苏 苏州 215004)
目前,甲基强的松龙(MPSS)是临床治疗急性神经损伤相对有效的药物,对损伤早期有一定效果,但不良反应大、后期效果不佳。因此,对于现阶段交通事故及坠落伤导致的高发疾病神经损伤,迫切需要其他药物以得到更好的救治效果。我科研组通过动物大体研究发现,促红细胞生成素(EPO)对神经系统损伤有明显疗效,其他学者同样发现EPO用于神经损伤早期及后期均能显著降低继发性炎性反应及改善预后等。若将两者联合应用,是否会得到更理想的效果,且以原代细胞为载体研究两者联合应用对神经细胞的作用目前尚未见报道。为此,笔者将MPSS与EPO联用对星形胶质细胞(AST)的作用进行了研究,现报道如下。
1 材料与方法
1.1 材料
器械及仪器:眼科镊,精细刀片,200目滤网,小烧杯,离心管,离心机;37℃恒温摇床,超净工作台,倒置显微镜,匀浆机,高速低温离心机,分光光度仪,聚合酶链式反应(PCR)仪,FR-200型紫外与可见光分析装置。
试药与动物:DMEM/F12培养基(Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶,多聚赖氨酸(Sigma公司);胶质纤维酸性蛋白(GFAP)荧光抗体(Sigma公司);甲基强的松龙(MPSS,Pfizer Manufacturing Belgium NV公司,批号为H20080285);促红细胞生成素(EPO,日本麒麟啤酒株式会社高崎医药工厂,进口药品注册证号J20060040);磷酸盐缓冲液(PBS,自行配制)。新生SD大鼠(苏州大学动物中心提供,动物合格证号SCXK2008-0005);GFAP引物、β-actin引物(生工生物工程<上海>股份有限公司);PCR试剂(Promega公司)。
1.2 方法
星形胶质细胞原代培养:将新生3 d内的SD大鼠静脉血释放、处死,取出大脑(尽量完整),在预冷的PBS中剥离脑膜,并以PBS冲洗3遍(去血细胞及杂质),将大脑切碎,吹打均匀,以1 000 r/min的转速离心10 min,取上清液,再次吹打均匀,10 min后过滤,按1.5×107计数接种于培养瓶(需提前1 d用0.01%多聚赖氨酸包被),置培养箱(5%CO2,95%O2,37 ℃ )中培养,3 d 后换液,8 ~10 d 细胞可分裂增殖满瓶壁,放于摇床(200 r/min,18 h)去除少突胶质细胞和小胶质细胞,换液培养1 d后传代,即得到纯度较高的星形胶质细胞,取培养至第3代、第4代的细胞进行试验。
分组及处理:将试验用细胞分为8组,分别进行如下处理。正常对照组(A1组)细胞传代后培养2 d,弃去培养基,更换新培养基培养;正常细胞+MPSS组(A2组)细胞传代后培养2 d,更换培养基,按 10 μmol/L 将 MPSS 加入并于新的培养基培养[1];正常细胞+EPO组(A3组)细胞传代后培养2 d,更换培养基,按10 U/L将EPO加入并于新的培养基培养[2];正常细胞+MPSS+EPO组(A4组)细胞传代后培养2 d,更换培养基,将 MPSS(10 μmol/L)与 EPO(10 U /L)加入并于新的培养基培养;损伤组(B1组)细胞传代后培养2 d,以PBS代替培养基培养3 h,再换新的培养基培养;损伤细胞+MPSS组(B2组)细胞传代后培养2 d,以PBS 代替培养基培养 3 h,将 MPSS(10 μmol/L)加入并于新的培养基培养;损伤细胞+EPO组(B3组)细胞传代后培养2 d,以PBS代替培养基培养3 h,将EPO(10 U/L)加入并于新的培养基培养;损伤细胞+MPSS+EPO组(B4组)细胞传代后培养2 d,以PBS代替培养基培养 3 h,将 MPSS(10 μmol/L)与 EPO(10 U /L)加入并于新的培养基培养。
星形胶质细胞鉴定:以GFAP鉴定,采用免疫荧光染色并鉴定。免疫荧光显微镜观察可见较明显的细胞形态,待星形胶质细胞培养至第3代,细胞爬片3 d后用PBS洗3次(5 min)后,按荧光染色说明书染色、观察并摄像。
MTT法检测细胞活性:将传代至第3代的细胞吹打均匀后,按照1×106/孔种植于96孔板,待细胞完全贴壁,按照上述分组分别制造试验模型;培养3 d后每孔加入MTT 20 μL,继续培养4 h后,然后每孔加二甲基亚砜(DMSO)150 μL,振动器振荡10 min;在酶联免疫检测仪上选用490 nm波长测定各孔吸光度值,记录结果。
PCR法检测GFAP的表达变化:将上述分组(共8组)细胞分别收集1×106,按PCR仪说明书操作步骤完成。GFAP和β-actin引物序列和扩增产物大小见表1。将各组电泳条带通过Smartview-2001生物电泳图象分析软件进行吸光度分析,可得到试验组与对照组各时间点GFAP mRNA的相对表达量。
1.3 统计学处理
采用SPSS 10.0统计软件处理数据,各组样本均数间比较行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 倒置显微镜下高纯度的星形胶质细胞
通过去纤维、血细胞、杂质,摇床,分离传代方式培养方法,可得到高纯度(纯度超过95%)的星形胶质细胞,待传代至第3代,细胞突触明显变长,相互间交织成网状,细胞纯化度高,基本未见其他杂细胞(见图1 A)。缺营养3 h后细胞形态已发生较明显变化,如大部分细胞胞体变小,突触变短,细胞间相互连接减少或消失,部分甚至呈空泡样,个别细胞萎缩至呈圆形(见图1 B)。
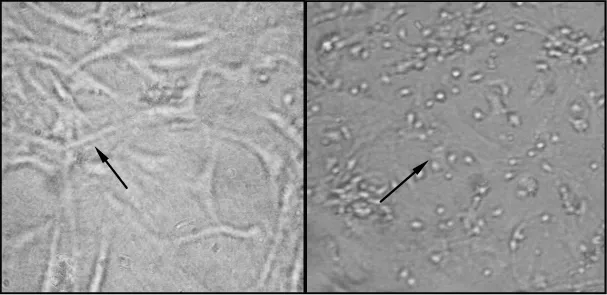
图1 星形胶质细胞倒置显微镜图
2.2 荧光免疫化学染色结果
因GFAP为星形胶质细胞的特异性蛋白,GFAP染色可使星形胶质细胞呈阳性,可清晰显示正常星形胶质细胞:胞体多数为三角形,胞膜光滑,边界清楚,突触长并多数相互连接;DAPI荧光染色可清晰显示细胞核,多为蓝色圆形,GFAP阳性细胞占总细胞数的比例在95%以上(见图2)。
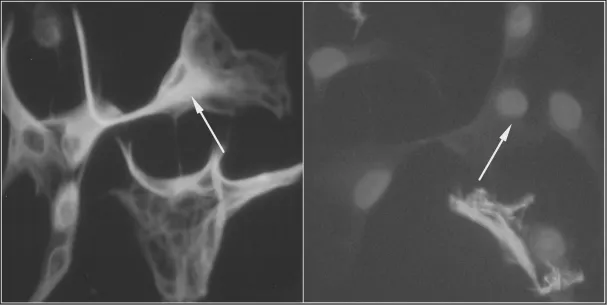
图2 星形胶质细胞荧光免疫化学染色图
2.3 MPSS与EPO对星形胶质细胞活性的影响
结果见表2和表3。可见,B1组与A1组细胞活性有显著性差异(P<0.05),故该细胞损伤模型制作成功;MPSS与EPO联用及两者单用对缺营养损伤后细胞活性有显著性影响(P<0.05),单用MPSS、单用EPO与缺营养损伤后的细胞活性有显著性差异(P<0.05),但单用MPSS与单用EPO组间细胞活性则无显著性差异(P>0.05);MPSS与EPO联用及两者单用对正常细胞活性无显著性影响(P>0.05),单用MPSS与单用EPO组间细胞活性也无显著性差异(P>0.05)。
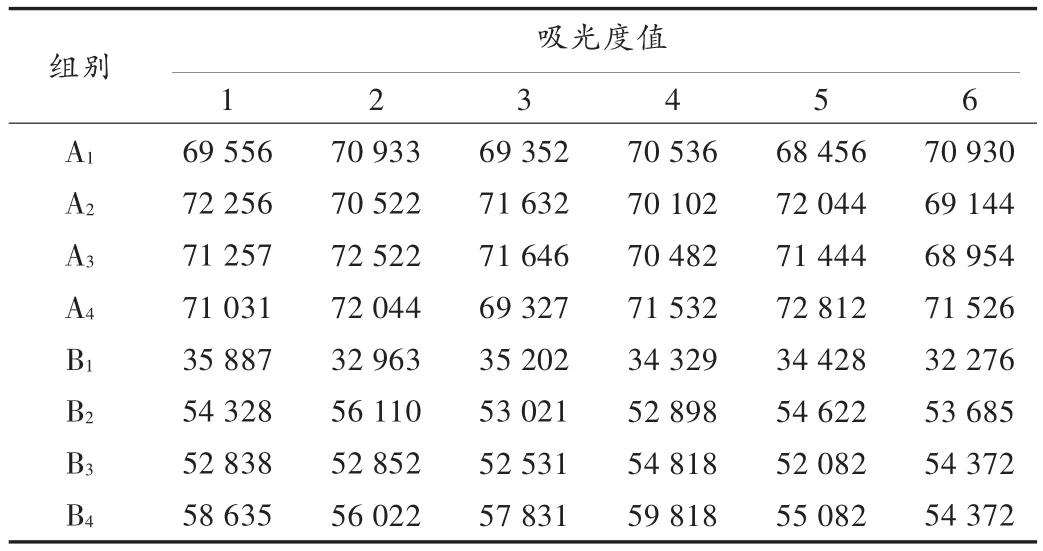
表2 各组细胞活性测定结果(吸光度值,MTT法)
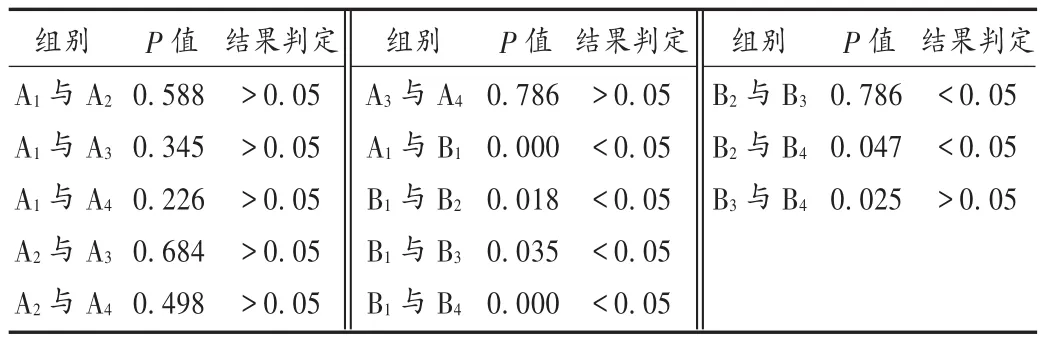
表3 各组细胞活性测定结果比较
2.4 MPSS与EPO对星形胶质细胞GFAP表达的影响
结果见表4、表5及图3。可见,各组细胞 GFAP mRNA表达水平比较,B1组与A1组有显著性差异(P<0.05),故该细胞损伤模型制作成功;B4组比 B1组、B2组、B3组明显升高,B2组、B3组比B1组也明显升高,而B2组与B3组间则无明显差异;A4组比A1组、A2组及A3组均无明显差异;A2组、A3组比A1组及A2组比A3组间也无明显差异。
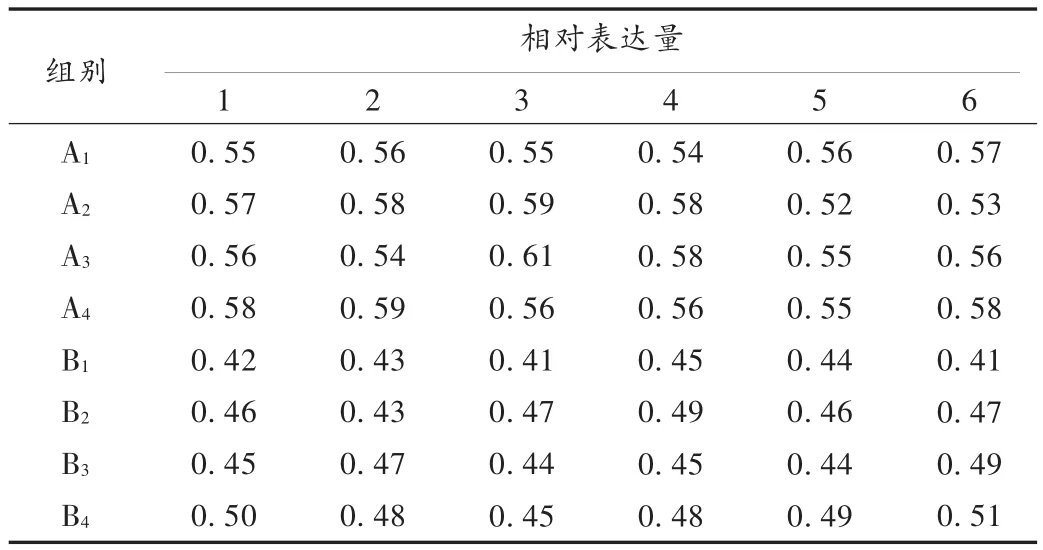
表4 各组细胞GFAP mRNA表达水平测定结果(相对表达量,PCR法)
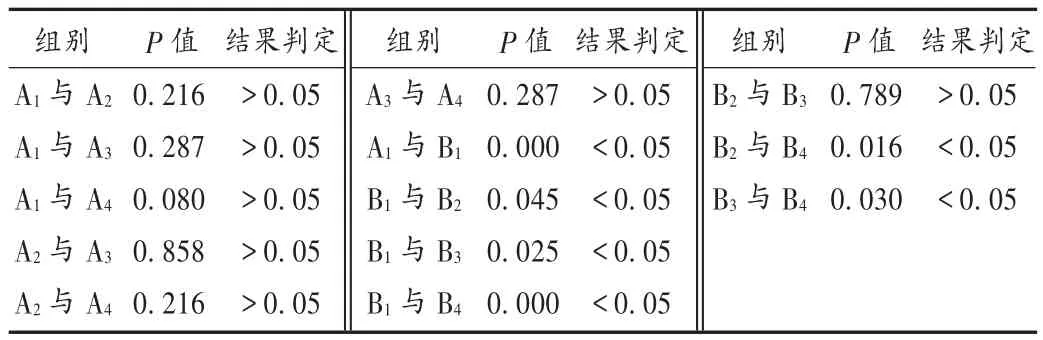
表5 各组细胞GFAP mRNA表达水平比较
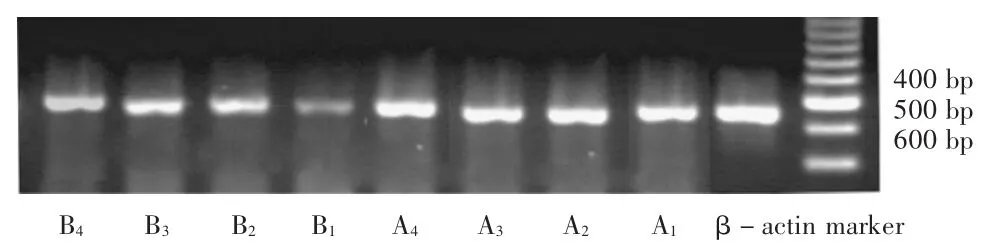
图3 各组细胞GFAP mRNA及βactin的电泳条带
3 讨论
原代神经细胞培养难度大,且细胞纯化难度大,本研究中利用星形胶质细胞在0.01%多聚赖氨酸包被过的培养皿贴附能力大于其他神经细胞的原理纯化得到星形胶质细胞,通过反复吹打洗涤可去除血细胞;脑膜表面的纤维细胞要得到良好去除,必须完整剥离脑膜,故选择乳鼠,迅速完整取出大脑,在PBS内适当浸泡后脑膜与脑实质可较容易分离。试验细胞纯度鉴定采用GFAP。GFAP为特有细胞骨架蛋白,可作为星形胶质细胞生理和病理情况下的特异性分子标志,且可根据其表达评价细胞的损伤程度。已有研究发现,在维持星形胶质细胞的形态结构及功能中,GFAP担任重要作用,若阻滞GFAP的表达,细胞的生长、增殖均受到严重 影响 。Farooque 等[3]与 O′Brein 等[4]报道 ,在 急 性 脊 髓 损 伤(ASCI)模型大鼠可观测到星形胶质细胞体积变大,GFAP含量明显增加。
糖皮质激素对神经系统的作用已有较多研究,但其对GFAP表达及合成的影响研究相对较少。O′Callaghan等[5]发现,糖皮质激素能抑制未损伤大鼠脑组织海马区内GFAP的合成,却不能影响损伤后GFAP合成的增加。EPO对神经系统的作用为目前研究的热点,鉴于神经细胞损伤后除糖皮质激素大量冲击治疗暂无明显有效的药物,但大量糖皮质激素应用后会产生严重不良反应,故许多学者开始研究新的药物或联合应用的效果。Villa等[2]通过动物模型研究证明,外源性的重组人促红细胞生成素(rhEPO)能有效地通过血脑屏障,并能提供神经保护。俞欧[6]认为,rhEPO不仅能纠正肾性贫血,还具有改善细胞营养状态和抗炎作用,局部缺血可产生致炎因子、肿瘤坏死因子、白细胞介素-6,应用rhEPO后炎性因子及肿瘤坏死因子可减少50%以上。Sirén等[7]研究发现,EPO和EPO受体在损伤8~48 h的神经细胞和血管内皮细胞的表达水平明显增加;且在损伤后12~24 h EPO受体上调,到损伤后8 d EPO免疫反应性减少,但显示为EPO阳性的神经元数目未发生变化,并在损伤周围区大量血管显示强EPO受体阳性,而在星形胶质细胞中可见中度的EPO和EPO受体免疫反应性表达;损伤后14 d,虽然血管内皮细胞和神经细胞的EPO免疫反应性极弱,但EPO受体阳性仍持续不变。上述研究可证明,在神经细胞及组织中不仅有EPO及EPO受体表达,且在损伤后表达可明显改变,为EPO应用于损伤神经细胞能够产生药物作用提供了理论依据。
EPO与MPSS联合应用于神经细胞已有学者进行了研究,但存在不少争议,这为进一步的研究提供了思路及研究空间。Gorio等[8]的研究认为,EPO不可与MPSS联用,因为MPSS有可能抑制EPO在脊髓损伤中的某些作用。Cetin等[9]的研究却认为,EPO联合MPSS治疗神经损伤,能更好地提高神经功能恢复并改善组织病理学形态。王望晓[10]对照研究了采用MPSS与鼠神经生长因子对视神经损伤的效果。
本研究中采用的剂量 MPSS 为 10μmol/L[1],EPO 为 10U /L[2],结果显示,MPSS与EPO联用及两者单用对缺营养损伤后星形胶质细胞活性有显著性影响,单用MPSS、单用EPO对缺营养损伤后细胞活性也有显著性影响,但单用MPSS与单用EPO组间细胞活性则无显著性差异;MPSS与EPO联用及两者单用对正常的星形胶质细胞活性无显著性影响,单用MPSS与单用EPO组间细胞活性也无显著性差异。星形胶质细胞表达或不表达或低表达MPSS受体与EPO受体,给予外源性MPSS或EPO时没有相应的受体可结合,不能激活相应的信号通道。而损伤后的星形胶质细胞MPSS受体及EPO受体大量表达,外源性MPSS或EPO可分别与相应的受体结合,其作用途径需进一步探讨。MPSS与EPO联用对缺营养损伤后的星形胶质细胞活性改善比两者单用效果更好,进一步推想,如要得到同样疗效,联用时两者的剂量是否会大大减少,从而可避免两者的严重不良反应,如高剂量MPSS引起的伤口感染、肺炎、败血症乃至死亡等呼吸系统并发症,MPSS的抗炎作用可能对神经再生和轴突萌芽有不良反应,从而加重损伤后神经系统的缺血性坏死。
参考文献:
[1]Schmitt KR,Kern C,Berger F,et al.Methylprednisolone attenuates hypothermia-and rewarming-induced cytotoxicity and IL-6 release in isolated primary astrocytes,neurons and BV-2 microglia cells[J].Neuroscience Letters,2006,404(3):309-314.
[2]Villa P,Bigini P,Mennini T,et al.Erythropoietin selectively attenuates cytokine production and inflammation in cerebral ischemia by targeting neuronal apoptosis[J].J Exp Med,2003,198(6):971-975.
[3]Farooque M,Badonic T,Olsson Y,et al.Astrocyte reaction after graded spinal cord compression in rats:immunohistochemical studies on glial fibrillary acidic protein and vimentin[J].J Neurotrauma,1995,12 (1):41-52.
[4]O′Brien MF,Lenke LG,Lou J,et al.Astrocyte response and transforming growth factor-beta localization in acute spinal cord injury[J].Spine,1994,19 (20):2 321-2 329.
[5]O′Callaghan JP,Brinton RE,McEwen BS.Glucocorticoids regulate the synthesis of glial fibrillary acidic protein in intact and adrenalectomized rats but do not affect its expression following brain injury[J].J Neurochem,1991,57 (3):860-869.
[6]俞 欧.重组人促红细胞生成素对维持性血液透析患者营养状态和微炎症状态的影响[J].中国药业,2012,21(1):6-7.
[7]Sirén AL,Knerlich F,Poser W,et al.Erythropoietin and erythropoietin receptor in human isehemic /hypoxic brain[J].Acta Neuropathol,2001,101 (3):271-276.
[8]Gorio A,Madaschi L,Di Stefano B,et al.Methylprednisolone neutralizes the beneficial effects of erythropoietin in experimental spinal cord injury[J].Proc Natl Acad Sci USA,2005,102 (45):16 379-16 384.
[9]Cetin A,Nas K,Büyükbayram H,et al.The effects of systemically administered methylprednisolone and recombinant human erythropoietin after acute spinal cord compressive injury in rats[J].Neurosurg Spine,2006,15(10):1 539-1 544.
[10]王望晓.鼠神经生长因子治疗视神经挫伤31例[J].中国药业,2013,22(11):53-54.

