siRNA沉默c-FLIP对K562/ADR耐药性的影响
宋 敏,王建宁,孟庆齐,包红雨,杨 杰
(1.南京医科大学第二附属医院血液科,江苏 南京 210011;2.江苏省中医药研究院,江苏 南京 210028)
·论 著·
siRNA沉默c-FLIP对K562/ADR耐药性的影响
宋 敏1,王建宁1,孟庆齐1,包红雨1,杨 杰2
(1.南京医科大学第二附属医院血液科,江苏 南京 210011;2.江苏省中医药研究院,江苏 南京 210028)
目的 探讨c-FLIP siRNA干扰c-FLIP mRNA水平对阿霉素耐药细胞K562/ADR的耐药性的影响及作用机制。方法应用siRNA干扰的方法抑制K562及K562/ADR细胞c-FLIP的表达,通过荧光定量PCR的方法检测c-FLIP mRNA表达及对多药耐药基因MDR1 mRNA水平的影响。MTT法检测c-FLIP干扰与否对K562及K562/ADR细胞增殖的影响,Annexin V/7-ADD双染研究c-FLIP干扰与否对K562及K562/ADR细胞凋亡的影响。结果与阴性siRNA转染组相比较,c-FLIP siRNA转染下调K562细胞中c-FLIP的mRNA后,K562细胞增殖受到一定程度的抑制(P<0.05),但是并未显著诱导细胞凋亡,c-FLIP干扰与否K562细胞48 h增殖率分别为(69.14±1.82)%和(60.69±2.23)%,凋亡率分别为(1.7±0.3)%和(1.8±0.2)%。与阴性siRNA转染组相比较,c-FLIP siRNA转染抑制K562/ADR细胞中c-FLIP的mRNA后,K562/ADR细胞增殖显著被抑制(P<0.05),并显著诱导了细胞凋亡增加(P<0.05),c-FLIP干扰与否K562/ADR细胞48 h增殖率分别为(-6.07±0.71)%和(-37.45±3.53)%,凋亡率分别为(5.2±0.4)%和(9.2±0.4)%。并且c-FLIP siRNA下调c-FLIP mRNA水平后,K562/ADR细胞中的多药耐药基因MDR1的mRNA表达水平也被显著下调(P<0.05)。结论c-FLIP siRNA下调K562/ADR细胞中c-FLIP的mRNA水平抑制了多药耐药基因MDR1的表达,从而抑制了K562/ADR细胞对阿霉素的耐药性。
c-FLIP siRNA;MDR1;K562/ADR;阿霉素耐药
肿瘤细胞对一种药物具有耐药性的同时,对化学结构、细胞靶点不同的抗癌药物同时产生耐药的现象称为多药耐药(Multidrug resistance,MDR),是化疗失败的主要原因之一[1]。目前白血病的药物治疗已经取得了很大进展,然而由化疗药物引起的MDR常导致疗效降低和疾病复发。阿霉素(Adriamycin,ADR)对治疗白血病有良好效果,但在临床使用中常受到自身毒性以及易产生耐药性的限制。因此研究阿霉素耐药的机理并寻找能逆转阿霉素耐药的策略已成为亟待解决的问题[2]。细胞凋亡(Apoptosis)是指细胞遵循自身基因有序调控的主动自杀过程,凋亡障碍是白血病和肿瘤发病和对化疗抵抗的原因之一,凋亡抑制蛋白c-FLIP的在介导白血病化疗耐药中起重要作用[3]。
本文以人白血病细胞K562及其阿霉素耐药株K562/ADR为研究对象,研究c-FLIP siRNA干扰c-FLIP的表达对K562/ADR细胞耐阿霉素的逆转作用,并对其作用机制进行初步探讨。
1 材料与方法
1.1 主要试剂 凋亡检测试剂盒购自Millipore公司,MTT购自Sigma公司。阿霉素购自南京凯基生物公司。RPMI-1640培养基,胎牛血清(Fetal bovine serum,FBS),胰酶消化液(0.25%胰酶+0.02%EDTA)均购自美国Invitrogen公司。Real-time PCR引物由南京金斯瑞公司合成,c-FLIP siRNA引物由广州锐博生物公司合成。细胞凋亡检测试剂盒购自Millipore公司,其他化学试剂均为进口或国产分析纯。
1.2 细胞来源及培养 人慢性白血病细胞K562细胞来源于中科院上海细胞库,采用含10%的胎牛血清,青霉素、链霉素的RPMI-1640培养基置于37℃,5%CO2,饱和湿度的培养箱中培养。阿霉素耐药白血病细胞K562/ADR细胞购自南京凯基生物公司,培养液在K562培养基中加入1 000 ng/ml阿霉素。根据细胞状态及时换液,传代。
1.3 c-FLIP siRNA转染K562或K562/ADR细胞 转染分组:(1)空白对照组:不转染siRNA组;(2)阴性siRNA转染组;(3)c-FLIP siRNA转染组。将对数生长期的2×105的K562或K562/ADR细胞接种于六孔板中,继续培养24 h。将5 μl的Lipfectamine 2 000逐滴加入25 μl的无血清Opti-MEM培养基中,吹打混匀,室温静置5 min,用无血清Opti-MEM培养基将c-FLIP的siRNA稀释一定浓度,然后将转染试剂和siRNA混匀,配成转染复合物。将上述转染复合物逐滴加入培养有K562或K562/ADR细胞的六孔板中,前后左右摇晃混匀。将上述六孔板置于细胞培养箱中继续培养24 h后取一部分细胞接种于96孔板,继续培养24 h或48 h后MTT检测细胞增殖率。另一部分细胞继续培养24 h后,收集细胞进行细胞凋亡分析及荧光定量PCR分析MDR及c-FLIP mRNA水平的改变。
1.4 MTT检测细胞增殖率 取对数生长期的K562或K562/ADR细胞,用相应的培养基配制成细胞悬液按照1×104个细胞100 μl每孔接种到96孔板内。用含1 000 ng/ml阿霉素的培养基将转染后的细胞稀释成一定浓度的细胞悬液并按照1×104个细胞100 μl每孔接种到96孔板内。继续于细胞培养箱中培养24 h或48 h。使用MTT法用酶联免疫检测仪测定波长为570 nm和630 nm处的吸光度值,以每个浓度3个复孔吸光值的平均值作为各浓度的平均值。根据下列公式计算转染c-FLIP与否的K562或K562/ ADR细胞的增殖率,细胞增殖率(%)=(A570nm-A630nm)实验组/(A570nm-A630nm)对照组×100%。
1.5 流式细胞技术检测细胞凋亡率 将K562或K562/ADR细胞种到24孔板,每孔加入5×104个细胞,0.5 ml培养液,37℃和5%CO2过夜培养。c-FLIP或阴性siRNA转染细胞48 h后离心收集细胞,并用预冷的磷酸盐缓冲液(PBS)洗2次。然后将细胞按照1×106/ml的浓度重悬到凋亡检测结合缓冲液中,将100 μl的溶液转移到新的1.5 ml的EP管中。加入凋亡检测试剂,混合均匀,避光室温孵育15 min后再加入400 μl的结合缓冲液混匀,用流式细胞仪测定细胞凋亡率。
1.6 荧光定量PCR检测K562及K562/ADR细胞c-FLIP mRNA水平及多药耐药基因MDR1的mRNA水平 转染c-FLIP与否的K562/ADR细胞培养48 h后,使用Trizol提取RNA并溶解于30 μl RNA酶灭活的双蒸水,立即进行后续实验或置于-80℃低温冰箱冻存。c-FLIP上游引物:5'-TTTACCACCCAGAGACACGC-3',下游引物:5'-AGAACCTCTGCCTGCTGAAC-3'。MDR1上游引物5'-ACCTGTGAAGAGTAGAACATGAAGA-3',下游引物:5'-AATGTTCTGGCTTCCGTTGC-3'。逆转录反应:根据Super Script™ⅢFirst-Strand Synthesis SuperMix for qRT-PCR Kits的说明书进行逆转录反应,逆转录反应条件为:5℃10 min,50℃30 min,85℃5 min,然后加入1 μl的E.coliRNase H在37℃保温20 min。定量PCR反应条件为50℃2 min,95℃3 s,60℃30 s,总共40个循环。
1.7 统计学方法 采用SPSS13.0软件进行数据处理,计量资料以均数±标准差(±s)表示,采用t检验,P<0.05表示差异有统计学意义
2 结 果
2.1 c-FLIP siRNA下调了K562及K562/ADR细胞c-FLIP的mRNA水平 K562及K562/ADR细胞分别转染阴性siRNA及c-FLIP siRNA 48 h后,提取细胞总RNA,荧光定量PCR检测c-FLIP的mRNA水平,检测c-FLIP siRNA的干扰效果。如图1所示,c-FLIP siRNA转染K562及K562/ADR细胞均能显著下调c-FLIP的mRNA水平(P<0.05)。
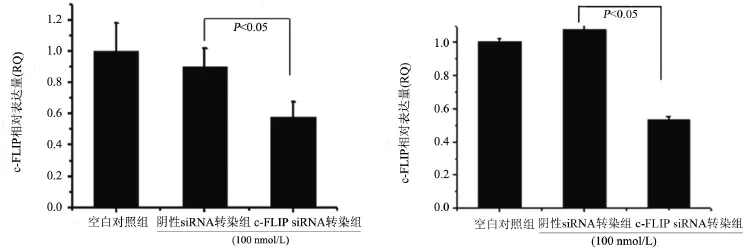
图1 c-FLIP siRNA转染K562(左)或K562/ADR(右)细胞48 h后,两种细胞中c-FLIP的mRNA表达水平
2.2 c-FLIP干扰诱导了K562/ADR细胞增殖抑制 K562及K562/ADR细胞分别转染siRNA及c-FLIP siRNA24 h、48 h后通过MTT细胞活力检测两种细胞在转染siRNA前后的增殖率。如表1中所示。在K562细胞中,阴性siRNA转染对K562的增殖没有影响,而在K562/ADR细胞中转染阴性siRNA抑制了K562/ADR细胞增殖(P<0.05),可能是由于K562/ADR细胞对转染试剂及转染过程比较敏感。c-FLIP siRNA转染K562后与阴性siRNA转染组比较,24 h及48 h增殖率均受到一定程度的抑制(P<0.05),但细胞仍然继续增殖(增殖率为正值),只是速率减缓。c-FLIP siRNA转染K562/ADR后与阴性siRNA转染组比较,24 h及48 h增殖率均呈负值,抑制了细胞生长(P<0.05)。K562/ADR对照组细胞能在含1 000 ng/ml的阿霉素的培养基中正常增殖,K562/ADR转染c-FLIP siRNA后同样的培养条件却诱导了细胞生长抑制,表明其对阿霉素的敏感性增加,耐药浓度的阿霉素抑制了细胞生长。
表1 c-FLIP siRNA转染后K562及K562/ADR细胞增殖率(%,±s)

表1 c-FLIP siRNA转染后K562及K562/ADR细胞增殖率(%,±s)
注:表示与空白对照组比较,p<0.05;表示与阴性siRNA转染组比较,p<0.05.
组别空白对照组阴性siRNA转染组c-FLIP siRNA转染组K562 (RPMI-1640正常培养基) 24 h 53.22±3.98 53.62±4.07 45.60±3.09ab48 h 67.13±2.80 69.14±1.82 60.69±2.23abK562/ADR (RPMI-1640培养基中添加1 000 ng/ml阿霉素) 24 h 43.36±3.75 9.72±0.61a-14.41±2.94ab48 h 30.92±4.57 -6.07±0.71a-37.45±3.53ab
2.3 c-FLIP干扰诱导了K562/ADR细胞凋亡 为了进一步揭示c-FLIP siRNA转染K562/ADR细胞导致其增殖被抑制是否是由于诱导了K562/ADR细胞发生凋亡。通过Annexin V/7-ADD双染的方法检测了K562及K562/ADR细胞转染c-FLIP siRNA后细胞凋亡情况。如图2中所示,K562转染c-FLIPsiRNA并不诱导K562细胞发生凋亡,而在K562/ADR中转染c-FLIP siRNA[早期凋亡率为(9.2±0.4)%]与转染阴性siRNA[(早期凋亡率为(5.2±0.4)%]相比明显诱导了其发生凋亡(P<0.05)。以上结果均表明,K562/ADR转染c-FLIP siRNA后增加了K562/ADR对阿霉素的敏感性,本身对K562/ADR耐药浓度的阿霉素诱导了细胞发生凋亡并抑制细胞增殖,逆转了K562/ADR对阿霉素的耐药。
2.4 c-FLIP siRNA干扰c-FLIP的表达对多药耐药基因MDR1 mRNA水平的影响 由于白血病化疗失败的主要原因是白血病细胞的多药耐药性(MDR1),其中多药耐药基因(MDR1)的表达在决定白血病细胞耐药中起了关键作用。因此我们推测c-FLIP siRNA转染K562/ADR细胞诱导其增殖抑制及细胞发生凋亡的可能原因是影响了MDR1的表达。因此我们研究了c-FLIP siRNA转染K562/ADR细胞对MDR1基因表达水平的影响,如图3中所示,c-FLIP siRNA转染显著下调了c-FLIP的mRNA水平,MDR1的mRNA水平也显著地被下调了(P<0.05)。

图2 c-FLIP siRNA转染K562或K562/ADR细胞48 h后,AnnexinV/7-ADD双染法检测细胞的凋亡率
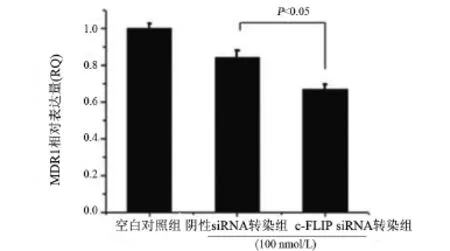
图3 c-FLIP siRNA转染K562/ADR细胞48 h后,荧光定量PCR检测MDR1的mRNA水平
3 讨论
肿瘤多药耐药的机制十分复杂,主要有药物外排泵(MDR1/Pgp、MRP等)的过度表达、药物作用靶点的改变、DNA修复机制活性增强和药物解毒、消除酶的表达增多、凋亡通路阻滞等[4]。在异常的肿瘤微环境中,一方面肿瘤细胞存活、凋亡通路中的激酶和转录调控因子能诱导解毒、转运蛋白(如Pgp等)的表达与活化[5],降低了肿瘤细胞内的药物蓄积浓度;另一方面药物解毒、转运蛋白的过量表达又改变了细胞膜的组成、通透性和细胞内的pH值等,这些变化能抑制细胞的凋亡。因此肿瘤细胞对化疗药物产生耐药性,是肿瘤细胞凋亡水平的异常改变和其他肿瘤多药耐药机制共同作用的结果[6]。
细胞型Fas相关死亡区域蛋白样白介素-1β转换酶抑制蛋白(c-FLIP),是一种新近发现的凋亡抑制蛋白,能强效抑制Fas(CD95/APO-1)、TRAIL(肿瘤坏死因子相关凋亡诱导配体)-R1/R2(DR4/5)、TNFR1(肿瘤坏死因子受体)等死亡受体(DR)诱导的细胞凋亡[7]。研究表明:持续的c-FLIP高表达为肿瘤细胞耐受DR4/5诱导的凋亡和耐药的主要决定因素[8]。使用RNA干扰(RNAi)技术,利用特定的si-RNA使c-FLIP基因沉默,能恢复肿瘤细胞对TRAIL介导的凋亡敏感性和化疗敏感性。此外,研究表明,c-FLIP还在NF-κB、MAPK、PI3-K等细胞增殖、存活通路中亦同样起着重要的调节功能,故称其为“细胞生死存亡(Death and life)的分子开关”[9-10]。
在耐药逆转的研究中,除了以药物外排泵(MDR1/Pgp为代表)等为靶点外,鉴于大多数化疗药物最终通过诱导肿瘤细胞凋亡发挥治疗作用,我们以凋亡通路关键调控蛋白c-FLIP作为靶点恢复肿瘤细胞的凋亡敏感性是非常可行的治疗策略。因此本研究通过RNAi手段抑制蛋白c-FLIP,研究干扰c-FLIP的表达对阿霉素耐药K562/ADR细胞的耐药性改变,以期揭示c-FLIP在介导白血病细胞对阿霉素耐药过程中的作用机理。
本研究显示:c-FLIP siRNA转染K562及K562/ ADR细胞下调c-FLIP的表达后,K562细胞增殖受到一定程度的抑制(P<0.05),但是并未显著诱导细胞凋亡,却明显下调了K562/ADR细胞中耐药基因MDR1的表达水平,并引起了K562/ADR细胞对阿霉素耐药性的改变,显著地诱导了K562/ADR细胞凋亡及增殖抑制。即c-FLIP正常表达情况下,K562/ADR细胞对阿霉素(1 000 ng/ml)耐药,当通过RNAi使c-FLIP表达下调后,耐药基因MDR1水平也被下调,引起了K562/ADR细胞对阿霉素耐药性降低,敏感性增加,从而导致细胞增殖抑制及细胞凋亡。
K562/ADR细胞培养条件始终是RPMI-1640+ 10%FBS+1 000 ng/ml阿霉素。在同样的细胞培养条件下,干扰c-FLIP表达导致MDR1表达下调的K562/ADR细胞与正常的K562/ADR细胞相比对1 000 ng/ml阿霉素敏感性增加了,所以这个浓度的阿霉素能诱导干扰c-FLIP表达导致MDR1表达下调的K562/ADR细胞增殖抑制及细胞凋亡。即干扰c-FLIP能逆转K562/ADR细胞对阿霉素的耐药。
为什么c-FLIP siRNA转染K562及K562/ADR细胞下调c-FLIP的表达后对K562细胞的凋亡没有显著地影响?与阴性siRNA转染组比较,K562细胞24 h及48 h增殖率均有受到一定程度的抑制(P<0.05),但细胞仍然继续增殖(增殖率为正值),只是速率减缓。笔者考虑:实验对K562及K562/ADR细胞分别转染阴性siRNA及c-FLIP siRNA 48 h后,检测c-FLIP siRNA的干扰效果结果表明c-FLIP siRNA转染K562及K562/ADR细胞均能显著地下调c-FLIP的mRNA水平(P<0.05),但其实c-FLIP并没有被完全干扰掉,只是相对明显地下调了。也许这些改变还不足以明显地诱导肿瘤细胞的凋亡,而肿瘤的发生、发展亦是多种因素、多种途径促成的,增殖过度、分化阻滞和凋亡受抑都会引起机体的病理状态,信号转导途径也是纷繁复杂,考虑是否还存在着其他的途径、机理或者其他的干扰因素,使其还不足以非常显著地抑制白血病细胞的凋亡和完全的负增殖。但在耐药细胞的培养基里是含阿霉素的,使用RNAi,c-FLIP表达受抑制,却促进了阿霉素诱导的细胞凋亡,c-FLIP siRNA体现了作为阿霉素诱导白血病细胞凋亡的增敏剂的作用,逆转了阿霉素耐药。
综上所述,本研究揭示了c-FLIP及MDR1在介导K562/ADR对阿霉素耐药中所起的关键作用,初步阐释了c-FLIP siRNA逆转K562/ADR对阿霉素耐药的机制是通过下调c-FLIP以及多药耐药基因MDR1的表达来实现的。本研究对于阐释白血病的预后因素、阿霉素耐药机制以及寻找有应用价值的治疗选择性标志物均具有着十分重要的意义。
[1]叶建涛,郑义磊,刘德育.蛇葡萄素对K562/ADR细胞耐药性的逆转作用机制研究[J].中国中药杂志,2009,34(6):761-764.
[2]Wang L,Meng Q,Wang C,et al.Dioscin restores the activity of the anticancer agent adriamycin in multidrug-resistant human leukemia K562/adriamycin cells by down-regulating MDR1 via a mechanism involving NF-κB signaling inhibition[J].J Nat Prod,2013,76(5):909-914.
[3]Park SJ,Kim MJ,Kim HB,et al.Sensitization of imatinib-resistant CML cells to TRAIL-induced apoptosis is mediated through down-regulation of Bcr-Abl as well as c-FLIP[J].Biochem J,2009, 420(1):73-81.
[4]Green DR,Kroemer G.Pharmacological manipulation of cell death:clinical applications in sight?[J].J Clin Invest,2005,115(10):2610-2617.
[5]Garcia MG,Alaniz LD,Cordo Russo RI,et al.PI3K/Akt inhibition modulates multidrug resistance and activates NF-kappaB in murine lymphoma cell lines[J].Leuk Res,2009,33(2):288-96.
[6]Roepe PD.PH and multidrug resistance[J].Novartis Found Symp, 2001,240:232-247.
[7]Safa AR,Pollok KE.Targeting the anti-apoptotic protein c-FLIP for cancer therpy[J].Cancers(Basel),2011,3(2):1639-1671.
[8]Wilson TR,Mclaughlin KM,McEwan M,et al.c-FLIP:A key regulator of colorectal cancer cell death[J].Cancer Res,2007,67(12):5754-5762.
[9]Lavrik IN,Golks A,Riess D,et al.Analysis of CD95threshold signaling:Triggering of CD95(FAS/APO-1)at low concentrations primarily results in survival signaling[J].J Biol Chem,2007,282(18):13664-13671.
[10]Lavrik IN,Krammer PH.Life and death decisions in the CD95system:main pro-and anti-apoptotic modulators[J].Acta Naturae, 2009,1(1):80-83.
Effect of siRNA-mediated silencing of c-FLIP on adriamycin-resistance of K562/ADR cells.
SONG Min1,WANG Jian-ning1,MENG Qing-qi1,BAO Hong-yu1,YANG Jie2.1.Department of Hematology,the Second Affiliated Hospital of Nanjing Medical University,Nanjing 210011,Jiangsu,CHINA;2.Jiangsu Province Institute of Traditional Chinese Medicine,Nanjing 210028,Jiangsu,CHINA
ObjectiveTo investigate the effect of silenced c-FLIP mRNA level by small interfering RNA (siRNA)on adriamycin-resistance of K562/ADR cells.Methodsc-FLIP siRNA and negative siRNA were transfected into K562 and K562/ADR cell lines respectively,and mRNA expression of c-FLIP and multi-drug resistance gene 1 (MDR1)were detected by quantitative PCR.Cell proliferation rate was detected by MTT assay,and cell apoptosis rate was assayed by Annexin V/7-ADD double-staining method.ResultsCompared with negative siRNA transfection group,siRNA transfection significantly decreased c-FLIP mRNA expression in K562 cells(P<0.05)and slightly inhibited the proliferation of K562 cell(not enough to induce K562 cell apoptosis).The 48 h proliferation rates of K562 cells were(69.14±1.82)%and(60.69±2.23)%in negative siRNA transfection group and siRNA transfection group, and the apoptosis rate were(1.7±0.3)%and(1.8±0.2)%,respectively.c-FLIP siRNA transfection significantly inhibited K562/ADR proliferation and induced cell apoptosis(P<0.05).The 48 h proliferation rate of K562/ADR cells were (-6.07±0.71)%and(-37.45±3.53)%in negative siRNA transfection group and siRNA transfection group,and the apoptosis rate were(5.2±0.4)%and(9.2±0.4)%,respectively.In addition,MDR1 mRNA expression of K562/ADR was significantly decreased(P<0.05)upon c-FLIP siRNA transfection(P<0.05).Conclusionc-FLIP siRNA transfection significantly decreases mRNAexpression of MDR1 and inhibites the adriamycin-resistance of K562/ADR cells.
Small interfering RNA(siRNA);Multi-drug resistance gene 1(MDR1);K562/ADR;Adriamycin resistance
R96
A
1003—6350(2015)11—1561—05
10.3969/j.issn.1003-6350.2015.11.0560
2014-12-17)
南京医科大学科技发展基金重点项目(编号:2010NJMUZ49)
宋 敏。E-mail:songmin218@163.com