橡子粉同步液化糖化产燃料乙醇的发酵条件优化
张 宁, 蒋剑杨 静, 卫 民, 赵 剑, 陈水根
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042)
·研究报告——生物质能源·
橡子粉同步液化糖化产燃料乙醇的发酵条件优化
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042)
以除去单宁的橡子粉为原料,应用活性干酵母同步液化糖化发酵(SLSF)制备燃料乙醇,并通过单因素试验和正交试验优化发酵条件。结果表明,同步液化糖化发酵技术适用于橡子粉发酵制备燃料乙醇;发酵的最佳条件为:除去单宁的橡子粉20 g,料液比为1 ∶3(g ∶mL),淀粉酶100 U/g,糖化酶3 750 U/g,活性干酵母1.50%;在30 ℃静止发酵120 h,发酵液中的乙醇质量浓度达到106.5 g/L,橡子淀粉的乙醇转化率达到89.36 %。采用橡子粉发酵法制备燃料乙醇与以玉米等粮食作物为原料制备的燃料乙醇质量浓度相当,可以替代粮食作物生产燃料乙醇。
橡子;同步液化糖化发酵;燃料乙醇
可再生能源是可以再生的能源总称,包括生物质能源、太阳能、光能和沼气等。现阶段生物质能是世界第四大能源,仅次于煤炭、石油和天然气,在整个能源系统中占据重要地位。预计到22世纪50年代,全球总能源的40%以上将会由各种生物质所生产,目前生物质燃料包括燃料乙醇、丁醇及生物柴油等[1-3]的研发已经成为世界各国的研究热点,其中非粮淀粉质能源植物是我国发展生物质能源的重要原料,可以替代粮食作物生产生物质燃料,具有重要的研究价值。橡子是壳斗科植物种子的总称[4]。我国的橡子,资源丰富,淀粉含量较高,是理想的生产燃料乙醇的原料。我国年产橡子约60~70亿千克,生产开发尚处于起步阶段[5]。然而以玉米、木薯淀粉等为原料发酵制备燃料乙醇的技术已经成熟,为实现橡实资源能源化转化提供了成熟的技术基础[6-8]。目前淀粉质燃料乙醇的发酵工艺主要有分步糖化发酵(SHF)、同步糖化发酵(SSF)及同步液化糖化发酵(SLSF)[9]。其中分步糖化发酵过程繁琐,可发酵糖损失较多,且分步糖化发酵和同步糖化发酵都需要先将原料液化,此过程能耗大,占生产过程总能耗的30%~40%,而同步液化糖化发酵是将原料在低温条件下同时进行液化、糖化及发酵,发酵过程简单,从而节省液化所需的能耗,降低成本[10-11]。活性干酵母发酵活力稳定性高,较传统的菌种液体培养基活菌浓度重复性好,使用方便,对发酵体系的浓度影响较小。本研究以橡子淀粉为原料,以活性干酵母为发酵菌种,采用同步液化糖化发酵技术制备燃料乙醇,并对发酵条件进行优化,以期为橡子的能源化转化探索新的可行性途径。
1 实 验
1.1 材料与试剂
橡子,安徽滁州沙河集体林场麻栎(QuercusacutissimaCarruth.);淀粉酶(2 000 U/g),国药集团化学试剂有限公司;糖化酶(100 000 U/g),无锡市雪梅酶制剂科技有限公司;菌种为高活性干酵母,湖北宜昌安琪酵母股份有限公司。
1.2 仪器与设备
AT L2P-930型毛细管色谱柱(0.53 mm×18 m),中国科学院兰州化学物理研究所色谱技术研究中心;TG16-WS型高速离心机,长沙湖智离心机仪器有限公司;LS-30型立式压力蒸汽灭菌器,上海东亚压力容器制造有限公司;GSP-9080MBE隔水式恒温培养箱,上海博迅实业有限公司医疗设备厂;双人双面洁净工作台,上海博迅实业有限公司医疗设备厂;UV1102型紫外-可见分光光度计,上海天美科学仪器有限公司。
1.3 实验方法
1.3.1 橡子粉制备 橡子风干后脱壳,得到橡子仁,粉碎后过425 μm筛。采用水提法除去橡子粉中的单宁,即用原料质量10倍的水在60 ℃水浴中浸提6 h,再用原料质量5倍的水清洗3次,每次清洗后经滤纸抽滤(真空度0.1 MPa),50 ℃烘干。用此方法除去单宁后,橡子粉中单宁质量分数小于1.50%,以此制得除去单宁的橡子粉原料备用。
1.3.2 单因素试验 取20 g除去单宁的橡子粉,加入水、酶及酵母,在500 mL三角瓶中混合均匀,放入恒温培养箱内,30 ℃下进行发酵。间歇振荡,定时称量,记录CO2失重,估计发酵情况。每24 h取样,将发酵液在6 000 r/min的条件下离心5 min,取上清液,检测发酵液中乙醇浓度。初始实验条件为料液比(除去单宁橡子粉与水的比)1 ∶3.0(g ∶mL) ,液化时加入淀粉酶100 U/g,糖化酶2 250 U/g,活性干酵母0.75%。分别考察料液比(1 ∶2.0、 1 ∶2.5、 1 ∶3.0、 1 ∶3.50、 1 ∶4.0、 1 ∶4.5)、液化酶(50、 100、 150、 200、 250、 300 U/g)、糖化酶(750、 1 500、 2 250、 3 000、 3 750、 4 500 U/g)和活性干酵母(0.25%、 0.50%、 0.75%、 1.00%、 1.25%、 1.50%)用量对乙醇发酵的影响,在考察某因素用量变化的情况下,其他因素仍按初始条件的用量进行添加,以此避免各因素之间的交互作用。
1.3.3 正交试验 在单因素试验的基础上,以料液比(B)、淀粉酶(C)、糖化酶(D)、酵母(E)为考察因素,设误差项为A,采用L16(45)正交试验考察4个因素对乙醇发酵的影响。
1.4 分析方法
1.4.1 单宁含量的测定 按照国标GB/T 15686—2008[12]测定原料橡子粉中单宁的含量。
1.4.2 淀粉含量的测定 按照国标GB/T 5514—2008[13]测定原料橡子粉中淀粉的含量。
1.4.3 乙醇浓度的测定 发酵液离心后取上层清液,稀释100倍,采用气相色谱法测定乙醇浓度[14]。
1.4.4 乙醇转化率 以除去单宁的橡子粉中淀粉含量计算乙醇转化率。
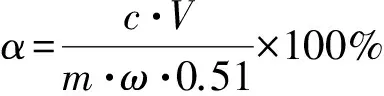
式中:α—乙醇转化率,%;c—发酵液中乙醇浓度,g/L;V—发酵液体积,L;m—除去单宁的橡子粉质量,g;ω—橡子粉中淀粉含量,%; 0.51—淀粉乙醇转化系数。
2 结果与分析
2.1 橡子粉除去单宁前后的变化分析
2.1.1 淀粉及单宁含量 橡子仁含有丰富的营养成分:粗淀粉50%~60%、可溶性糖2%~8%、蛋白质3%~6%、粗纤维3%~5%、粗脂肪1%~5%、单宁5%~12%[5]。其中单宁是植物产生的一种化学结构复杂的多元酚衍生物,易溶于水,能沉淀溶液中的蛋白质,对微生物具有广谱的抑制性。而本研究中所用的淀粉酶、糖化酶及酵母细胞的主要成分都是蛋白质,单宁对其均存在不同的抑制作用从而影响橡子淀粉的水解及发酵。所以在进行发酵之前,必须首先除去橡子粉中的单宁,解除单宁对发酵的影响;水浸提过程在除去单宁的同时,也除去了可溶性糖,所以在发酵过程中,可发酵糖主要来源于橡子淀粉。本研究采用的麻栎橡子含淀粉59.23%、单宁7.82%,还含有少量的蛋白质、粗脂肪和可溶性糖,除去单宁后淀粉增加至70.12%,单宁降低至1.13%。
2.1.2 形态 橡子粉除去单宁前后电子扫描显微镜拍摄的形态变化如图1所示。从图1(a)和(b)中可以看出,除单宁前橡子粉大都颗粒饱满,且表面光滑;采用水浸提法除单宁后,经过水的浸泡,橡子粉形状变得不规则,部分橡子粉颗粒出现粘连,界限不清晰。
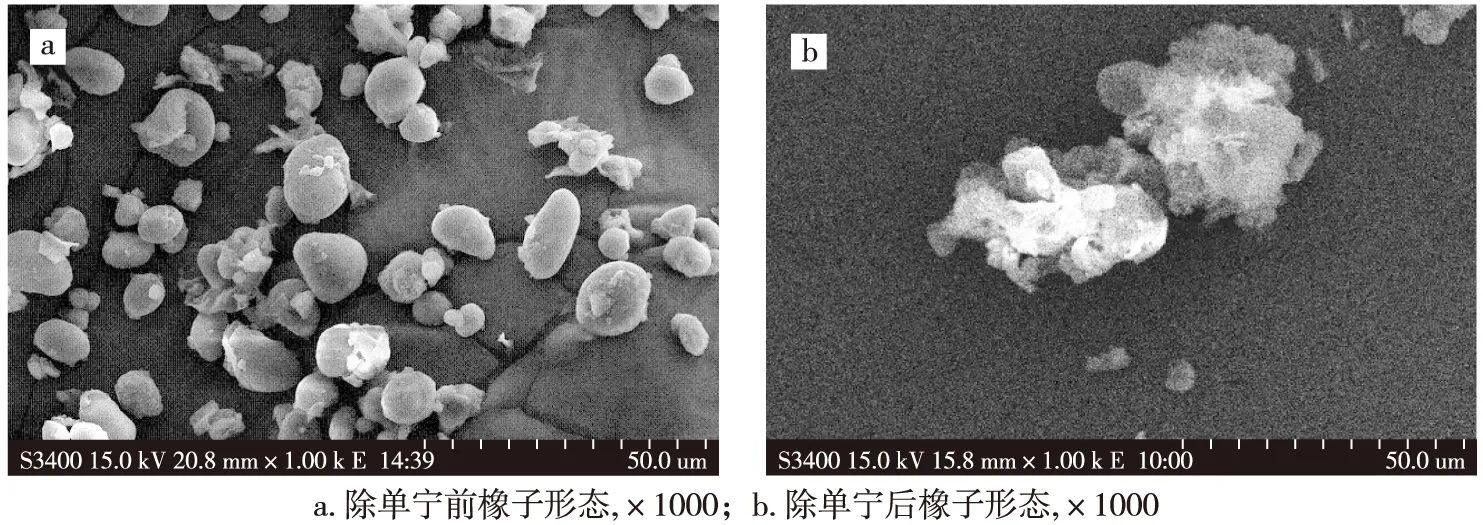
图1 橡子粉除单宁后形态变化比较Fig.1 Morphology of acorn starch before and after extract of tannin
2.2 单因素试验探讨发酵的影响因素
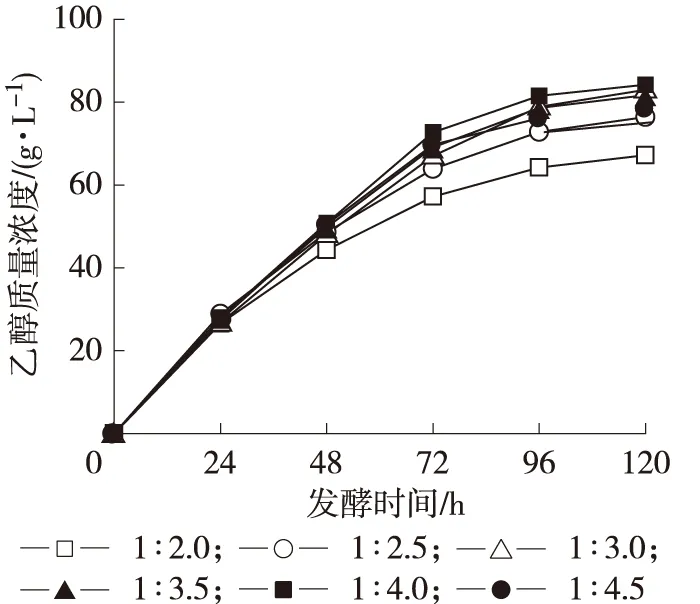
图2 料液比对乙醇发酵的影响 Fig.2 Effect of ratio of solid to liquid on the fermentation of ethanol
2.2.1 料液比 发酵体系中的料液比(g ∶mL)调节在1 ∶2至1 ∶4.5之间,加入水后将料液振荡混匀,置于30 ℃培养箱中发酵120 h。每隔24 h测定发酵液中乙醇质量浓度。实验结果见图2。由图2可以看出,前24 h,发酵体系中的物料主要用于酵母繁殖,同时生产少量乙醇,料液比对酵母的繁殖影响不大,所以乙醇积累情况大致相当;而到发酵后期(72~120 h)发酵体系中的料液比影响物料的传质过程,乙醇对酵母的抑制作用也变大,乙醇积累量差距较大。其中料液比为1 ∶2的条件下乙醇生成量最少,随着料液比的增加乙醇积累量逐渐增加,当料液比增加到1 ∶4的条件下乙醇浓度在发酵后期达到最大;继续增加料液比到1 ∶4.5,乙醇浓度却不再增加,这可能是因为料液比过大,液化酶、糖化酶及酵母浓度下降影响橡子淀粉的糖化、液化及发酵过程,而发酵体系的粘度及流动性也适合乙醇的转化[15]。在试验范围内,最佳料液比为1 ∶3~1 ∶4。
2.2.2 淀粉酶用量 发酵体系中淀粉酶的用量调控在50~300 U/g之间,考察淀粉酶的用量对乙醇发酵的影响。发酵液中淀粉酶用量与乙醇质量浓度的关系见图3。由图3可以看出,淀粉酶的用量对乙醇发酵影响较大。随着淀粉酶用量的增加,乙醇浓度先增加后降低,当淀粉酶用量为100 U/g时,乙醇生成速率和最终积累量达到最大。淀粉酶用量少,橡子淀粉液化速度慢,液化不充分,不利于后续的糖化及发酵;而用量过大,不仅增加生产成本,而且由于对酵母的抑制作用而影响乙醇的发酵。在试验范围内,淀粉酶最佳用量为100 U/g。
2.2.3 糖化酶用量 在确定了淀粉酶用量的前提下,考察糖化酶用量对发酵乙醇的影响。实验考察在糖化酶的用量为750~4 500 U/g的条件下乙醇的积累量,实验结果见图4。结果表明:在实验范围内,糖化酶的用量对乙醇的积累有一定影响,随着糖化酶用量的增加,乙醇的积累量随之增加,当糖化酶用量增加至3 750 U/g,发酵中乙醇的浓度在发酵后期达到最大,再继续增加糖化酶,乙醇浓度变化不大。由于酵母的存在同步液化糖化发酵体系中糖化得到的糖很快被转化为乙醇,所以体系中糖的浓度始终维持在低水平,这样不仅可以避免糖对酶水解的抑制,还可以抑制杂菌的生成,所以橡子淀粉在去除单宁以后并不需要进行高温灭菌就可以进行发酵,即简化发酵工艺,也可以避免高温灭菌造成糖损失。在试验范围内,糖化酶最佳用量为3 750 U/g。
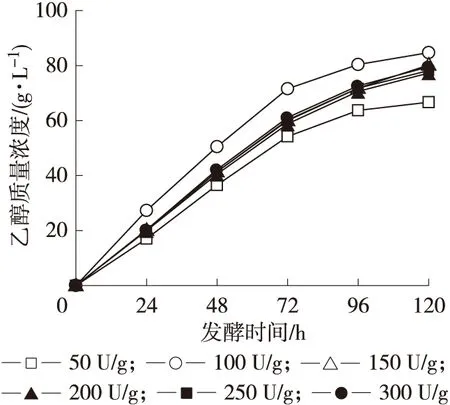
图3 淀粉酶用量对乙醇发酵的影响
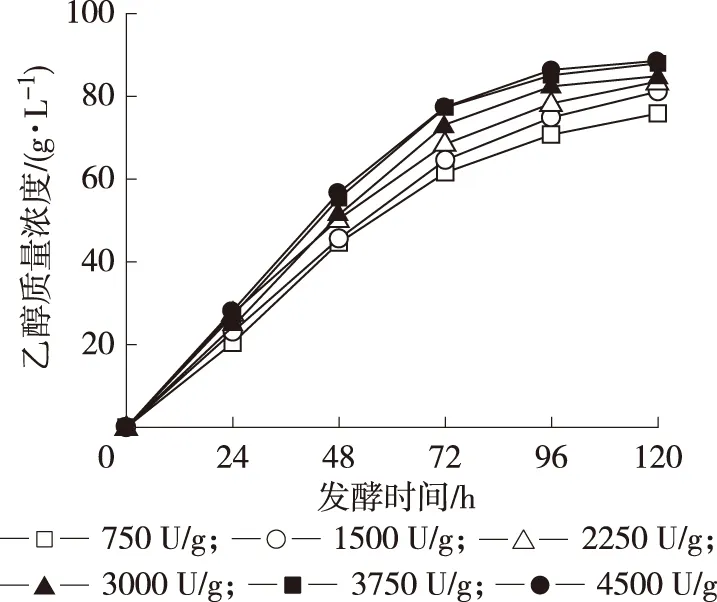
图4 糖化酶用量对乙醇发酵的影响
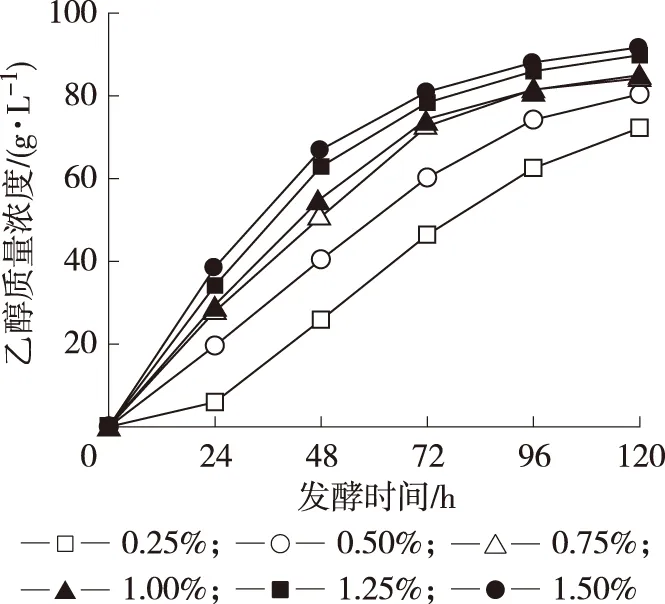
图5 酵母用量对乙醇发酵的影响 Fig.5 Effect of yeast amount on the fermentation of ethanol
2.2.4 酵母粉用量 发酵体系中活性干酵母用量对发酵乙醇影响显著,如图5所示。在添加的干酵母较少(0.25%)的情况下,酵母生长繁殖较慢,同时消耗更多的糖,这就导致在整个发酵周期内乙醇的积累量都较少;随着酵母量的增加,乙醇的生产速度和积累量都迅速增加,直至酵母的用量增加到1.25%~1.50%时,发酵至96 h后乙醇的最终浓度不再显著增加,这是因为产物乙醇的浓度对酵母也有抑制作用,使得发酵反应减缓。在试验范围内,酵母粉最佳用量为1.50%。
2.3 正交试验探讨发酵的影响因素
2.3.1 直观分析 根据以上橡子淀粉同步液化糖化发酵产燃料乙醇的单因素试验结果,以最佳因素水平为中心设置正交试验因素水平,以发酵液中乙醇浓度分析正交试验结果,正交试验设计与结果直观分析见表1。结果表明,在试验范围内,4个因素对乙醇浓度的影响由大到小依次为B>D>E>C,即料液比>糖化酶用量 >酵母用量 >液化酶用量。乙醇发酵的最优条件为B2D3E4C2,即料液比为1 ∶3(g ∶mL),淀粉酶用量为100 U/g,糖化酶用量为3 750 U/g,酵母用量为1.50%。
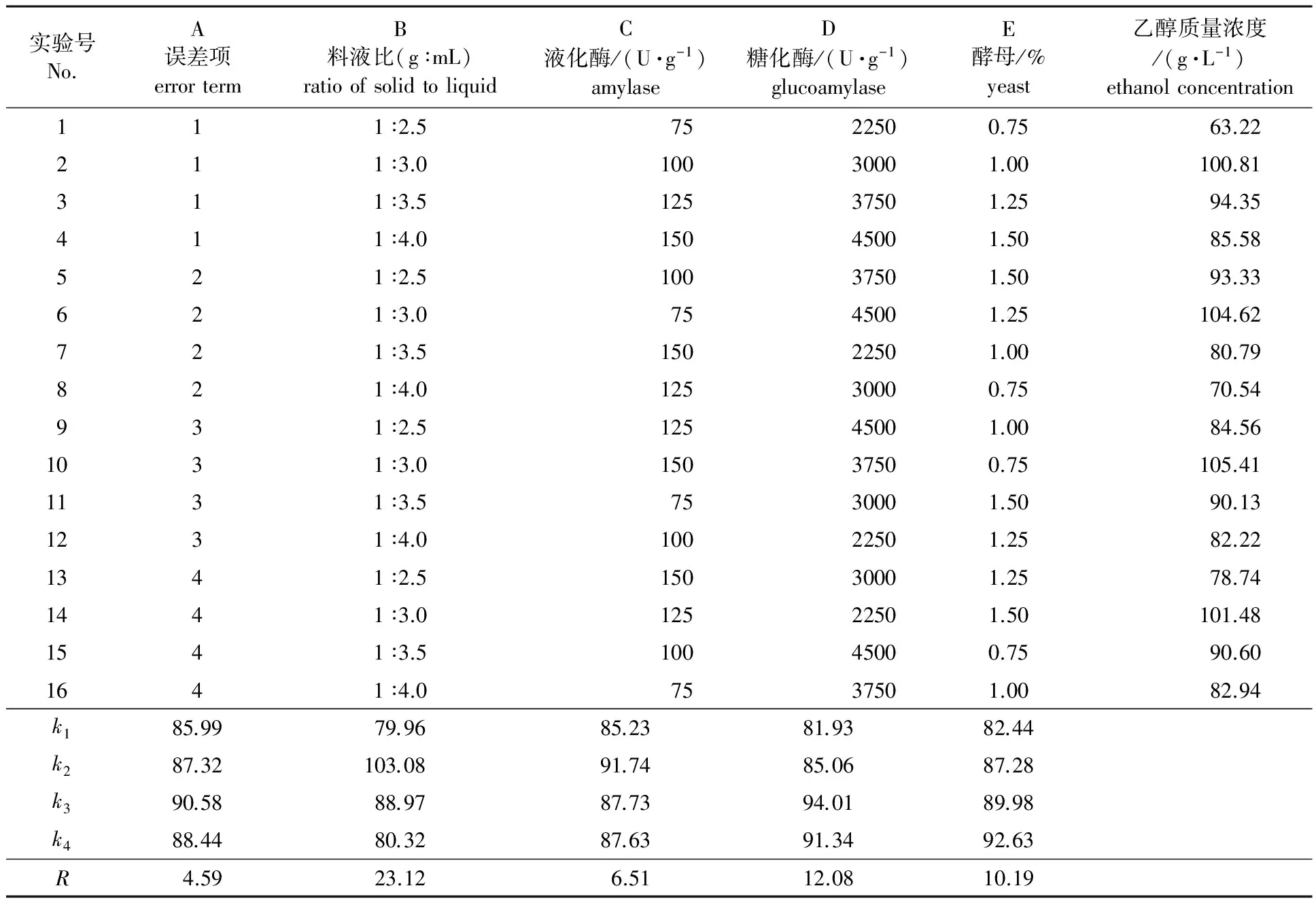
表1 正交试验设计与结果直观分析表Table 1 Orthogonal experiment design and result analysis
2.3.2 方差分析 从表2 正交试验的方差分析结果可以看出,料液比对乙醇产量有高度显著影响(F比>F0.01),糖化酶用量对乙醇产量有一定的影响(F0.05>F比>F0.1),而淀粉酶用量和酵母粉用量对试验结果没有显著影响,所以,本发酵试验条件应该严格控制料液比和糖化酶用量。最优组合并不在正交试验表中,重新以B2D3E4C2为试验条件进行优化试验,经过3次验证,在该发酵条件下乙醇质量浓度达到106.52 g/L;橡子淀粉的乙醇转化率达到89.36%。
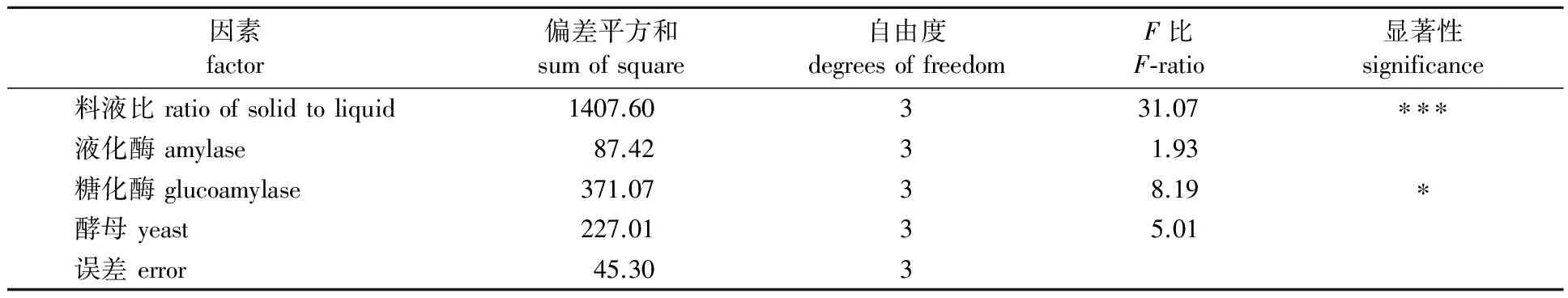
表2 正交试验结果方差分析表Table 2 The variance analysis of the orthogonal experiment results
注:F0.01(3,3)=29.50,F0.05(3,3)=9.28,F0.1(3,3)=5.39;* 表示一般显著,*** 表示高度显著。
由优化实验结果可知采用除去单宁的橡子粉发酵法制备燃料乙醇与以玉米等粮食作物为原料制备的燃料乙醇质量浓度相当[16-17],可以替代粮食作物生产燃料乙醇。同步液化糖化法结合活性干酵母的使用,使得发酵体系中糖浓度始终处于较低的水平,避免了糖对酶水解的抑制作用,同时也抑制了菌体的大量繁殖;酵母的存在使得酶解得到的糖很快被转化生成乙醇。同步液化糖化将液化、糖化及发酵过程结合到一起,不仅减少工艺步骤,还缩短了发酵时间,提高了原料的转化效率。
3 结 论
3.1 橡子粉经水浸提后含单宁1.13%,含淀粉70.12%;除去单宁后橡子粉形状变得不规则,部分橡子粉颗粒出现粘连,界限不清晰。
3.2 采用单因素试验和正交试验优化除去单宁橡子粉的同步液化糖化发酵制备燃料乙醇的发酵条件,所得到的最佳发酵工艺条件为:除去单宁的橡子粉20 g,料液比为1 ∶3(g ∶mL),淀粉酶100 U/g,糖化酶3 750 U/g,活性干酵母1.50%;在30 ℃静止发酵120 h,发酵液中的乙醇质量浓度达到106.5 g/L,橡子淀粉的乙醇转化率达到 89.36 %。采用橡子粉发酵法制备燃料乙醇与以玉米等粮食作物为原料制备的燃料乙醇质量浓度相当,可以替代粮食作物生产燃料乙醇。
[1]EDWARDS M C,DORAN-PETERSON J.Pectin-rich biomass as feedstock for fuel ethanol production[J].Applied Microbiology Biotechnology,2012,95(3):565-575.
[2]KIM I I S,KIM Y S,KIM H,et al.SaccharomycescerevisiaeKNU5377 stress response during high-temperature ethanol fermentation[J].Molecular Cell,2013,35(3):210-218.
[3]SAHA B,COTTA M A.Cotta Ethanol production from lignocellulosic biomass by recombinantEscherichiacolistrain FBR5[J].Bioengineered,2012,3(4):197-202.
[4]杨静,蒋剑春,张宁,等.橡子单宁的超声波提取工艺优化[J].林产化学与工业,2013,33(6):81-84.
[5]杨静,蒋剑春,张宁,等.稀酸法预处理对橡子壳纤维组成和结构的影响[J].生物质化学工程,2014,48(2):13-17.
[6]NUWAMANYA E,CHIWONA-KARLTUN L,KAWUKI R S,et al.Bio-ethanol production from non-food parts of cassava (ManihotesculentaCrantz)[J].Ambio,2012,41(3):262-270.
[7]徐大鹏,冯英,王俊增.木薯半连续同步糖化发酵乙醇[J].中国酿造,2012,31(4):122-125.
[8]沈晖,常亮,封杏子,等.木薯生料发酵制备燃料乙醇的工艺条件研究[J].食品工业,2012,33(4):76-79.
[9]COLLARES R M,MIKLASEVICIUS L V S,BASSACO M M,et al.Optimization of enzymatic hydrolysis of cassava to obtain fermentable sugars[J].Journal of Zhejiang University Science B,2011,13(7):579-586.
[10]SHEN J C,AGBLEVOR F A.Ethanol production of semi-simultaneous saccharification and fermentation from mixture of cotton gin waste and recycled paper sludge [J].Bioprocess and Biosystems Engineering,2011,34(1):33-43.
[11]SALWAL M K,YADAV A,SELWAL K K,et al.Tannase production by Penicillium Atramentosum KM under SSF and its applications in wine clarification and tea cream solubilization[J].Brazilian Journal of Microbiology,2011,42(1):374-387.
[12]国家技术监察局.GB/T 15686—2008高粱 单宁含量的测定[S].北京:中国标准出版社,2008.
[13]国家技术监察局.GB/T 5514—2008 粮油检验 粮食、油料中淀粉含量测定[S].北京:中国标准出版社,2008.
[14]张伟民,陶磊,王芳.小麦生料发酵技术的研究[J].酿酒科技,2013,229(7):75-77.
[15]莫丽春,彭文,曾里,等.木薯粉制备燃料酒精的生料低温水解工艺研究[J].粮食与饲料工业,2012(3):30-34.
[16]马清榜,张建博,田苗,等.玉米燃料乙醇生产新工艺研究[J].创新科技,2014(12):27-28
[17]刘劲松,宫殿良,董克芝,等.玉米与陈化水稻共发酵生产燃料乙醇的研究[J].酿酒,2014,41(5):86-89.
Fermentation Optimization of Fuel Ethanol Producing by Simultaneous Liquefaction,Saccharification and Fermentation from Acorn Flour
ZHANG Ning, JIANG Jian-chun, YANG Jing, WEI Min, ZHAO Jian, CHEN Shui-gen
The fuel ethanol was produced from acron flour by simultaneous liquefaction,saccharification and fermentation (SLSF).The optimum conditions of fermentation by SLSF technology were determined through single factor experiments and orthogonal experiments.The results showed that SLSF technology was suitable for the ethanol fermentation from acorn flour.The optimum conditions were 20 g acorn flour removed of tannin,the ratio of materials to water 1 ∶3,amylase 100 U/g,glucoamylase 3 750 U/g and active dry yeast 1.50%.The ethanol concentration of fermentation broth reached 106.5 g/L after static fermentation for 120 h at 30 ℃,and the conversion rate of acorn starch into ethanol reached 89.36%.The ethanol concentration of fermentation liquor by simultaneous liquefaction,saccharification and fermentation was comparable to the ethanol concentration fermented by corn and other food crops.
acorn flour;simultaneous liquefaction,saccharification and fermentation;fuel ethanol
10.3969/j.issn.1673-5854.2015.04.005
2015-03-12
“十二五”国家科技支撑计划资助(2014BAD02B02);江苏省自然科学基金资助项目(BK2012515);国家自然科学基金资助项目(31100429)
张 宁 (1978—),女,副研究员,博士,主要从事生物质能源及工业微生物研究工作
*通讯作者:蒋剑春(1955—),男,研究员,博士,博士生导师,从事林产化学加工和生物质能源开发技术研究;E-mail:bio-energy@163.com。
TQ352;Q815
A
1673-5854(2015)04-0025-06
(Institute of Chemical Industry of Forest Products,CAF; National Engineering Lab.for Biomass Chemical Utilization; Key and Open Lab.of Forest Chemical Engineering,SFA; Key Lab.of Biomass Energy and Material,Jiangsu Province, Nanjing 210042, China)
——“单宁”

