注射用头孢他啶中吡啶的检测方法研究
肖 燕,龚 浩,易秋艳,何宇新,李 锐
(1.西华大学食品与生物工程学院,四川 成都610039;2.四川省食品药品检验所,成都610039)
注射用头孢他啶中吡啶的检测方法研究
肖 燕1,龚 浩1,易秋艳2,何宇新1,李 锐1
(1.西华大学食品与生物工程学院,四川 成都610039;2.四川省食品药品检验所,成都610039)
目的对注射用头孢他啶中吡啶的检测方法进行研究,为提高该药质量标准、临床配制使用、合理包装贮存及说明书修订等提供参考。方法采用高效液相色谱(HPLC)法,外标以吡啶含量为指标,进行检测方法的线性关系试验、精密度试验及稳定性试验;对样品进行1个月加速试验、影响因素试验,比较该条件下产品质量;对按产品使用说明书中的配制方法配制样品溶液进行稳定性试验,比较头孢他啶中吡啶在不同配制溶液中的含量变化。结果吡啶线性回归方程为Y=168 580X-2 451,R2=0.999 8,在0.055 2~0.661 9 μg内与峰面积线性关系良好;精密度试验吡啶色谱峰面积相对标准偏差(RSD)为0.29%;稳定性试验下,新旧吡啶对照溶液吡啶峰面积RSD为0.40%;影响因素试验,加速1个月试验注射用头孢他啶中吡啶含量均未超出含量限度(0.4%);3种头孢他啶静脉注射溶液随时间的增加吡啶含量均有增加,避光下含量增加幅度略低于不避光,以生理盐水组增加幅度最小。结论通过试验建立了吡啶的HPLC标准工作曲线进行定量检测,其方法可靠,影响因素及加速试验可为该制剂包装贮存提供参考,3种稀释剂配置的注射液稳定性试验可为提高该药质量标准、临床合理配用、说明书的合理科学制定等提供参考。
头孢他啶; 吡啶类; 色谱法,高效液相; 质量控制
头孢他啶(CAZ)为第三代半合成头孢菌素,对多种β-内酰胺酶稳定,对多种革兰阳性菌与阴性菌均有杀菌作用,特别是对铜绿假单胞菌的抗菌作用居头孢菌素之首[1-3]。适用于治疗单一细菌感染、2种及以上细菌引起的混合感染[4]。头孢他啶通常采用以7-氨基头孢烷酸(7-ACA)、7-苯乙酰胺基-3-氯甲基头孢烷酸对甲氧基苄酯(GCLE)为起始原料的合成路线来制备[5-7]。合成路线中涉及有机溶剂吡啶,与头孢他啶的前体物质的化学结合键不是非常牢固,在高温、光照或贮存不当时,其侧链上的杂环可取代基脱落,产生游离吡啶,并在一定条件下发生聚合[8-9],使得药物的抗菌活性下降甚至消失,并可能会引发毒性反应,影响药物稳定性与疗效。国内有关头孢他啶中吡啶的检测方法研究甚少,本文就此进行研究,以期为提高该药质量标准,临床配制使用、合理包装贮存及说明书修订等提供参考。
1 材料与方法
1.1 材料 高效液相色谱仪[Watersalliance(Waters2487-2695)];电子天平[METTLER TOLEDO XP205(d=0.01 mg)-Sartorius BSA2202S-CW(d=0.01g)];pH计(METTLER TOLEDO SevenEasy S20);超纯水仪[MILLIPORE(MILLIPAK0.22 μm)];培养箱(Thermo Scientific FORMA 311;BINDER KB400;MEMMENT LNE500);原研厂葛兰素史克生产的注射用头孢他啶(复达欣);注射用头孢他啶抽检样品。磷酸二氢铵[分析纯(≥99.0%),成都市科龙化工试剂厂];磷酸二氢钾[分析纯(≥99.5%),广东光华化学厂有限公司];磷酸二氢钠[分析纯(≥99.0%),成都市科龙化工试剂厂];吡啶[分析纯(≥99.5%),成都市科龙化工试剂厂];氨水[分析纯(25%~28%),天津天大天发科技有限公司];乙腈[色谱纯(≥99.9%),SIGMAALORICH];甲醇[色谱纯(≥99.9%),Fisher Scientific]。水为超纯水。
1.2 方法
1.2.1 溶液配制 吡啶对照贮备溶液:精密称取吡啶约1 g,置100 mL量瓶中,加水溶解并稀释至刻度,精密量取10 mL,置另一100 mL量瓶中,加水稀释至刻度,于15℃以下贮存。pH7.0磷酸盐缓冲液:称取无水磷酸氢二钠5.68g、磷酸二氢钾3.63g,加水溶解并稀释至1000mL。0.25 mol/L磷酸二氢铵溶液:取磷酸二氢铵57.515 g,用水溶解并稀释至2 000 mL。吡啶对照溶液:临用前精密量取2 mL吡啶贮备液,置于200 mL量瓶中,加pH7.0磷酸盐缓冲液稀释至刻度,作为吡啶对照溶液。供试品溶液:取注射用头孢他啶样品,按标示量加水溶解并定量稀释制成每1毫升含头孢他啶6 mg的溶液,作为待测样品溶液[8]。输液样品溶液:取头孢他啶样品9份,分为三组,每组3份。以使用说明书规定的稀释剂(生理盐水、5%葡萄糖注射液、乳酸钠注射液)为溶剂,分别配制成含头孢他啶20 mg/mL的溶液[10]。
1.2.2 色谱条件与系统适用性试验
1.2.2.1 色谱条件 色谱柱:SPOLAR C18柱(4.6 mm× 250.0 mm×5.0 μm);流动相:乙腈-0.25 mol/L磷酸二氢铵溶液-水(300∶100∶600)用氨溶液调节 pH值至 7.0[12-13];检测波长254 nm;柱温30℃;流速1.0 mL/min;进样量20 μL。
1.2.2.2 系统适用性试验 照高效液相色谱(HPLC)法(《中国药典》2010版二部附录ⅤD)测定,用十八烷基硅烷键合硅胶为填充剂;吡啶峰理论板数应不低于3000。取吡啶对照溶液精密进样高效液相色谱仪,以数次进样结果计算相对标准偏差(RSD)不得超过3.0%[10]。
1.2.3 吡啶含量测定的HPLC法验证[10,14]
1.2.3.1 线性关系考察 取 1.2.1中吡啶对照溶液(0.011 mg/mL)依次进样5、10、20、30、40、60 μL于高效液相色谱仪记录色谱图,积分测定吡啶峰面积。得到6次进样色谱峰重叠图及吡啶进样量与测得的吡啶峰结果,以测得的吡啶峰面积为纵坐标、吡啶进样量为横坐标绘制吡啶的标准工作曲线。
1.2.3.2 精密度试验 取新配制的吡啶对照品溶液精密进样20 μL并重复操作5次,按照1.2.2相同色谱条件记录重复进样色谱结果。以重复进样的吡啶色谱峰面积计算峰面积的RSD值。
1.2.3.3 对照溶液稳定性试验 由于吡啶对照溶液在低温下才稳定,因此,其稳定性试验为在5 d后新配吡啶对照溶液,与之前配制好的在低温下贮存的旧对照溶液分别精密进样20 μL,重复进样3针,记录色谱图与峰结果。
1.2.4 样品影响因素试验[12-14](1)高温试验:取 5批注射用头孢他啶供试品适量,去除外包装,不打开瓶盖,以保持严封完整性。60℃温度下放置10 d后取样测定。(2)高湿度试验:同样取供试品适量,去除外包装,但不打开瓶盖,准确称定试验前的质量,再在25℃分别于相对湿度(90±5)%(干燥器下部放置硝酸钾饱和溶液)条件下放置10 d后取样,同时准确称量试验后供试品的质量,以考察吸湿潮解性能。(3)强光照射试验:将供试品去除外包装,但不打开瓶盖,放在澄明度检测仪下,于照度为(4 500±500)lx的条件下放置10 d(可用其配套的照度计来确定适宜照度所在的高度),于第10天取样。将上述影响因素试验后的样品,分别取样3份以上,按上述1.2.1项下规定方法配制供试样品溶液,按1.2.2项下色谱方法记录头孢他啶中吡啶的色谱峰面积,按外标法计算出其平均含量。
1.2.5 样品加速1个月试验[14]供试品取10批,按市售包装在温度(40±2)℃、相对湿度(75±5)%的条件下放置1个月后取样,按上述供试溶液同法配制,每批次重复测试3次。按1.2.2色谱条件记录各供试品与对照品的色谱图,以此计算吡啶的含量平均值。
1.2.6 临床使用注射用头孢他啶在3种静脉注射溶剂中的稳定性试验[11-14]在注射用头孢他啶说明书中,其注意事项第8项为以生理盐水、5%葡萄糖注射液或乳酸钠稀释头孢他啶制成的静脉注射液(20 mg/mL)在室温下存放不宜超过24 h。故本试验对用上述3种溶液配制的头孢他啶静脉注射溶液进行了日内稳定性考察,分别在避光和正常操作2个水平下,在设定的时间考察点(0.0、0.5、1.0、2.0、4.0、8.0、12.0、16.0、24.0h)分别取对应组别的样品,精密进样20 μL于高效液相色谱系统,同法测定其中吡啶峰面积,以外标法按峰面积计算吡啶含量,探讨在临床使用中样品的稳定性,以及验证药品说明书的科学性与可靠性,为临床使用及说明书修订提高提供参考。按样品吡啶测定方法同法记录以上3种溶液的六组测定结果,并将六组样品测定的吡啶含量与时间绘制吡啶含量变化趋势图。
2 结 果
2.1 吡啶含量测定的HPLC法验证结果
2.1.1 线性关系考察结果 通过线性关系考察,得出回归方程为Y=168 580X-245 1,R2=0.999 8。且理论塔板数均在8 000左右,远大于3 000,见图1、表1。

图1 吡啶线性色谱峰重叠图

表1 吡啶进样量与测得的吡啶峰面积数据表
2.1.2 精密度试验 吡啶对照品溶液色谱峰面积RSD为0.29%,远低于要求的3.00%,见图2、表2。

图2 吡啶精密度试验色谱重叠图
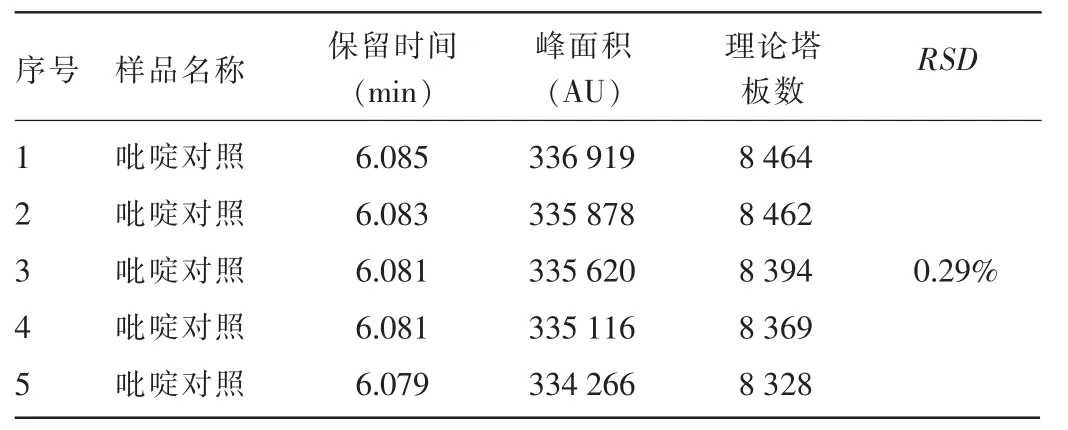
表2 精密度试验吡啶峰结果
2.1.3 稳定性试验 5 d后新配吡啶对照溶液,与之前配制好在低温下贮存的旧对照溶液重复进样的吡啶峰面积均值为337 310,理论塔板均在9 000以上,峰面积RSD为0.40%,见图3、表3。

图3 吡啶对照溶液稳定性色谱图
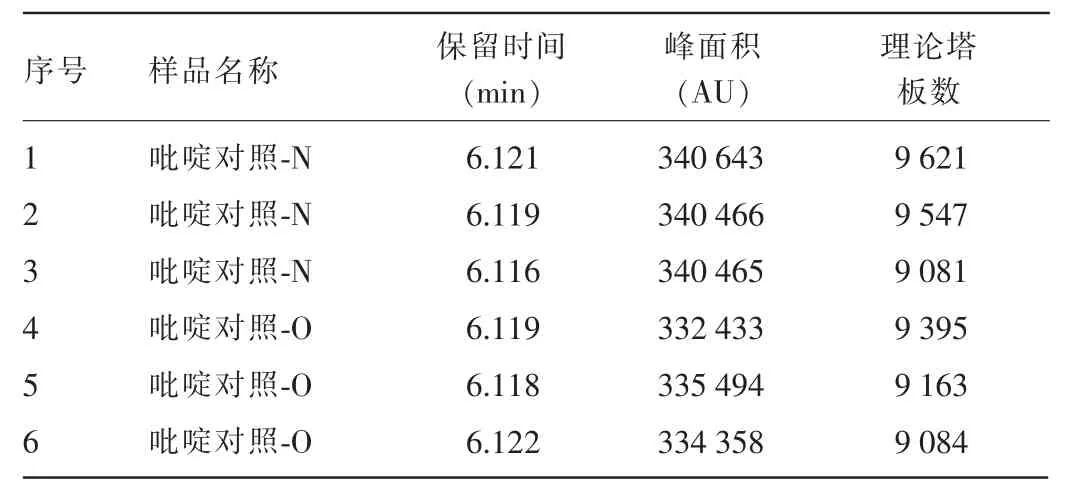
表3 吡啶对照溶液稳定性峰结果
2.2 样品影响因素试验结果 影响因素中高温(60℃)的影响最大,会使注射用头孢他啶中吡啶的含量明显增加;而光照和高湿条件下,注射用头孢他啶中吡啶含量改变不明显,均在限度范围内,部分略有增加,部分反而降低。见表4。
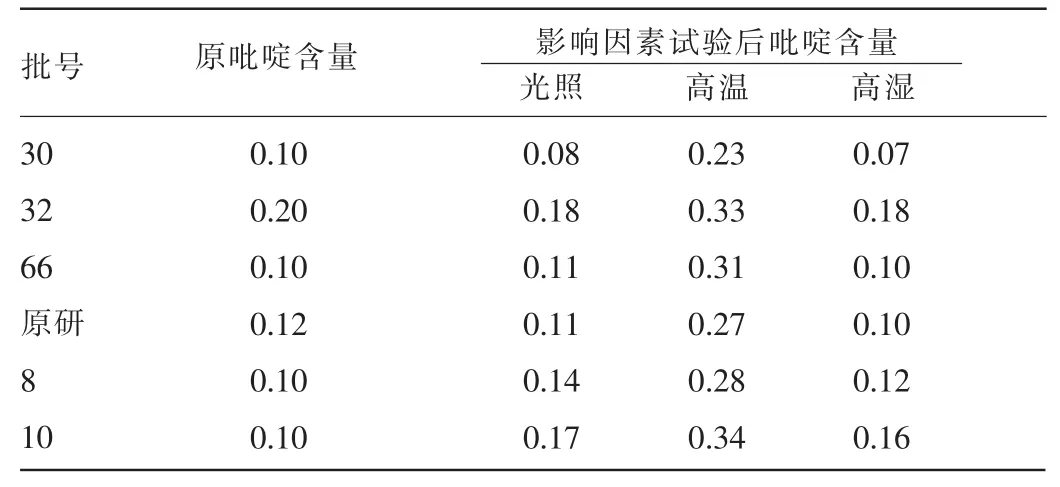
表4 影响因素试验下吡啶含量计算结果(%)
2.3 样品加速1个月试验结果 样品加速1个月试验后,注射用头孢他啶中吡啶含量的改变量均未超出《中国药典》2010版对注射用头孢他啶中吡啶含量限度(0.4%)的规定,该试验中的样品是比较稳定的,但样品在温度(40±2)℃、相对湿度(75±5)%条件下进行了1个月加速试验后,吡啶的含量几乎均有所增加,部分增加幅度接近最初含量的2倍。见图4、表5。

图4 注射用头孢他啶1个月加速试验色谱图

表5 1个月加速试验吡啶含量测定结果(%)
2.4 临床使用注射用头孢他啶在3种静脉注射溶剂中的稳定性试验结果 配制好的头孢他啶静脉注射溶液随放置时间增加,其中的吡啶含量均明显增加,而且几乎呈线性趋势,避光放置下的增加幅度略小于不避光放置溶液,以葡萄糖配制的组别差异稍大;3种溶液比较,生理盐水组中吡啶含量的增加幅度最小,头孢他啶在3种溶液中稳定性依次为:生理盐水、0.5%葡萄糖、乳酸钠。在16 h考察点,除生理盐水外,另外2种溶剂制备的头孢他啶溶液中吡啶含量超限(0.4%),乳酸钠组在12 h考察点的吡啶含量临近0.4%,生理盐水组在24h考察点内的吡啶含量在限度内。见图5、表6。

表6 3种头孢他啶静脉注射液中吡啶含量结果记录
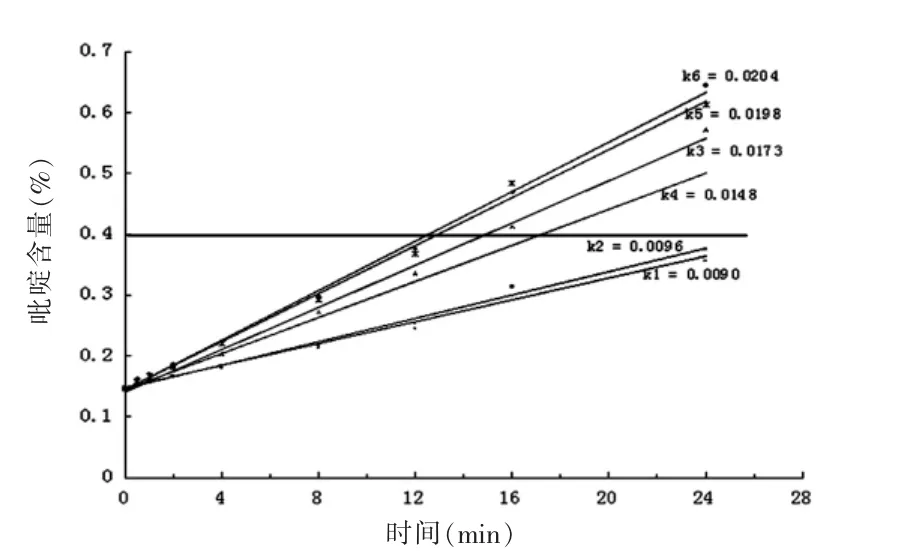
图5 3种头孢他啶静脉注射液避光/不避光吡啶含量变化趋势图
3 讨 论
HPLC法运用于药物分析检测具有高效、精确、快速的特点。本试验通过线性关系考察、精密度及稳定性试验结果表明,本试验所用方法验证成立,精密度良好,测定结果准确可靠,吡啶对照品进样量在0.055 2~0.661 9μg范围内与峰面积线性关系良好,方法稳定可靠;所建立的标准线性曲线可以很好地用于吡啶含量测定,具有参考价值。样品影响因素及1个月加速试验中,温度对该制剂影响最大,其他因素相对次之,加速试验中测得的吡啶含量下降可能由试验中的各种误差因素造成,重复可减小;随着贮存时间增加,吡啶含量也随之增加。提示,在分析检验、运输储存,生产及临床使用中,应尤其注意温度条件,还应控制好湿度、光照及其他条件,以保证药效,减少不良因素导致的不良反应。
在保证药物制剂、生产、存储环节下,临床使用对制剂安全有效性的影响也很关键。本试验由临床常用3种稀释剂配制的头孢他啶静脉注射溶液的稳定性考察结果显示,稀释剂的选择对该制剂的药效具有明显影响,同时,静脉注射液的使用时间对药物疗效也很关键。注射用头孢他啶最好临用新配,在可能的情况下,尽量选择生理盐水避光配制,以减少不良反应。在选择另外2种溶液配制头孢他啶静脉注射液时,应尽量在12 h内使用,以减少降解降低用药风险,保证用药安全与疗效。同时,应对药品使用说明书的表述加以准确细致化、科学化。
本研究对临床使用具有指导意义,可为制剂包装、贮存、检验及质量标准的提高提供参考。从用药安全有效出发,探索头孢他啶质量标准的科学性,以强化药品质量控制、监督与管理,指导临床用药及药品分析检测,保障人民群众用药安全有效,具有重要意义。
[1]苏玉华.头孢他啶的药理作用及不良反应分析[J].中国民族民间医药,2013,22(20):73.
[2]杨静,刘自玲,杨建,等.头孢他啶与钠钾镁钙葡萄糖注射液的配伍稳定性[J].药学与临床研究,2014(4):344-346.
[3]张婷婷,魏增泉.临床研究中的抗生素新药[J].国外医药:抗生素分册,2013,34(6):241-244.
[4]薛雨,陈宇瑛.头孢菌素类抗生素的最新研究进展[J].中国抗生素杂志,2011,36(2):86-92.
[5]宋荣军.头孢他啶药剂研究[J].中外健康文摘,2012,9(1):169-170.
[6]曹国文.头孢他啶注射液与常用注射剂配伍的稳定性[J].临床合理用药杂志,2011,4(12):59-60.
[7]李彬,李永伟,庞艳龙,等.7-氨基-3-(1-吡啶甲基)头孢烯酸氯化物的合成[J].河北化工,2007,30(1):18-19.
[8]李凤侠,王晓艳,王勇进,等.头孢他啶中间体及头孢他啶合成方法[P].山东:CN102391289A,2012-03-28.
[9]屠洁,闫志刚,楼秋霞,等.头孢他啶及其制剂的有关物质分析及稳定性研究[J].中国药科大学学报,2002,33(2):113-116.
[10]国家药典编委会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2010:附录174-176.
[11]张姮婕,孙雪奇,袁军,等.HPLC测定注射用头孢他啶中的有关物质[J].中国抗生素杂志,2013,38(10):752-755.
[12]陆瑶华.头孢他啶在输液中的稳定性[J].华西药学杂志,2007,22(4):478-479.
[13]刘庆堂.三种头孢菌素类药物的输液稳定性影响因素研究[J].中外医学研究,2011,9(35):152-153.
[14]陈宏杰.影响药物制剂稳定性的因素及解决办法研究[J].中国医药指南,2013(19):749-750.
Study of pyridine detection method in Ceftazidime for Injection
Xiao Yan1,Gong Hao1,Yi Qiuyan2,He Yuxin1,Li Rui1
(1.School of Food and Bioengineering,Xihua University,Chengdu,Sichuan 610039 China;2.Sichuan Provincial Institute for Food and Drug Control,Chengdu,Sichuan 610036,China)
ObjectiveTo study the detection method of pyridine in Ceftazidime for Injection to provide reference for increasing its quality standard,clinical dispensing use,rational package and storage,and revision of instruction.MethodsThe HPLC was adopted and the external standard used the pyridine content as the indicator,the linear relationship test,precision test and stability test for the detection method were conducted;the 1-month accelerated test and the affecting factors trial were conducted for comparing the quality of products under this condition;the sample solution prepared by adopting the methods in the product manual was performed the stability test for comparing the content change of pyridine in different prepared solutions.ResultsThe linear regression equation for pyridine was Y=168 580X-2 451,R2=0.999 8,there was a good linear relationship with peak area within the range of 0.055 2~0.661 9 μg;the precision test showed that RSD of pyridine chromatographic peak area was 0.29%;in the stability test,pyridine peak area RSD of the old and new pyridine control solution was 0.40%;in the influence factor tests,the 1-month accelerated tests showed that the pyridine content did not exceed the content limits(0.4%);in three kinds of ceftazidime intravenous solution,the pyridine content was increased with time,the content increased range in avoiding light was slightly lower than that without avoiding light,which in the physiological saline group had smallest increase.ConclusionThe established HPLC standard curve of pyridine by tests can be used for the quantitative detection of pyridine;the method is reliable,the influencing factors and accelerated test can provide a reference for the packaging and storage of this preparation;the stability test of injection solution prepared by three kinds of diluents can provide reference for improvement of drug standards and quality control,reasonable clinical use and making reasonable scientific product manual and so on.
Ceftazidime; Pyridines; Chromatography,High Pressure Liquid; Quality Control
10.3969/j.issn.1009-5519.2015.12.005
:A
:1009-5519(2015)12-1773-04
2015-02-04)
肖燕(1988-),女,四川德阳人,硕士研究生,主要从事功能性食品、天然药物制剂及分析研究;E-mail:983534299@qq.com。
何宇新(E-mail:13981850645@126.com)。

