G250mAb 修饰的肿瘤细胞靶向基因载体功能研究
李 廷,徐 涛,张延辉,刘春雷
(1.青岛市妇女儿童医院,山东266000;2.青岛市中心医院,山东266000)
G250mAb 修饰的肿瘤细胞靶向基因载体功能研究
李 廷1,徐 涛2,张延辉2,刘春雷2
(1.青岛市妇女儿童医院,山东266000;2.青岛市中心医院,山东266000)
目的分析G250mAb与聚乙烯亚胺(PEI)偶联作为肿瘤靶向基因载体系统的优越性,为肿瘤细胞靶向基因治疗提供研究基础。方法通过二硫键将G250mAb与PEI偶联,得到修饰后的基因载体G250mAb-PEI,利用体外转染细胞的方法研究其转基因的优越性。结果G250mAb-PEI转染效率明显高于单纯PEI或传统脂质体转染;其毒性也较未修饰的PEI低;对人宫颈癌细胞Hela的基因转染具有显著的靶向性,其转基因效率是肝癌细胞HepG2(G250阴性)的2倍,而对正常血管平滑肌细胞的基因转染效率较Hela低近20倍。结论G250mAb-PEI是一种高效、低毒和具有靶向性的基因载体。
Hela细胞; 聚乙烯亚胺; 遗传载体; 肿瘤/病理学; 基因; 转染; G250mAb
基因治疗的发展出现障碍,最主要的问题是如何有效地将基因释放到靶细胞中长期稳定地表达,同时较少产生不良反应,即载体效率、靶向性和安全性[1]。高分子基因传递系统曾取得较大进展,结构简单的高分子很难使DNA穿越细胞内的所有屏障,设计多成分、多性能载体将是高分子基因治疗的研究方向[2]。单克隆抗体用于提高肿瘤治疗的靶向性具有重要意义。自创立单克隆抗体制备技术以来,单克隆抗体的研制与应用使靶向药物迅速发展[3-4],对肿瘤靶向治疗具有重要意义。目前研制的抗肿瘤靶向药物大部分属于单抗制品或以单抗为靶向载体的免疫偶联物,其中,单克隆抗体与靶细胞行抗原-抗体特异性结合,使药物或放射性核素释放的射线损伤与抗体结合的靶细胞DNA,从而发挥抗肿瘤作用[5]。目前单抗在肿瘤的靶向治疗领域有着重要的地位[6]。G250是膜相关性的碳酸酐酶,在肿瘤的发生、发展中起重要作用。肾癌G250抗原有良好的肿瘤特异性,其在肾癌细胞中的特异表达使其成为肾癌诊断和治疗的重要靶位。本文将G250mAb与聚乙烯亚胺(PEI)偶联,选用人宫颈癌细胞Hela(G250阳性)和人肝癌细胞HepG2、大鼠平滑肌细胞(SMC,G250阴性),利用体外细胞培养技术,检测G250mAb修饰的PEI对Hela细胞基因转染的靶向性。
1 材料与方法
1.1 材料 PEI枝化型(相对分子质量为25 000)、N-琥珀酰胺-3-(2-吡啶二硫)丙酸酯(SPDP)和2-咪唑硫烷均来自美国Sigma公司;转染试剂盒(LipofectamineTM2000)来自美国Invitrogen公司;小鼠成纤维细胞(NIH3T3,武汉大学);人宫颈癌细胞Hela、人肝癌细胞HepG2(本实验室保存);大鼠平滑肌细胞SMC;噻唑蓝(MTT,生化纯,Gibco公司);二甲亚砜(DMSO,分析纯,天津市化学试剂三厂);DMEM(美国Gibco公司);倒置荧光显微镜(Nikon ECLIPSE TE2000U,日本);酶标仪(Labsystem,Muhiskan,Ascent,芬兰)。
1.2 方法
1.2.1 质粒扩增和纯化 质粒pEGFP-C1在大肠杆菌中扩增,使用Qiagen plasmid Maxiprep试剂盒按照产品操作说明分离、提取和纯化质粒。利用凝胶电泳和紫外-可见分光光度计(UA)检验并测定所提取的质粒DNA的纯度和浓度,然后将DNA在TE缓冲溶液(含0.1mol/L氯化钠、0.01 mol/L三羟甲基氨基甲烷,pH=8.0)中稀释,于-20℃保存。
1.2.2 G250mAb与PEI复合物的合成 向5 mL PEI的磷酸盐缓冲液(PBS,浓度5 mg/mL)中加入20 μL的SPDP(10 mmol/L DMSO溶液),混合物在室温下避光反应30 min,加入100 μL 1 mol/L的甘氨酸溶液终止反应。在室温下G250mAb溶于1 mL冷PBS,然后加入21.8μL 20 mol/L的2-咪唑硫烷活化,混合物在室温下避光反应30 min,加入50 μL 1 mol/L的甘氨酸溶液终止反应,然后与活化的PEI混合,在室温下继续反应1 h,将最终产物用Sephadex G-75分离纯化,收集产物用蒸馏水透析,冷冻干燥后得到G250mAb-PEI靶向载体。
1.2.3 体外转染试验筛选转染G250阳性细胞Hela效率最佳的产物 G250mAb与PEI之间的质量比例影响着二者偶联系统的转染率,通过体外转染试验筛选转染G250阳性细胞Hela效率最佳的产物。转染前24 h在24孔培养板中种入Hela细胞,密度约为每孔20 000个细胞,G250mAb-PEI(1∶200、1∶400、1∶800、1∶1 600)与DNA以不同的质量比转染G250阳性细胞Hela,48 h后在荧光显微镜下观察蛋白表达情况。
1.2.4 基因载体转染效率测定 选择Hela和HepG22种常见肿瘤细胞,前者表达G250,而后者不表达G250。用正常细胞SMC作为对照组。转染前24 h在24孔培养板中分别种入HepG2、Hela细胞,密度约为每孔20 000个细胞。每孔加入0.5 mL完全DMEM培养基,5%CO2培养箱中37℃培养。转染前先移去完全培养基,用温热PBS洗涤细胞。用0.5 mL无血清DMEM培养基继续培养。在温和涡旋搅拌下,G250mAb-PEI与DNA以质量比3∶1混合,PEI与DNA以质量比1∶1混合,脂质体LipofectamineTM2000与DNA以3∶1混合,孵育30 min,将复合物溶液均匀地加入到各孔中,37℃转染4~6 h后将无血清培养基换成0.5 mL完全DMEM培养基继续培养48 h。在倒置荧光显微镜下观测转染结果。同时,Hela/ SMC:Hela/HepG2培养后行流式细胞仪检测。
1.2.5 基因载体的细胞毒性测定 将NIH3T3细胞接种到96孔板(1×104/孔),培养24 h后每孔分别加入G250mAb-PEI/PEI/Lipofectamine,使终浓度分别为20、40、60、80、120、160 μg/mL,对照组不加基因载体。培养24 h后每孔加入25 μL 5 mg/mL MTT溶液,继续孵育4 h,弃去上清液,用PBS清洗1次,每孔加入DMSO 150 μL,震荡10 min,用酶标仪在570 nm波长下测定吸光度。每个浓度及对照组做6个平行样,实验重复3次。根据下列公式计算细胞的相对成活率:相对成活率=样品组平均吸光度值/对照组平均吸光度值×100%。
1.3 统计学处理 应用SPSS17.0统计软件进行数据分析,计数资料以率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 G250mAb与PEI复合物的合成 G250mAb与PEI的反应为PEI过量反应,反应体系中除G250mAb-PEI外,还有过量的PEI和化学小分子。根据其相对分子质量大小的不同,利用分子筛原理进行SephadexG-75分离纯化,见图1。

图1 G250mAb与PEI复合物合成分离纯化
2.2 通过体外转染试验筛选转染G250阳性细胞Hela效率的最佳产物 G250mAb对PEI的不同修饰度影响载体对Hela细胞的转染效率,其中G250mAb-PEI(1∶400)转染效率最高,其他比例的产物较之均偏低。经过筛选得到G250mAb-PEI 1∶400在该实验合成比例中为最佳载体,见图2。
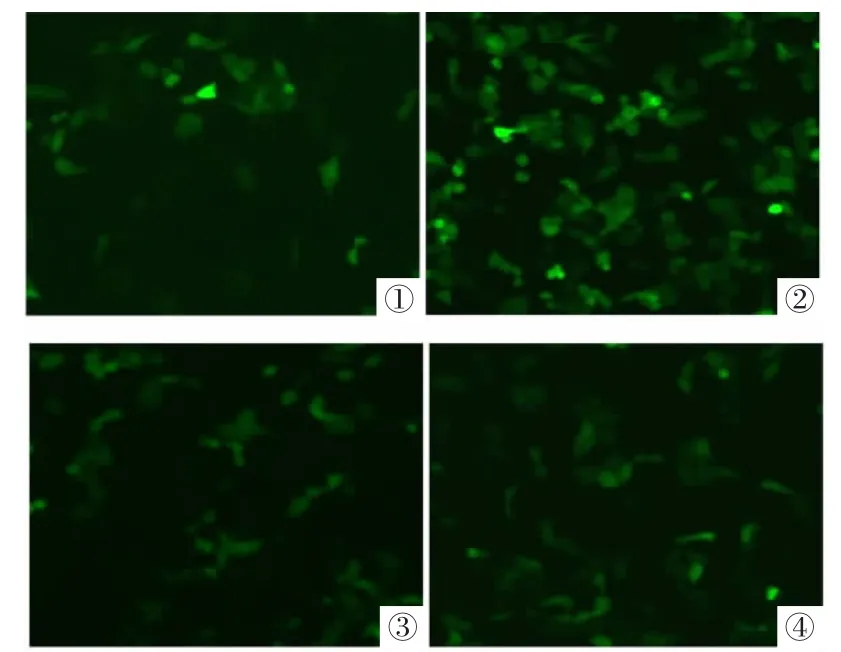
图2 G250mAb-PEI转染效率荧光照片(100×)
2.3 基因载体转染效率测定 G250修饰的PEI对Hela细胞基因转染具有靶向性。G250mAb-PEI对Hela/SMC和Hela/HepG2的转染率比较,差异有统计学意义(P<0.05)。见图3、4。

图3 体外转染Hela、HepG2、SMC细胞荧光照片(100×)

图4 共培养的Hela/SMC、Hela/HepG2细胞流式细胞仪检测结果
2.4 基因载体的细胞毒性测定 G250mAb修饰后载体的生物相容性显著提高,对NIH3T3细胞的细胞毒性显著低于PEI、Lipofectamine,见图5。

图5 G250mAb-PEI转染NIH3T3细胞毒性MTT分析
3 讨 论
病毒载体转染效率高,但缺点是安全性较差,且其免疫原性高,所以在体内应用不广。而非病毒载体安全性较高,免疫原性也较低,将成为首选的基因转染载体[7]。PEI还可以合成更复杂的DNA非病毒载体释放系统,用于体内基因治疗。Koo等[8]发现,PEI能转染真核细胞基因,但能引起红细胞聚集和溶血,使体内转染效率大大降低[9]。PEI作为基因载体的缺点还包括高毒性和不可降解性,可以通过PEG、脂质体或细胞特异配体等方法把PEI/DNA复合物屏蔽,从而降低PEI的细胞膜毒性,增强载体的靶向性。G250mAb通过二硫键将PEI与G250mAb偶联,可以特异性结合原发性肾癌和转移性肾癌、宫颈癌、卵巢癌、食管癌等表面的G250抗原[10],从而合成G250mAb-PEI基因载体。既实现了用细胞特异性配体降低PEI的细胞膜毒性,又增强了G250mAb与PEI的协同靶向性。本实验证明,G250mAb-PEI对Hela细胞的转染效率是SMC转染效率的19倍。对于Hela细胞,G250mAb-PEI的转染效率较未修饰的PEI高1倍,而对SMC的转染效率二者差别不大。结果表明,G250mAb-PEI/DNA复合物能够与G250抗原紧密结合,促进细胞胞吞,使转染效率得到提高。相关文献报道,PEI与NIH3T3细胞作用24h后,根据MTT试验计算生存率,PEI浓度为6 μg/mL时,细胞生存率为64.2%,在相同的条件下,G250mAb-PEI细胞生存率为82.0%,当其浓度大于6μg/mL时,PEI转染的细胞生存率急剧下降,在25 μg/mL时降到10%左右,而G250mAb-PEI浓度在6~25 μg/mL时细胞生存率保持在60%~80%,为G250mAb-PEI在体内实验中的应用提供了广阔的空间[11]。证明G250mAb-PEI是一种毒性低、效率高、靶向性强的基因载体,为肿瘤细胞靶向基因治疗提供了一个很好的转染途径。针对PEI的细胞毒性,近年来也有学者利用PEG和细胞特异性配体共同修饰PEI[12-13],例如G250mAb、PEG共同修饰载体后,细胞毒性降低,生物相容性提高,对NIH3T3细胞的细胞毒性显著低于PEI,使PEI的高毒性和不可降解性大大降低。
综述所述,G250mAb-PEI是一种高效、低毒且具有靶向性的基因载体。
[1]唐彬秩,秦豪杰,傅强,等.重组腺相关病毒:很有潜力的基因治疗载体[J].生物化学与生物物理进展,2006,33(8):711-718.
[2]Nakanishi H,Mazda O,Satoh E,et al.Nonviral genetic transfer of Fas ligand induced significant growth suppression and apoptotic tumor cell death in prostate cancer in vivo[J].Gene Ther,2003,10(5):434-442.
[3]谢力,李鸿钧,孙茂盛,等.单克隆抗体在肿瘤治疗中的应用进展[J].国际免疫学杂志,2012,35(6):445-448.
[4]Su X,ZhangL,Jin L,et al.Immunotherapy with cytokine-induced killer cells in metastatic renal cell carcinoma[J].Cancer Biother Radiopharm,2010,25(4):465-470.
[5]Mulders P,Bleumer I,Oosterwijk E.Tumor antigens and markers in renal cell carcinoma[J].Urol Clin North Am,2003,30(3):455-465.
[6]Duan Y,Zheng J,Han S,et al.A tumor targeted genevector modified with G250 monoclonal antibody for gene therapy[J].J Control Release,2008,127(2):173-179.
[7]汤谷平,范辉,胡奇达.阳离子聚合物作为基因载体的研究进展[J].浙江大学学报:医学版,2012,41(6):593-598.
[8]Koo H,Jin GW,Kang H,et al.Biodegradable branched poly(ethylenimine sulfide)for gene delivery[J].Biomaterinis,2010,31(5):988-997.
[9]Goula D,Benoist C,Mantero S,et al.Polyethylenimine-based intravenous delivery of transgenes to mouse lung[J].Gene Ther,2009,5(9):1291-1295.
[10]Bleumer I,Knuth A,Oosterijk E,et al.A phase II trial of chimeric monoclonal antibody G250 for advanced renal cell carcinoma patient[J].Br J Cancer,2004,90(5):985-990.
[11]梁兵,袁芳,殷建瑞,等.纳米材料PEG-PEI介导双基因促体外拟神经细胞凋亡的作用[J].山东医药,2012,52(25):1-4.
[12]何宁,孙贺春,徐欢喜,等.可降解非病毒基因载体PEG-b-(PG-g-PEI)的合成与表征[J].南方医科大学学报,2013,33(11):1643-1647.
[13]刘云云,刘中霖,王勇,等.PEG-PEI/ROCK-II-siRNA复合物物理性能和转染C17.2神经干细胞效率的研究[J].解剖学研究,2012,34(6):401-405.
Study on vector function of G250 mAb modified tumor cell target gene
Li Ting,Xu Tao,Zhang Yanhui,Liu Chunlei
(1.Qingdao Municipal Women and Children Hospital,Qingdao,Shandong 266000,China;2.Qingdao Municipal Central Hospital,Qingdao,Shandong 266000,China)
ObjectiveTo research and analyze the superiority of G250mAb coupling with polyethyleneimine(PEI)as a tumor-targeted gene vector to lay the foundation for targeted gene therapy of tumor cells.MethodsG250mAb was coupled with PEI by the disulfide bond for obtaining the modified gene vector G250mAb-PEI.The transfected cells in vitro method was applied to study its transgenetic superiority.ResultsThe transfection efficiency of G250mAb-PEI was significantly higher than that of pure PEI or traditional lipofectamine trasfection;its toxicity was lower than that of non-modified PEI;the gene transfection of cervical cancer Hela cells had significant targeting and its transfection efficiency was twice that of liver cancer cells HepG2(G250 negative),but the transfection efficiency of normal vascular smooth muscle cells(SMC)was lower than that of Hela by nearly 20-fold.ConclusionG250mAb-PEI is a highly efficient gene vector with low cytotoxicity and targeting effect.
Hela cell; Polyethyleneimine; Genetic vectors; Neoplasms/pathology; Genes; Transfection;G250mAb
10.3969/j.issn.1009-5519.2015.12.002
:A
:1009-5519(2015)12-1764-03
2015-02-08)
青岛市卫生科技发展计划项目(WSZD080)。
李廷(1981-),女,山东青岛人,硕士研究生,主要从事肿瘤的诊断及治疗工作;E-mail:qingdaoliting@163.com。
刘春雷(E-mail:qdzxyymnwk@163.com)。

