食欲素研究现状及展望*
路 海 姜云璐 综述 陈 京 白 波 审校
(济宁医学院神经生物研究所,山东 济宁272067)
食欲素(Orexins,Ox)是由下丘脑分泌的能够促进食欲的一种神经肽,又称下丘脑分泌素,主要通过激活7次跨膜G蛋白偶联受体(G protein coupled receptors,GPCRs)-Ox1型受体(orexin receptor type 1,OX1R)与 Ox2型受体(orexin receptor type 2,OX2R)发挥其生理学功能[1]。自1998年发现Ox后,人们致力于研究其在嗜睡、失眠等疾病中的作用,并发现食欲素的拮抗剂能提高睡眠质量[2]。此外,Ox还参与饮食、机体成瘾及奖赏系统的调节,并具有促进肿瘤细胞凋亡的作用。本文将Ox近几年的研究进展作一综述。
1 Ox分子生物学特征
OxA与OxB来源于同一个Ox前体,OxA含有33个氨基酸,其N末端有两分子的二硫键,而OxB为28个氨基酸[3]。人体中有80000多个神经元能够分泌Ox,这些神经元主要集中于下丘脑区域[4]。Ox主要通过OX1R、OX2R发挥作用,OX1R主要分布于大脑皮层与脑干区,参与调节睡眠及奖赏系统等。Smart等[5-6]研究发现,OX1R通过偶联Gαq激活磷脂酶C(phospholipase c,PLC)调控胞内的钙通道或通过偶联Gαi/Gs调节胞内的cAMP水平,进而调节与摄食、饮水等生理活动。OX2R主要分布于下丘脑结节核、脑干中的5-羟色胺(5-HT)神经元等,与OX1R相似,能激活Gαq/Gαi/Gs 调 节 胞 内 的 Ca2+及 cAMP 的 水平[6]。
Ox广泛分布于外周系统并参与调节众多生理功能。Liu等[7]在肾上腺、睾丸、肠道中发现有少量的OX1RmRNA,而在肾上腺中存在大量的OX2RmRNA。因此,Ox在外周系统的作用机制、生理功能引起了人们的高度关注。研究表明,Ox受体活化后激活蛋白激酶C(Protein kinase C,PKC)以调节细胞膜上的慢钙通道。OX1R激活Ca2+通道后能上调促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、cAMP结合蛋 白 (cAMP-response element binding protein,CREB)、腺苷酸环化酶(adenylyl cyclase,AC)与PLC等激酶。通过PLC引起的Ca2+释放会激活神经元,调节精神活动。OX2R通过偶联Gαq激活的PLC/PKC途径以及偶联 Gαi、Gs激活的AC/cAMP/PKA途径诱导的ERK磷酸化作用明显强于OX1R通过调节PKC、PI3K、Ras与Src诱导的ERK磷酸化[8]。此外,OX2R还可以通过Gαi、Gs的 下 游 信 号 分 子 AC/cAMP 激 活 p38 MAPK途径。Ward等[9]研究发现,OX1R能够形成同源二聚体,且能够与GPCRs其他成员形成异源二聚体,如能与大麻素1型受体形成二聚体,此二聚体的形成能够影响OX1R的内吞与运输途径,并增强OX1R引起的ERK磷酸化作用。β-arrestin 1与动力蛋白Dynlt1等的结合也会影响OX1R的内化作用。对OX1R的基因序列分析发现,OX1R 通过激活 TGF-β、Smad、BMP、FGF、NF-kB等因子而调节细胞生长与新陈代谢[10]。见图1。
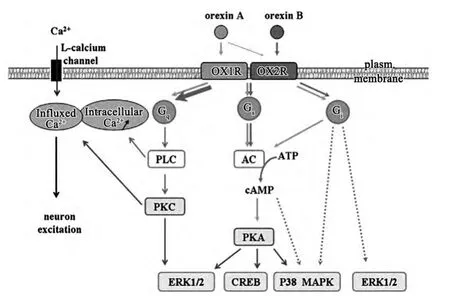
图1 食欲素介导的下游信号通路示意图
由Ox诱导的外周信号通路是错综复杂的,但Ox作为神经肽参与调节的神经活动更为繁琐。首先,神经元分泌许多具有重要调节作用的神经肽,且与Ox能够协同的加强刺激结节乳头体核。与缺少Ox神经元相比较,缺少Ox受体引起的肥胖与失眠更为严重。因此,当用Ox的反向激动剂虽然能够拮抗食欲素的作用,但会引起一系列的神经系统紊乱的疾病。其次,Ox神经元能够直接激活基底前脑区的胆碱能/非胆碱能神经元。此外,Ox神经元的去极化主要是由5-HT作用于5-HT1A偶联G蛋白调控内向整流钾离子通路(inwardly rectifying K+channels,GIRK)产生的。研究发现,脑干区的血清素神经元与去甲肾上腺素(noradrenaline,NA)神经元对Ox神经元能够产生负反馈的调节作用,此调节会抑制5-HT的产生而阻碍食欲素神经元的去极化现象。
2 Ox的生理作用
2.1 调节睡眠
Sakurai[11]证实Ox受体最主要的生理作用是调节睡眠与清醒。γ-氨基丁酸(gamma-aminobutyric acid,GABA)、谷氨酸、乙酰胆碱(acetylcholine,Ach)、NA、5-HT、多巴胺(dopamine,DA)、组胺,腺苷、甘氨酸、前列腺素、Ox等多种神经递质参与睡眠与清醒的调节。研究发现,下丘脑腹外侧核团区的GABA神经元与甘丙肽神经元在睡眠期被激活,而在清醒状态被抑制。在清醒状态,相对活跃的神经元主要集中在侧背面与脑桥被盖核区的ACh神经元、蓝斑核区的NA神经元、中缝背核区的5-HT神经元、腹侧被盖区的DA神经元、结节乳头核HA神经元及LH区的Ox神经元[12-13]。Marcus等[14]研究表明,Ox在单胺能神经和胆碱能神经核区大量表达,且此区域富含Ox受体,故此区域是促进与维持清醒状态的核心区。
研究表明,Ox介导的下游信号通路是维持哺乳动物觉醒的关键途径。在LDT、LC、TMN和横向预光学区域侧脑室注射OxA导致觉醒,因为它同时降低快速眼动期(rapid eye movement,REM)和非快速眼动期(non rapid eye movement,NREM)。直接光刺激Ox神经元能够激活阳离子通道通道视紫红质-2,自由移动小鼠能够加速其从慢波睡眠或REM睡眠过渡到清醒状态。基因敲除小鼠表明,OX1R和OX2R均参与睡眠和觉醒的调节,OX2R更显著,但不同亚型的Ox受体在不同物种中调节作用不同。基因敲除或损害食欲素神经元、肽或受体会导致睡眠紊乱,如发作性嗜睡症和睡眠窒息等。研究表明,犬齿动物的嗜睡症是由OX2R基因破坏造成的,而大多数嗜睡症患者的Ox及其受体的基因是完整的,但检测不到Ox的表达。Thannickal等[15]研究表明,嗜睡症患者下丘脑区域Ox神经元的数量比正常人下降85%~95%,且神经胶质发生明显的增生现象。
OX2R激动剂能够透过血脑屏障发挥唤醒作用而用于治疗嗜睡症,而阻断OX2R能够延长睡眠,由此推测,OX2R的拮抗剂能够用于治疗失眠症。OxA通过LC抑制REM与NREM,而OX1R的选 择 性 拮 抗 剂 (SB-334867-A/SB-334867 盐 酸盐)与其作用恰好相反。研究发现,OX2R的特异性拮抗剂(JNJ-10397049)对REM 与NREM 的促进作用,比OX1R的特异性拮抗剂(SB-408124)或OXR的非特异性拮抗剂(阿莫伦特)更明显。临床研究表明,Ox系统对睡眠的调节与年龄相关。在哺乳动物与人类中,Ox及其受体、Ox神经元与免疫受体神经元随着年龄的增长而逐渐减少[16]。这足以解释随着年龄的增长,睡眠质量越来越差及睡眠时间逐渐减少的生理现象,同时为治疗嗜睡症、失眠症提供新的药物靶点。
2.2 调节饮食
Ox系统对睡眠的调节与饮食及能量代谢相关联,相关研究显示,Ox能够增加能量代谢并抑制肥胖。Ox神经元缺少的小鼠机体能量代谢降低引发肥胖,并伴随新陈代谢紊乱、2型糖尿病与冠心病;而Ox神经元基因敲除小鼠的食欲明显降低[17]。由此推测,Ox系统在饮食、能量代谢、肥胖与糖尿病等扮演着重要角色。
下丘脑外侧区域中Ox神经元对摄食行为与能量代谢平衡发挥重要作用,在外周系统(如脂肪组织、肾上腺、胰腺等)亦是如此。Ox系统能够调节脂肪代谢并维持体温平衡,这主要是通过褐色脂肪区域的p38MAPK途径与Smad1/5信号通路介导的,而Smad1/5则主要依赖于跨膜的丝氨酸/苏氨酸激酶及骨形态发生蛋白受体1α(bone morphogenetic protein receptor,BMPR1A)。
Ox系统在中枢神经系统与外周系统均可发挥调节能量平衡的功能,包括激素、营养物质的代谢等。某些激素或营养物质能够增强对空腹刺激的适应性(饥饿时由胃产生的一种促使人清醒的脑肠肽激素),因此,人在饥饿时会变得清醒[18]。食欲素、瘦素、胰岛素、胃饥饿素等在胰腺中大量表达,受交感神经支配而参与调节体内能量代谢。瘦素是由脂肪组织分泌的一种能够降低能量摄取、增加能量代谢的蛋白类激素,它能够增强内源性的胰岛素分泌降低血糖水平而缓解肥胖大鼠的病症。胃饥饿素是由下丘脑、胃分泌的一种调节食欲酰基化多肽。瘦素、葡萄糖等会抑制Ox的表达,而胃饥饿素通过NPY与刺鼠相关蛋白会增强食欲素的表达。因此,Ox能够影响瘦素的选择性,并介导胃饥饿素诱导Fos的表达。进一步研究发现,OX2R通过增加能量释放和减少食物消耗保护啮齿类动物免受由瘦素诱导的肥胖症与胰岛素耐受。因此,只有食欲素系统、瘦素、胃饥饿素系统共同协调才能维持正常的机体代谢水平。
2.3 调节成瘾
调节饮食的部分神经元同时能够参与机体成瘾及奖赏系统,如下丘脑外侧区域等。不同的脑区域参与调节的成瘾行为不同,如尼古丁成瘾主要集中于下丘脑外侧与脑岛区域,酒精与吗啡成瘾主要在下丘脑外侧,可卡因成瘾主要在中脑腹侧被盖区。将OxA中脑腹侧被盖区给药,发现大鼠对可卡因的需求动机增强,这主要是由于OxA诱导OX1R激活PKC/PLC途径,促使VTA中的DA能神经元N-甲基-D天冬氨酸受体活化,使得突触后兴奋性电流增强。Borgland等[19]研究发现,SB-334867(OX1R拮抗剂)直接给药至VTA,可以有效地改变由于长期可卡因给药引起的突触可塑性,并能阻断与此相关联的行为敏化效应。将SB-334867直接皮层、PVN给药时发现,会降低尼古丁的躯体戒断反应,敲除食欲素受体的小鼠(SB-334867直接皮层、PVN给药)没有产生由高浓度尼古丁产生的焦虑症状[20]。皮下注射SB-334867,会降低吗啡诱导的小鼠跳动、排便、腹泻等反应;全身给药能下调Fos蛋白在伏隔核中的表达水平;蓝斑核给药会降低吗啡引起的躯体症状。此外,SB-334867在酒精、食物成瘾的治疗中也发挥重要作用。
Ox能够上调与成瘾相关的神经递质及受体,而成瘾与奖赏行为会随着神经递质向神经系统的传递增加而加强。把Ox直接注射到中脑腹侧被盖区时伏隔核区的多巴胺会显著增加,使得与成瘾相关的神经元持续活化。在小鼠体内基因敲除或阻断OX1R时,由吗啡诱导的DA增加的现象会显著降低,由此推测,OX1R在吗啡介导的奖赏系统中发挥重要作用。增加Ox或上调OX2R的表达会直接导致酒精成瘾,这为寻找靶向于PLC/PKC途径的药物(治疗成瘾的药物)提供理论基础。
2.4 促进癌细胞凋亡
Ox除了在饮食、睡眠及药物成瘾中发挥重要作用外,在癌症治疗过程中也扮演重要角色。相关研究表明,在HT29-D4细胞中,OxA与OxB均能引起细胞形状改变、DNA断裂、核染色质凝聚,且能引起线粒体中细胞色素C释放进而激活caspase-3与caspase-7,此种现象在正常结肠细胞中没有发现[5]。在CHO及神经母细胞瘤中转染OX1R的cDNA,给予Ox干预以后发现两种细胞生长受到抑制且部分细胞凋亡。在CHO与大鼠的胰腺细胞中只转染OX2R的cDNA,同样给予食欲素干预,出现了上述现象。研究表明,OX1R诱导细胞凋亡主要是通过P38MAPK途径,但在CHO细胞中主要是通过激活P53与半胱天冬酶引起的。大鼠的神经胶质瘤细胞中同时表达OX1R与OX2R,OxA干预后并不影响细胞增殖,但是能通过激活半胱天冬酶而抑制细胞生长。重要的是,无论哪个时期的结肠癌与肝癌均表达OX1R的mRNA,但是邻近的正常组织中没有OX1R[21]。当把人的结肠癌细胞接种到裸鼠中,OxA能强烈地抑制肿瘤细胞的生长。此外,临床表明脑瘤病人的脑脊液中OxA的含量低于正常人;良性前列腺增生的病人OX2R表达水平上调而OxA含量降低;子宫内膜癌患者的OX2R的基因沉默[22]。由此可见,Ox受体是治疗癌症的潜在靶点,尤其是结肠癌。
Voisin等[23]研究发现,OX1R 活化后引起Gαq与βγ亚基分离,βγ二聚体进而激活Src-酪氨酸激酶,Src-酪氨酸激酶磷酸化免疫受体酪氨酸抑制基序(immunoreceptor tyrosinebased inhibitory motif,ITIM)与免疫受体酪氨酸活化基序(immunoreceptor tyrosinebased switch motif,ITSM),磷酸化的ITIM、ITSM募集并激活酪氨酸磷酸酶SHP-2,诱导线粒体裂解,细胞色素C释放,最终导致细胞凋亡(图2)。另有发现,ITIM、ITSM 在OX2R及其它的GPCRs(如速激肽受体NK1、NK2、NK3)介导的细胞凋亡中也发挥重要作用[24]。由此推测,Ox受体介导的下游信号通路的某些分子有望成为治疗癌症的关键因子。
尽管多种迹象表明,Ox受体能够抑制众多癌细胞的生长,并促进其凋亡,但并不是对所有癌细胞均有抑制作用。OxA虽然能够通过p38MAPK途径促进细胞凋亡,但是ERK1/2却能保护细胞免受损伤,如OxA能够通过ERK1/2途径保护前脂肪 细 胞 3T3-L1,并 降 低 Caspase-3 的 活 性。Skrzypski等[25]在永生化的大鼠胚胎R7细胞系中发现,OxA 能够降低 Caspase-3、Caspase-7的活性,增强细胞的生存能力。Spinazzi等[26]发现人肾上腺皮质瘤细胞中同时表达OX1R与OX2R,与促进细胞凋亡相反,OxA与OxB增强皮质瘤细胞的活性。这似乎与前期研究不相符合,这主要是由于不同信号分子在不同的细胞系或信号通路中发挥的作用不同所致,如细胞色素Apaf-1的活性与不同的细胞系及生长状态呈正相关。因此,Ox受体的下有信号通路为癌症的治疗提供可能,而其机制不明,需要我们进一步深入研究。
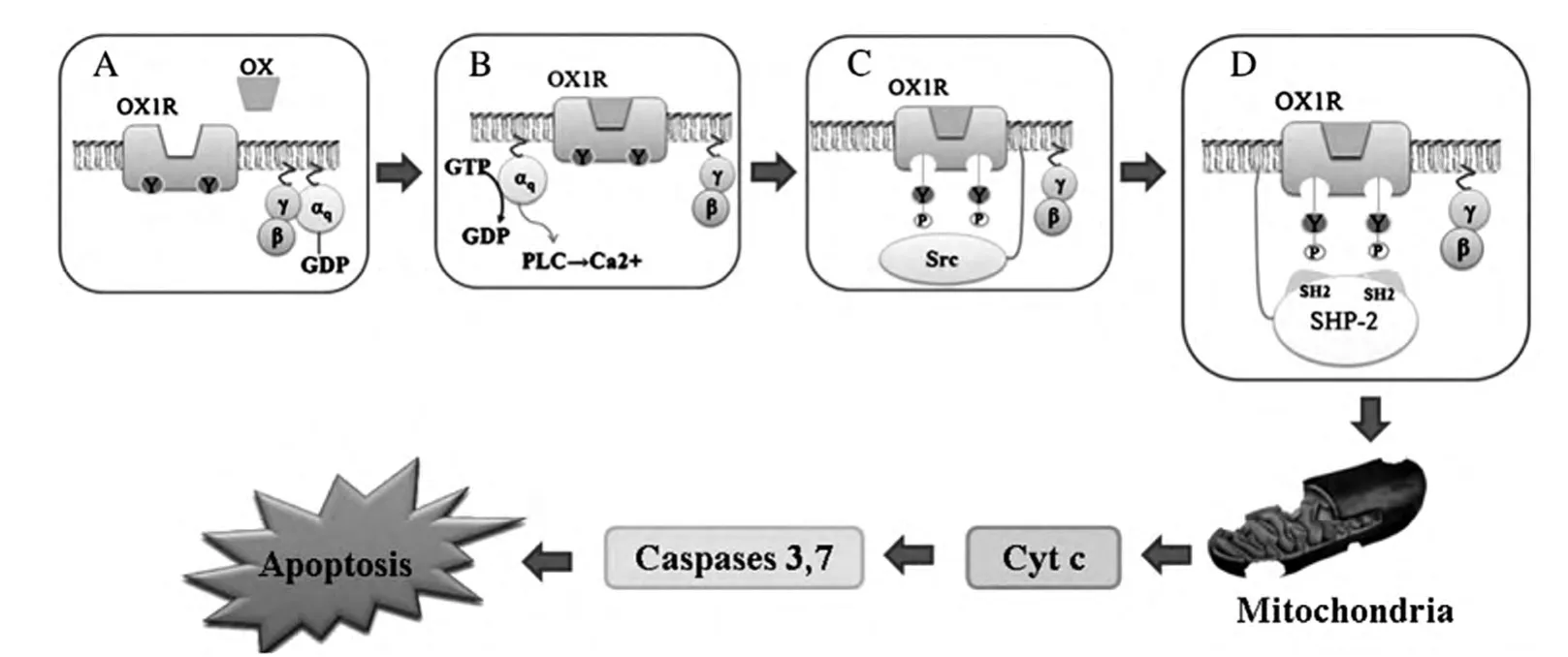
图2 OX1R介导的细胞凋亡
3 展望
过去几十年的研究表明,Ox系统在生理学及生物学中具有重要的作用,如能够调节睡眠与清醒、饮食与能量代谢、药物与食物成瘾以及癌症等众多生理病理反应。Ox受体与其它GPCRs成员的相互作用介导的下游信号通路也日益清晰,如能与大麻素受体、肾上腺素受体形成异源二聚化等。然而,Ox系统依然存在不可避免的副作用,解决这种副作用最好方法就是找到能够特异性结合Ox受体的激动剂或拮抗剂。然而,Ox系统在脑部区域及亚型之间的作用是错综复杂、相辅相成的,因此,即便是靶向于Ox受体的药物也会影响相关联区域及其他受体的生理功能。本文基于Ox系统的药理学作用,针对OX1R与OX2R的下游信号通路及与GPCRs家族中其它受体的相互作用关系展开研究,并取得了初步的成果[27-28]。随着对Ox系统研究的不断深入,我们有理由相信它终将成为治疗失眠、肥胖、成瘾、癌症等疾病的新靶点。
[1] Powley T L,Keesey R E.Relationship of body weight to the lateral hypothalamic feeding syndrome[J].J Comp Physiol Psychol,1970,70:25-36.
[2] Hara J,Beuckmann C T,Nambu T,et al.Genetic ablation of orexin neurons in mice results in narcolepsy,hypophagia,and obesity[J].Neuron,2001,30:345-354.
[3] Lee J H,Bang E,Chae K J,et al.Solution structure of a new hypothalamic neuropeptide,human hypocretin-2/orexin-B[J].Eur J Biochem,1999,266:831-839 .
[4] Fronczek R,Lammers G J,Balesar R,et al.The number of hypothalamic hypocretin(orexin)neurons is not affected in Prader-Willi syndrome[J].J Clin Endocrinol Metab,2005,90:5466-5470 .
[5] Turunen P M,Ekholm M E,Somerharju P,et al.Arachidonic acid release mediated by OX1orexin receptors[J].Br J Pharmacol,2010,159:212-221.
[6] Smart D,Jerman J C,Brough S J,et al.Characterization of recombinant human orexin receptor pharmacology in a Chinese hamster ovary cell-line using FLIPR[J].Br J Pharmacol,1999,128:1-3.
[7] Liu F,Xu G Z,Wang L,et al.Gene expression and protein distribution of orexins and orexin receptors in rat retina[J].Neuroscience,2011,189:146-155.
[8] Tang J,Chen J,Ramanjaneya M,et al.The signalling profile of recombinant human orexin-2receptor[J].Cell Signal,2008,20:1651-1661.
[9] Ward R J,Pediani J D,Milligan G.Heteromultimerization of cannabinoid CB(1)receptor and orexin OX(1)receptor generates a unique complex in which both protomers are regulated by orexin A[J].J Biol Chem,2011,286(43):37414-37428.
[10]Sikder D,Kodadek T.The neurohormone orexin stimulates hypoxia-inducible factor-1activity[J].Genes Dev,2007,21(22):2995-3005.
[11]Sakurai T.The neural circuit of orexin(hypocretin):maintaining sleep and wakefulness[J].Nat Rev Neurosci,2007,8:171-181.
[12]Mieda M,Sakurai T.Orexin(hypocretin)receptor agonists and antagonists for treatment of sleep disorders.Rationale for development and current status[J].CNS Drugs,2013,27:83-90.
[13]Gotter A L,Webber A L,Coleman P J,et al.International U-nion of Basic and Clinical Pharmacology.LXXXVI.Orexin receptor function,nomenclature and pharmacology[J].Pharmacol Rev,2012,64:389-420.
[14]Marcus J N,Aschkenasi C J,Lee C E,et al.Differential expression of orexin receptors 1and 2in the rat brain[J].J Comp Neurol,2001,435:6-25.
[15]Peyron C,Faraco J,Rogers W.A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains[J].Nat Med,2000,6:991-997.
[16]Wang W,Pan Y,Li Q,et al.Orexin:apotential role in the process of obstructive sleep apnea[J].Peptides,2013,42:48-54.
[17]Kotz C,Nixon J,Butterick T,et al.Brain orexin promotes obesity resistance[J].Ann N Y Acad Sci,2012,1264:72-86.
[18]Guyenet S J,Schwartz M W.Clinical review:Regulation of food intake,energy balance,and body fat mass:implications for the pathogenesis and treatment of obesity[J].J Clin Endocrinol Metab,2012,97:745-555.
[19]Borgland S L,Taha S A,Sarti F,et al.Orexin A in the VTA is critical for the induction of synaptic plasticity and behavioral sensitization to cocaine[J].Neuron,2006,49:589-601.
[20]Plaza-Zabala A,Flores A,Maldonado R,et al.Hypocretin/orexin signaling in the hypothalamic paraventricular nucleus is essential for the expression of nicotine withdrawal[J].Biol Psychiatry,2012,71:214-223.
[21]Biegańska K,Sokolowska P,Jöhren O,et al.Orexin A suppresses the growth of rat C6glioma cells via a caspase-dependent mechanism[J].J Mol Neurosci,2012,48:706-712.
[22]Dehan P,Canon C,Trooskens G,et al.Expression of type 2 orexin receptor in human endometrium and its epigenetic silencing in endometrial cancer[J].J Clin Endocrinol Metab,2013,98:1549-1557.
[23]Voisin T,El Firar A,Fasseu M,et al.Aberrant expression of OX1receptors for orexins in colon cancers and liver metastases:an openable gate to apoptosis[J].Cancer Res,2011,71:3341-3351.
[24]Laburthe M,Voisin T.The orexin receptor OX(1)R in colon cancer:apromising therapeutic target and a new paradigm in G protein-coupled receptor signalling through ITIMs[J].Br J Pharmacol,2012,165:1678-1687.
[25]Butterick T A,Nixon J P,Billington C J,et al.Orexin A decreases lipid peroxidation and apoptosis in a novel hypothalamic cell model[J].Neurosci Lett,2012,524:30-34.
[26]Spinazzi R,Rucinski M,Neri G,et al.Preproorexin and orexin receptors are expressed in cortisol-secreting adrenocortical adenomas,and orexins stimulate in vitro cortisol secretion and growth of tumor cells[J].J Clin Endocrinol Metab,2005,90:3544-3549.
[27]Chen J,Zhang R,Chen X,et al.Heterodimerization of human orexin receptor 1and kappa opioid receptor promotes protein kinase A/cAMP-response element binding protein signaling via a Gαs-mediated mechanism[J].Cell Signal,2015,27:1426-1438.
[28]Wang C,Pan Y,Zhang R,et al.Heterodimerization of mouse orexin type 2receptor variants and the effects on signal transduction[J].Biochim Biophys Acta,2014,1843:652-663.

