大鼠骨髓间充质干细胞体外培养体系的建立
李 丹 张金国
(济宁医学院2013级研究生,山东 济宁272067;济宁医学院附属医院,济宁272029)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是目前组织工程建设的种子细胞,但因其在骨髓中含量极低,体外细胞纯化、扩增培养难度较大,严重影响BMSCs后续实验研究。目前提取方法主要有4种:全骨髓贴壁培养法、密度梯度离心法、免疫磁珠法和流式细胞仪分离法[1]。由于全骨髓贴壁培养法获得的细胞活性强,增殖旺盛,并且具有操作简单,造价低等优点,本文采用贴壁法进行体外培养。报道如下。
1 材料和方法
1.1 实验动物
体重100g左右健康清洁SD大鼠,雌雄不限,由济宁鲁抗生物有限公司提供。
1.2 试剂及仪器
1.2.1 试剂 DMEM/F12 1∶1(Gibco公司);胎牛血清(Gibco公司);0.25%胰蛋白酶(Gibco公司);青链霉素混合液(genview公司);CD90、CD45抗大鼠荧光表面抗体(eBioscience公司)。
1.2.2 仪器 超净工作台(苏州安泰空气技术有限公司);倒置显微镜(OLYMPOS公司);细胞培养箱 (Thermo公司)。
1.3 大鼠BMSCs体外培养体系的建立及鉴定
1.3.1 大鼠BMSCs的提取 称取100g左右健康清洁SD大鼠一只,脱臼处死后完全浸泡于75%
酒精中5min。将大鼠置于灭菌后的手术台上,依次剪开皮肤、皮下组织,剥离肌肉,完整取下双侧股骨及胫骨,放置装有PBS的无菌培养皿中,清除肌肉组织,并用PBS反复冲洗3遍。在超净台内剪开双侧骨端,用1ml针头吸取含10%胎牛血清的DMEM/F12培养基反复冲洗骨髓腔,直至骨体发白,将骨髓液收集至15ml离心管中,1000rpm,5min离心,收集细胞。
1.3.2 大鼠BMSCs的体外培养 用5ml含10%完全培养基重悬细胞,反复吹打,制备单一细胞悬液。在细胞计数板上计数,以1×109/L密度接种于25cm2的细胞瓶中,置于37℃,CO2浓度为5%的饱和适度培养箱内培养。72h后全量换液,并用PBS反复冲洗,将悬浮细胞去除。每间隔2d换液,第7天细胞融合至80%左右,胰酶消化,并严格控制消化时间,待镜下观察梭形细胞变形后,立即用完全培养基5ml终止消化,收集细胞悬液,1000rpm,5min离心。将收集的细胞以1∶2接种于25cm2的细胞瓶中,继续培养,传代后细胞生长迅速,依次传代记为P1,P2,P3等。
1.3.3 大鼠BMSCs的表型鉴定 取P3代生长良好的细胞,胰酶消化后,PBS反复冲洗两遍,收集离心后的细胞,根据流式细胞荧光抗体的要求,按每管1×106/L密度置于4个流式专用上机管中,分别加入CD90抗体和同型、CD45抗体和同型各5μl,充分混匀细胞悬液后,避光静置15min后,各管加入1ml PBS,1200rpm,离心5min,洗涤细胞。用400μl PBS重悬细胞后上机,根据收集的荧光信号,判断细胞阳性率。
1.3.4 操作注意事项 1)提取、培养细胞过程中严格无菌操作,添加必要抗生素,减少污染概率。2)提取过程中注意保持股骨端的完整性,避免其它杂细胞的污染。3)反复吹打获得的细胞悬液,制备单一的细胞悬液,有利于BMSCs的贴壁生长。4)避免反复观察细胞,严格控制首次换液时间,减少培养液晃动对细胞的不利影响。
2 结果
2.1 大鼠BMSCs的形态特征
提取细胞接种于培养瓶后,呈大小不一的圆形,悬浮于培养液中。24h后瓶内出现少量贴壁细胞,呈梭形、椭圆形、多角形等,小片状聚集生长,细胞生长缓慢。72h后首次全量换液,去除不贴壁的造血细胞等悬浮细胞,可见贴壁细胞增多,呈现梭形、纺锤形,呈片状聚集生长。2天后换液,细胞增长速度明显增快,生长逐渐融合,继续培养至7d,细胞融合达80%左右,梭形细胞为主,胰酶消化传代至P3代时,细胞生长速度较前明显增快,梭形细胞克隆状生长,形态趋于稳定。见图1。
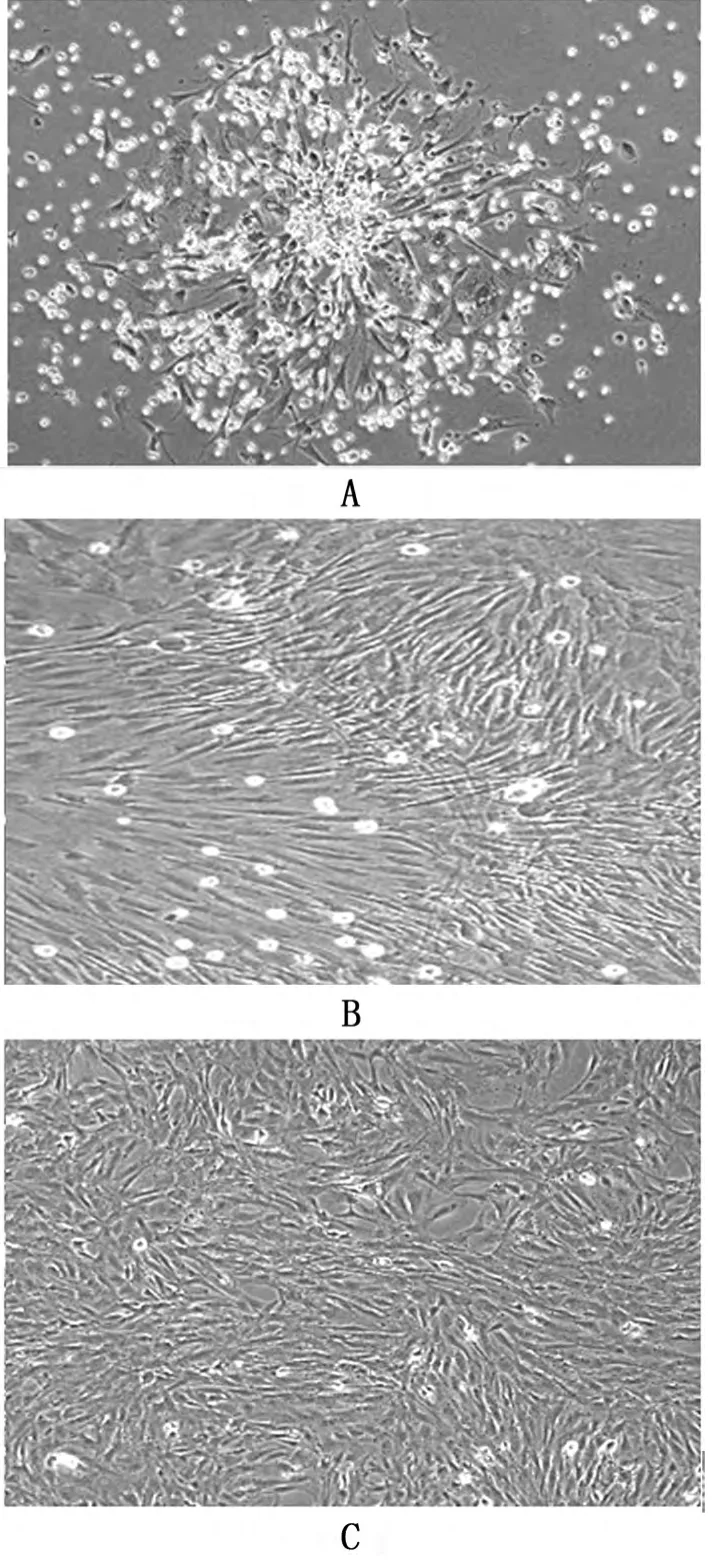
图1 不同培养时间BMSCs贴壁情况
2.2 大鼠BMSCs的鉴定结果
取生长旺盛的P3代细胞,应用流式细胞仪进行细胞表型鉴定:CD90阳性表达率99.2%,CD45阳性表达率0.9%,符合BMSCs鉴定标准,说明原代培养的BMSCs具有纯度高,均一性强的特性。见图2。
3 讨论
BMSCs因其自身具有多向分化潜能,取材容易,体外培养后可以高度纯化、大量扩增等优点,成为组织工程的种子细胞,已被应用于许多领域的研究,并成功诱导分化为骨、软骨、脂肪、神经、心肌等细胞[2-5],使得多年以来干细胞的诱导分化,干细胞的移植治疗始终是研究的热点[6-7],目前这些研究已初步取得一定疗效[8],为临床疾病的治疗提供了新思路,为临床患者带来曙光。
本实验成功分离、提取大鼠BMSCs。采用全骨髓贴壁培养法建立体外培养体系,经表面抗原表型鉴定为纯化BMSCs,并通过严格控制消化时间,严格无菌操作,成功实现BMSCs的体外大量扩增,为进一步的实验研究提供细胞来源,促进了干细胞诱导分化、移植治疗的进一步研究。并通过总结实验中的注意事项,大大提高了BMSCs提取及培养的成功率,避免了培养过程中时间的浪费,节省了科研经费,提高了科研的准确性。
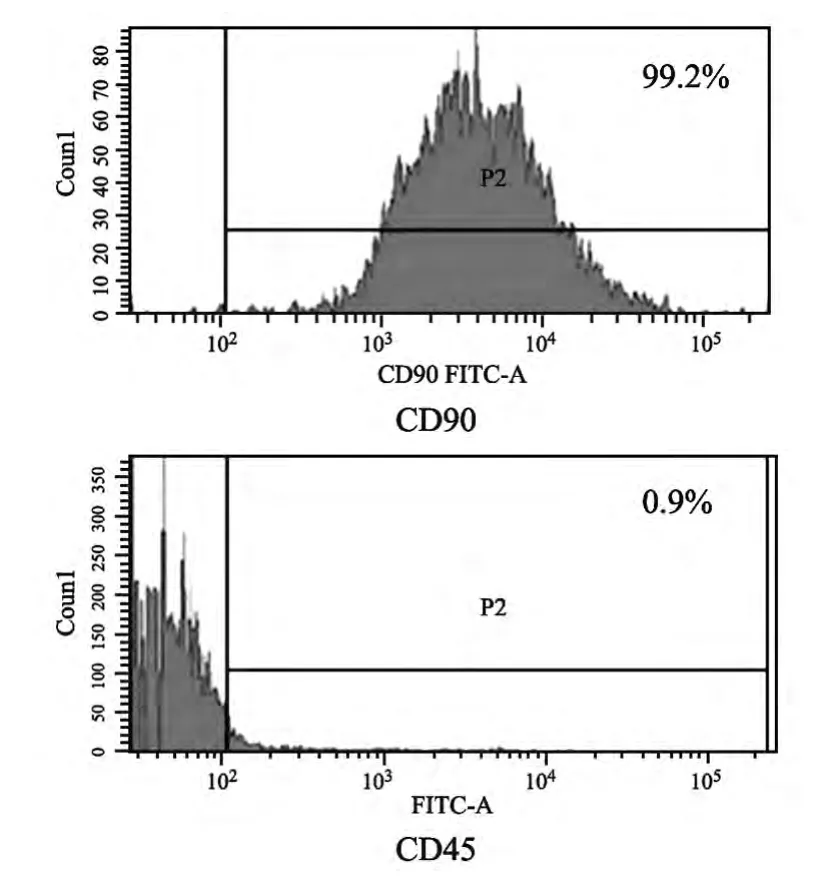
图2 CD90、CD45表达情况
BMSCs在骨髓中含量仅0.001%~0.1%,各种分离方法各有优缺点,至今尚无最佳分离培养方案。免疫磁珠法、流式细胞仪法因其对细胞活性损伤较大,甚至导致细胞死亡,并且造价昂贵,对实验室要求较高等原因,未能广泛应用。密度梯度离心是根据骨髓中各种细胞比重不同,通过加入percon液或淋巴细胞分离液提取相对较纯的BMSCs,但因多次离心,破坏了BMSCs生存的骨髓微环境,不利于细胞生长。而全骨髓贴壁培养法利用BMSCs的贴壁生长特性,通过不断换液,去除悬浮细胞,是目前操作最简单有效的方法。
由于BMSCs细胞表面尚未有特异抗体表达,目前多采用阳性表面标记物及阴性表面标记物相结合的办法鉴定。国际细胞治疗学会间充质及组织干细胞委员会在2006年提出了鉴定人来源的间充质干细胞最低的3条标准[9]:1)必须具备对塑料底物的贴壁特性。2)CD105、CD90、CD73等阳性表达率≥95%,而CD45,CD34,CD14或CD11b,CD79a或CD19,HLA-DR等的阳性表达率≤2%。3)体外诱导分化具有多向分化潜能。本文对P3代生长旺盛的细胞给予标记CD90、CD45进行表面抗原鉴定,结果显示CD90表面抗原阳性,CD45表面抗原阴性,虽然大鼠与人物种存在差异,但目前鉴定标准仍采用2006年标准进行[10]。
[1] Gamie Z,Tran G T,Vyzas G,et al.Stem cells combined with bone graft substitutes in skeletal tissue engineering[J].Expert Opin Biol Ther,2012,12(6):713-729.
[2] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells[J].The International Society for Cellular Therapy position statement Cytotherapy,2006,8(4):315-317.
[3] Dezawa M,Takahashi I,Esaki M,et al.Sciatic nerve regeneration in rats induced by transplantation of in vitro differentiated bone-marrow stromal cells[J].Eur J Neurosci,2001,14(11):1771-1776.
[4] Pikir BS.Susilowati H,Hendrianto E,et al.Reversin increase the plasticity of bone marrow-derived mesenchymal stem cell for generation of cardiomyocyte in vitro[J].Acta Med Indones,2012,44(1):23-27.
[5] Piryaei A,Soleimani M,Heidari M H,et al.Ultrastructural maturation of human bone marrow mesenchymal stem cellsderived cardiomyocytes under alternative induction of 5-azacytidine[J].Cell Biol Int,2015,39(5):519-530.
[6] Cuiffo B G,Karnoub A E.Mesenchymal stem cells in tumor development:emerging roles and concepts[J].Cell Adh Migr,2012,6(3):220-230.
[7] Rohaina C M,Then K Y,Ng A M,et al.Reconstruction of timbal stem cell deficient corneal surface with induced human bone marrow mesenchymal stem cells on amniotic membrane[J].Transl Res,2014,163(3):200-210.
[8] 罗建红,何学华.干细胞治疗心脏疾病的研究进展[J].医学综述,2013,19(3):410-414.
[9] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[10]Kedziorek D A,Hofmann L V,Fu Y,et al.X-ray-visible microcapsules containing mesenchymal stem cells improve hind limb perfusion in a rabbit model of peripheral arterial disease[J].Stem Cells,2012,30(6):1286-1296.

