膝关节韧带组织损伤与修复的力学生物学研究进展
王业全
(济宁医学院法医学与医学检验学院,山东 济宁272067)
膝关节在人体结构中起着重要的枢纽作用,是人体最大、结构最复杂的关节。膝关节韧带是稳定膝关节的重要结构,也是病变多发的部位。关节腔内的前交叉韧带、后交叉韧带(posterior cruciate ligament,PCL)等组织的修复能力很差,而这些组织又不同程度的容易受到机械损伤。当前面临的挑战就是撕裂损伤的膝关节韧带组织已经没有能力再修复或再生成具有原始功能性的韧带。膝关节韧带组织的修复和重建仍然是生物医学以及临床医学面临的重大难题。目前,膝关节外科手术依然是治疗ACL损伤的主要手段,但令人遗憾的是虽然手术有治疗作用,但它仍然是一种“拆东墙补西墙”以有损伤为代价的治疗方法,术后远景不佳,很难满足临床救治的需要,离人们所希望的“重建出一条具有完整功能的韧带”相差甚远[1]。
力学生物学是生物力学新兴的研究领域成为当前国内外研究的热点。力学生物学是研究通过体外施加力学刺激来模拟生物体损伤、修复机理,阐明机体的力学过程与生物学过程之间的相互关系,从而研发出新技术、新方法,促进生物医学基础与临床研究的发展[2]。
目前,临床上主要使用自体移植物、异体移植物和人工合成生物材料进行ACL重建手术。虽然用自体或异体移植物重建交叉韧带是临床手术的最佳选择,并且效果不错,如自体髌韧带移植能够保证较高的力学强度,但自体供区会继发髌腱炎、髌下脂肪垫挛缩、相应部位髌骨骨折等并发症。而异体移植物重建ACL不仅材料来源较少,而且会伴有免疫排斥反应,甚至有传播疾病的危险。作为生物移植物,自体和异体移植都要经历组织坏死、血管重建、细胞增殖和组织重塑“韧带化”的过程,移植物的强度会明显下降,影响术后效果。本文着重从力学生物学在膝关节韧带组织损伤与修复机理研究中应用的研究进展进行报道,为临床诊断与治疗提供新的思路。
1 膝关节韧带的结构与功能
膝关节韧带主要是由厚而致密,平行于纵轴的螺旋形胶原纤维束组成。成纤维细胞在胶原束之间,沿着力学加载的方向排列。在ACL组织中胶原蛋白大约占蛋白总量的80%,其中以I型胶原为主,其次为III型胶原,相比之下,在内侧副韧带(medial cruciate ligament,MCL)组织中胶原蛋白所占比例远远高于ACL组织,I型胶原和III型胶原分别占胶原蛋白总量的95%、5%。Woo等报道在兔子模型中 MCL的杨氏模量[(1120±153)MPa]是ACL组织[(516±64)MPa]的两倍之多,因此,MCL组织具有很强的力学特性[3]。
在膝关节韧带中每条韧带各尽其能,同时每条韧带又与其它韧带或组织协同完成一些身体机能方面的功能。ACL起于股骨髁间的后部,向前向下止于胫骨髁间隆突的前外侧,主要功能是防止膝关节胫骨过度前移(或股骨后移)。临床发现内侧副韧带或外侧副韧带(laterial collateral ligament,LCL)单独撕裂,仅能导致内侧面或外侧面方向的不稳,若ACL和MCL联合撕裂,则会导致内侧、向前和前内侧旋转的不稳。膝关节前交叉韧带还有一些其他方面的重要功能,如在保持关节面的生理压力方面起着重要的作用,有助于保护关节软骨,控制关节滑动。另外,韧带具有重要的本体感觉功能,从而对膝关节的运动有着重要意义。
2 ACL与MCL损伤与修复的差异
ACL是由一薄层滑膜组织包裹的细胞外结构,处于关节腔内部微环境中,一旦滑膜组织破裂,ACL暴露于关节液中,就会出现出血性故障,产生蛋白水解酶类。由于其特殊的关节位置和非常有限的血管环境,ACL不能形成中间瘢痕组织且缺乏最初的炎性反应,造成组织不能愈合[4-5]。MCL组织损伤修复期间能够得到周围血管提供的足够营养,从而促进组织自身修复(图1)[1]。Murray等研究发现利用富含血小板的血浆制成的胶原支架有利于损伤的ACL修复[6]。
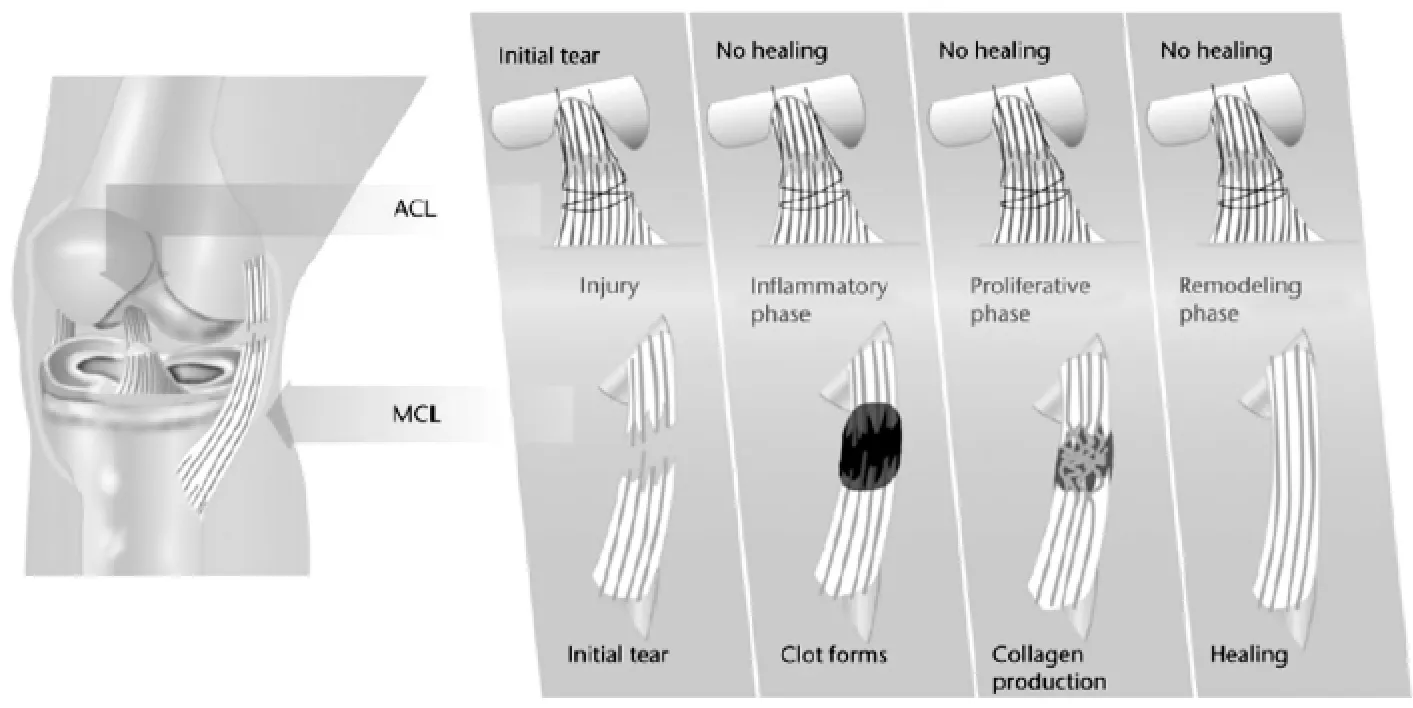
图1 ACL与MCL修复能力差异示意图
ACL和MCL组织本身遗传性差异能够帮助解释它们不同的愈合能力。众多的研究表明,ACL与MCL组织本身存在特异性差异如:细胞的黏附、迁移和增殖等。细胞增殖、迁移、蛋白合成以及胞外基质合成在结缔组织损伤后修复以及组织重塑中起主要作用。MCL成纤维细胞增殖与迁移的能力都高于ACL成纤维细胞,并且MCL成纤维细胞对I、III型胶原的黏附力远远高于ACL成纤维细胞。据报道,机械拉伸损伤后的ACL成纤维细胞中I型胶原和III型胶原的mRNA表达都增加了,在MCL和ACL受伤部位,MCL组织中原胶原的mRNA表达高于ACL组织[7]。但是,ACL和MCL的损伤与修复过程是非常复杂的,需要进一步对ACL损伤机理进行更加深入的研究。ACL与MCL本身遗传特异性差异确实是其修复能力存在差异的一个主要因素,但是通过外源性施加生长因子等方法可以很好地改善两者之间存在的差异[8]。
3 力学生物学在韧带组织损伤与修复的应用
由于ACL损伤后治疗手段匮乏,因此,需要对ACL的损伤机制做更深入的研究。ACL损伤后关节腔内大量的基质金属蛋白酶(matrix metalloproteinases,MMPs)累积可能是导致ACL不能自身修复的原因之一。无论是正常、还是损伤的组织,细胞外基质的降解与合成都处在一个动态平衡过程。在这个过程中,老化的或者损伤的组织退化降解,被新合成的组织所代替,这个平衡受到MMPs和基质金属蛋白酶抑制剂 (tissue inhibitors of metalloproteinases,TIMPs)协调控制。TIMPs和MMPs是作为调节组织再生的效应分子,其中MMPs是组织修复过程的退化因子,而TIMP是其抑制因子。
长期慢性溃疡组织液检测发现组织液中大量MMPs的释放与积累,损伤后早期MMPs的表达明显增加,而其天然特异性抑制剂TIMP-1的表达则无显著变化[9]。细胞水平实验结果表明,在机械损伤应力作用下,ACL成纤维细胞释放大量酶原形式 MMP-2,并可转化为活化形式的 MMP-2,从而破坏修复的进程。研究还发现ACL损伤后,整体MMPs的活性和MMPs基因表达一致上调,而TIMPs作用则不显著,这表明ACL损伤后,MMPs/TIMPs平衡被破坏[10-11]。
当韧带组织撕裂后,损伤的ACL组织就完全暴露于关节液中,关节液中的炎症因子也已经被证明在正常和病理条件下可以诱发一系列的MMPs的表达。当对韧带组织施加机械应力时,细胞因子IL-1β、TGF-β1和 TNF-α都能显著增加 MMPs的表达[12-13]。因此,可以认为 ACL损伤后不能修复的原因可能是由于机械损伤与炎症因子进一步诱导MMPs的表达与酶的活性增加从而破坏关节腔内组织胞外基质合成与降解平衡导致。
Zhou等研究发现在机械应力的作用下ACL成纤维细胞比MCL成纤维细胞释放更多的酶原以及活化形式的MMP-2,且是 MCL成纤维细胞的 MMP-2活性的20倍左右[14]。ACL成纤维细胞与MCL成纤维细胞相比在机械损伤应力作用下赖氨酰氧化酶 (Lysyl oxidase,LOX)的表达不同,无论分子还是蛋白水平MCL都显著高于ACL[15]。大鼠ACL扭转损伤模型也证明膝关节腔内组织在ACL扭转损伤后释放大量的MMPs,尤其是滑膜组织,大量酶原形式的MMP-2转化成活性形式[14]。因此,研究关节腔内组织在机械应力作用下诱导MMPs、LOXs等组织损伤与修复相关蛋白的表达机制以及炎症因子的作用,可以使我们更深入的了解组织损伤与修复过程。
因此,力学生物学在ACL损伤与修复以及组织功能性再生的体外实验研究中是不可或缺的。它可以很好的模拟体内ACL组织的受力情况,为其机理研究提供可靠的实验平台。
4 力—化学协同效应对ACL损伤与修复的影响
组织损伤后都会伴随急性炎症反应,炎症因子与细胞之间的响应在皮肤修复以及韧带/肌腱损伤等都已经得到深入的研究。炎症因子在损伤修复机制过程中尤其是在急性炎症期起到重要的调控作用。Tang等实验结果表明ACL损伤后,炎症因子(IL-1β、IL-6和 TNF-α)的表达水平呈时间依赖性增高[16]。因此,炎症期和瘢痕组织形成等常规的组织损伤愈合机制在ACL损伤后同样要经历。如果ACL的损伤没有得到及时有效的治疗,关节液中高表达的炎症因子尤其是IL-1β和TNF-α将会引起MMPs等降解酶类活性的增加,从而导致损伤的ACL以及关节软骨等关节腔组织的降解,最终发展成骨关节炎等退行性病变。
在韧带组织损伤与修复过程中,伴随着旧组织的降解以及新组织的合成。胞外基质的降解与合成是一个极其复杂的调控过程,通过对这一过程的调控会很大程度上影响韧带的修复能力。在韧带组织重塑过程中,胞外基质降解与合成这一动态过程是由MMPs、TIMPs以及LOXs进行协同调控[17]。总体上说,在组织重塑胞外基质降解过程中MMPs起主导作用,反之TIMP起主要作用。
急性损伤的组织液中MMP-2和MMP-9的活性显著增加,在慢性皮肤溃疡疾病中高表达的MMPs最终会导致伤口不能够愈合[18]。Tang等研究发现大鼠ACL撕裂损伤后,关节液中酶原形式的 MMP-2活性随时间依赖性增强,并且整体MMPs家族的活性随着损伤时间的增加而增强。ACL的机械损伤是导致炎症反应以及MMPs活性增强的直接原因,但是炎症因子的高表达也是诱导MMPs活性进一步增强的因素。
与ACL相比,滑膜组织等关节腔内其它组织都能够向体外组织培养的上清液中释放更多的酶原以及活化形式的MMP-2,并且大量的酶原形式MMP-2转化为活化形式。在ACL损伤的同时,关节腔内组织如滑膜组织也会受到不同程度的损伤,巨噬细胞、炎症细胞也会增强滑膜细胞MMP-2的表达[19]。Zhang等[20]研究表明,在机械损伤应力作用下 TNF-α抑制LOXs的表达,却上调MMPs的表达,而TGF-β1则都上调 MMPs及LOXs的表达。因此,在关节腔内组织中滑膜组织是关节液中MMP-2累积的主要贡献者,并能使大量的酶原形式MMP-2转化为活化形式[16]。
此外,其它关节腔内组织比如:后交叉韧带、关节软骨以及半月板在ACL损伤后的关节腔微环境内也会发生相应的变化。与MCL所处的微环境相比,ACL处于一个相对封闭的关节腔微环境,因此,有利于炎症因子以及MMPs的累积。大量累积的MMPs能够打破新组织合成与降解之间的平衡,从而导致关节腔内组织的可行性退化,不利于组织的修复。
ACL与MCL两种韧带细胞修复的差异可能起因于炎症因子的不同作用。炎症因子可改变细胞表面受体的数量、密度、黏附区域或成纤维细胞的形态,并影响细胞的迁移速度。Sung等[21]研究发现LPS、TNF-α、C5a等能够增加 ACL与 MCL成纤维细胞的粘附性,在不同时间点抑制作用则不同。
Yang等[16]研究发现在ACL损伤后关节液中IL-1β和TNF-α的表达量显著增加,这些因子通过刺激其它关节腔内组织进一步调控MMPs的表达。Tsuzaki等[22]发现在人的肌腱机械损伤后,肌腱成纤维细胞对外源性炎症因子通过细胞表面特异性受体进行响应,通过表达COX-2和PGE2来激活急性/慢性炎症反应,并释放大量MMPs降解胞外基质,IL-1β能够诱导韧带成纤维细胞MMP-1、MMP-3mRNA的表达。另有研究结果表明,IL-1β和 TNF-α两种炎症因子都能促进 MMP-2活性的增强,其中以IL-1β的作用最为显著。ACL成纤维细胞MMP-2的活性对IL-1β不仅有剂量依赖性而且随作用时间的增加而显著增强,将这两种炎症因子共同作用于ACL成纤维细胞发现对MMP-2的活性及蛋白表达有着显著的增强,这也表明ACL成纤维细胞对炎症因子刺激非常敏感,在力—化学协同作用下促进MMPs的释放以及活性的增强。IL-1β和TGF-β1在机械应力作用下均能上调LOXs家族的表达,且以MCL细胞中的表达尤为显著,IL-1β上调LOXs家族的表达呈剂量依 赖 性[23-24]。TNF-α 抑 制 韧 带 成 纤 维 细 胞 中LOXs的表达,且以ACL成纤维细胞的抑制效果较为显著[25]。由于关节液中炎症因子以及MMPs的大量累积,从而导致胞外基质尤其是I型胶原的降解,不利于韧带的修复。
在生理条件下,ACL损伤后机械应力与其它炎症因子、细胞因子共同作用于损伤的关节腔内组织。这也就意味着ACL损伤后关节腔内的炎症因子以及机械应力对ACL成纤维细胞MMPs的活性有着显著的影响,尤其是在这种复杂的关节腔微环境下对MMPs的活性具有进一步放大的作用。
此外,关节腔是一个相对密闭的微环境,被滑膜组织所包围的关节腔微环境有利于炎症因子的累积。随着MMPs的表达以及活性的增加,会使新组织合成与坏死组织降解之间的平衡被打破,从而导致损伤后的关节腔内组织可行性退化以致消失。
5 结语
力学生物学在膝关节韧带损伤中的应用研究得到了国内外研究者越来越广泛的关注。ACL损伤后除了组织本身存在的先天遗传不足外,其损伤后关节腔力-化学微环境的变化也是导致不能自我修复的主要原因。因此,通过弥补ACL组织的先天不足和改善损伤后关节腔微环境对ACL修复起到积极促进作用。
[1] Kiapour A M,Murray M M.Basic science of anterior cruciate ligament injury and repair[J].Bone Joint Res,2014,3:20-31.
[2] 姜宗来.从生物力学到力学生物学的思考[J].医用生物力学,2013,38-39.
[3] Woo S L,Newton P O,MacKenna D A,et al.A comparative evaluation of the mechanical properties of the rabbit medial collateral and anterior cruciate ligaments[J].J Biomech,1992,25:377-386.
[4] Bokoch G M,Katada T,Northup J K,et al.Identification of the predominant substrate for ADP-ribosylation by islet activating protein[J].J Biol Chem,1983,258:2072-2075.
[5] Lee J,Harwood F L,Akeson W H,et al.Growth factor expression in healing rabbit medial collateral and anterior cruciate ligaments[J].Iowa Orthop J,1998,18:19-25.
[6] Murray M M,Spindler K P,Devin C,et al.Use of a collagenplatelet rich plasma scaffold to stimulate healing of a central defect in the canine ACL[J].J Orthopaed Res,2006,24:820-830.
[7] Kim S G,Akaike T,Sasagawa T,et al.Gene expression of type I and type III collagen by mechanical stretch in anterior cruciate ligament cells[J].Cell Structure and Function,2002,27:139-144.
[8] Yoshida M,Fujii K.Differences in cellular properties and responses to growth factors between human ACL and MCL cells[J].J Orthop Sci,1999,4:293-298.
[9] Subramaniam K,Pech C M,Stacey M C,et al.Induction of MMP-1,MMP-3and TIMP-1in normal dermal fibroblasts by chronic venous leg ulcer wound fluid*[J].Int Wound J,2008,5:79-86.
[10]Zhang J,Yang L,Tang Z,et al.Expression of MMPs and TIMPs family in human ACL and MCL fibroblasts[J].Connect Tissue Res,2009,50(1):7-13.
[11]Tang Z,Yang L,Xue R,et al.Differential expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases in anterior cruciate ligament and medial collateral ligament fibroblasts after a mechanical injury:involvement of the p65subunit of NF-kappaB[J].Wound Repair Regen,2009,17(5):709-716.
[12]Wang Y,Tang Z,Xue R,et al.TGF-beta1promoted MMP-2 mediated wound healing of anterior cruciate ligament fibroblasts through NF-kappaB[J].Connect Tissue Res,2011,52(3):218-225.
[13]Wang Y,Tang Z,Xue R,et al.Combined effects of TNF-alpha,IL-1beta,and HIF-1alpha on MMP-2production in ACL fibroblasts under mechanical stretch:an in vitro study[J].J Orthop Res,2011,29:1008-1014.
[14]Zhou D,Lee H S,Villarreal F,et al.Differential MMP-2activity of ligament cells under mechanical stretch injury:an in vitro study on human ACL and MCL fibroblasts[J].J Orthop Res,2005,23:949-957.
[15]Xie J,Huang W,Jiang J,et al.Differential expressions of lysyl oxidase family in ACL and MCL fibroblasts after mechanical injury[J].Injury,2013,44(7):893-900.
[16]Tang Z,Yang L,Wang Y,et al.Contributions of different intraarticular tissues to the acute phase elevation of synovial fluid MMP-2following rat ACL rupture[J].J Orthop Res,2009,27(2):243-248.
[17]Xie J,Jiang J,Zhang Y,et al.Up-regulation expressions of lysyl oxidase family in Anterior Cruciate Ligament and Medial Collateral Ligament fibroblasts induced by Transforming Growth Factor-Beta 1[J].Int Orthop,2012,36(1):207-213.
[18]Wysocki A B,Staianocoico L,Grinnell F.Wound fluid from chronic leg ulcers contains elevated levels of metalloproteinases MMP-2and MMP-9[J].Invest Dermatol,1993,101(1):64-68.
[19]Wang Y,Yang L,Zhang J,et al.Differential MMP-2activity induced by mechanical compression and inflammatory factors in human synoviocytes[J].Mol Cell Biomech,2010,7(2):105-114.
[20]Zhang Y,Huang W,Jiang J,et al.Influence of TNF-alpha and biomechanical stress on matrix metalloproteinases and lysyl oxidases expressions in human knee synovial fibroblasts[J].Knee Surg Sports Traumatol Arthrosc2014,22(9):1997-2006.
[21]Witkowski J,Yang L,Wood D J,et al.Migration and healing of ligament cells under inflammatory conditions[J].J Orthop Res,1997,15(2):269-277.
[22]Tsuzaki M,Guyton G,Garrett W,et al.IL-1beta induces COX2,MMP-1,-3and-13,ADAMTS-4,IL-1beta and IL-6 in human tendon cells[J].J Orthop Res,2003,21(2):256-264.
[23]Xie J,Wang C,Huang D Y,et al.TGF-beta1induces the different expressions of lysyl oxidases and matrix metalloproteinases in anterior cruciate ligament and medial collateral ligament fibroblasts after mechanical injury[J].J Biomech,2013,46(5):890-898.
[24]Xie J,Wang C,Yin L,et al.Interleukin-1beta influences on lysyl oxidases and matrix metalloproteinases profile of injured anterior cruciate ligament and medial collateral ligament fibroblasts[J].Int Orthop,2013,37(3):495-505.
[25]Xie J,Jiang J,Huang W,et al.TNF-alpha induced down-regulation of lysyl oxidase family in anterior cruciate ligament and medial collateral ligament fibroblasts[J].Knee,2014,21(1):47-53.

