乳腺癌分子分型在新辅助化疗中的疗效预测*
史亚飞 韩晓菲 李 磊 张仁亚 刘启龙
(1济宁医学院附属医院,山东 济宁272029;2济宁市第四人民医院,济宁272000)
乳腺癌是一类分子水平上高度异质的肿瘤,常根据临床和病理表现划分不同的分期及类型。2000年Perou等[1]提出乳腺癌分子分型的概念,即根据乳腺癌基因表达的差异,将乳腺癌分为Luminal A 型、Luminal B型、Her-2过表达型、Basallike型和Normal-like型。此概念逐步为广大学者接受并成为乳腺癌研究领域的热点之一。部分乳腺癌患者在治疗中出现肿瘤稳定甚至进展,不仅无法受益于新辅助化疗,还要承受化疗带来的不良反应。因此,寻求能够预测新辅助化疗疗效的生物指标,实现以分子分型为基础的乳腺癌个体化化疗方案成为国内外学者研究的热点。本文旨在探讨中国女性乳腺癌患者中不同分子亚型的临床特点及其对新辅助化疗的敏感性,以期为临床中分子靶向个体化治疗提供依据。
1 对象和方法
1.1 对象
选择济宁医学院附属医院2011年1月至2013年12月收治的女性乳腺癌患者172例,所有患者均符合以下标准:1)临床II~III期;2)无其他恶性肿瘤史;3)临床一般情况(包括临床大小、淋巴结状态、肿瘤细胞分级等)和受体状态(包括ER、PR、Her-2、Ki-67等)完整,如为三阴性乳腺癌需检测EGFR、CK5/6;4)至少接受4个疗程以上的新辅助化疗;5)Her-2过表达型术前未接受曲妥珠单抗治疗;6)所有患者术前经空芯针活检病理确诊,一般情况良好,Karnofsky评分为80分以上,均有临床可测量的病灶。化疗前通过肝脏彩超、胸片/胸部CT和骨扫描排除远处转移。
1.2 方法
1.2.1 新辅助化疗方案 为吡柔比星联合多西紫杉醇 方 案 (Taxotere plus pirarubicinhydrochloride,THP T);多西紫杉醇75mg/m2,持续3h静脉滴入1d,吡柔比星50mg/m2,静脉滴入1d,化疗前1天给予口服地塞米松7.5mg,每天2次,连用3d,化疗前30min给予地塞米松10mg静注,21d为1个疗程。完成化疗周期第16~20天后进行手术治疗,术前1~2天评估疗效。在2周期和4周期新辅助化疗后评估疗效,所有临床部分缓解(clinical partial remission,CPR)或稳定(clinical stable disease,CSD)的患者均完成6周期化疗,如评估疗效为疾病进展(progressive disease,PD)的患者更换二线化疗或手术治疗。病理完全缓解(pathological complete remission,PCR)定义为化疗后原发肿瘤区域及区域淋巴结均无浸润性癌残留,其中残留原位癌也认为病理完全缓解。
1.2.2 免疫组化分析及分子分型 经过空芯针穿刺活检的组织标本均通过免疫组化方法确定雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(Human epidermal growth factor receptor 2,Her-2)、细胞增殖抗原Ki-67的状态。如为三阴性乳腺癌,加测表皮生长因子受体(epidermal growth factor receptor,EGFR)、细胞角蛋白 CK5/6。ER、PR阳性均作义为≥10%的肿瘤细胞核内表达性激素受体标记。Her-2免疫组化及荧光原位杂交技术(fluorescence in situ hybridization,FISH)判读标准参照《乳腺癌 Her-2检测指南》[2]。0~1+为阴性,2+不纳入统计资料,3+为阳性。Ki-67≥14%为阳性,Ki-67<14%为阴性。根据肿瘤细胞中ER、PR、Her-2、Ki-67、EGFR、CK5/6等表达情况将乳腺癌分为4型。见表1。

表1 乳腺癌分子亚型
1.3 观察指标
4种乳腺癌分子分型患者所占比例,以及各型患者的发病年龄、肿瘤大小、淋巴结状态、临床分期、新辅助化疗疗效等。
1.4 统计学方法
采用SPSS13.0统计软件进行统计学分析。
2 结果
2.1 4种乳腺癌分子分型的临床特征比较
免疫组化结果显示,172例患者中,Luminal A型占47.1%(81例),Luminal B 型占23.8%(41例),Her-2过表达型占11.6%(20例),Basal-like型占16.3%(28例)。4种分子分型的临床特征比较见表2。
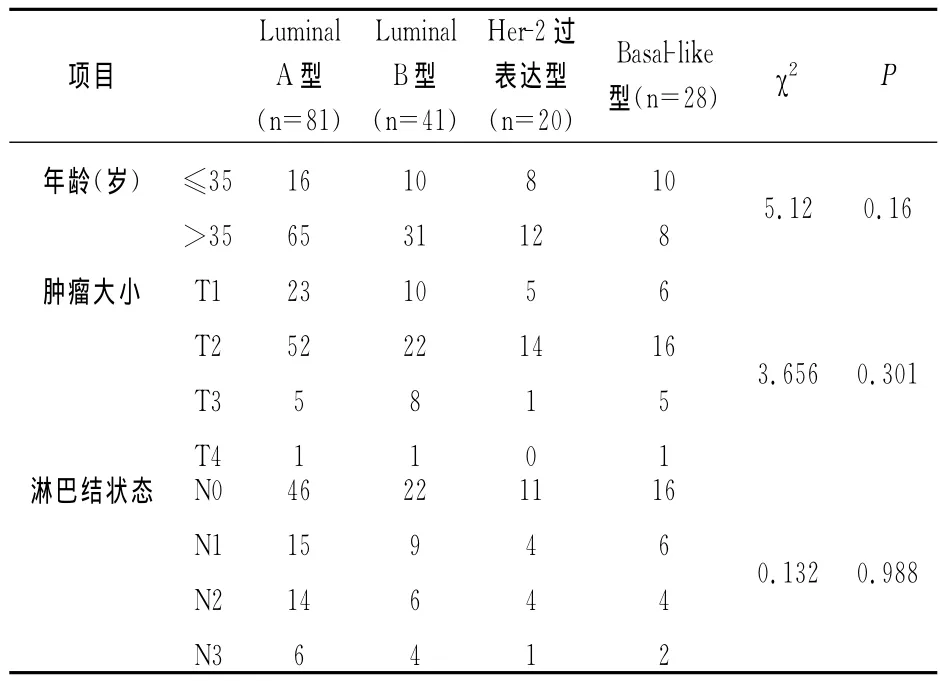
表2 4种分子分型乳腺癌患者临床特征比较
2.2 不同乳腺癌分子分型对新辅助化疗疗效比较
对172例患者进行新辅助化疗疗效评价,结果显示有33例患者获得病理完全缓解,137例患者化疗后仍有癌残留。新辅助化疗对不同乳腺癌分子分型有效的概率不全相同,χ2=17.878,P<0.001,见表3。进一步两两比较,将增大Ι类错误的机会,为此根据比较的次数修正检验水准,因为4组间两两比较共比较6次,此时α=0.05/6=0.0083。在此检验水准下Basal-like型病理完全缓解率(42.9%)高于Luminal A型及Luminal B型(11.1%、12.2%),差别有统计学意义。Her-2过表达型病理完全缓解率(35%)与Lumianl型比较无统计学意义。见表4。
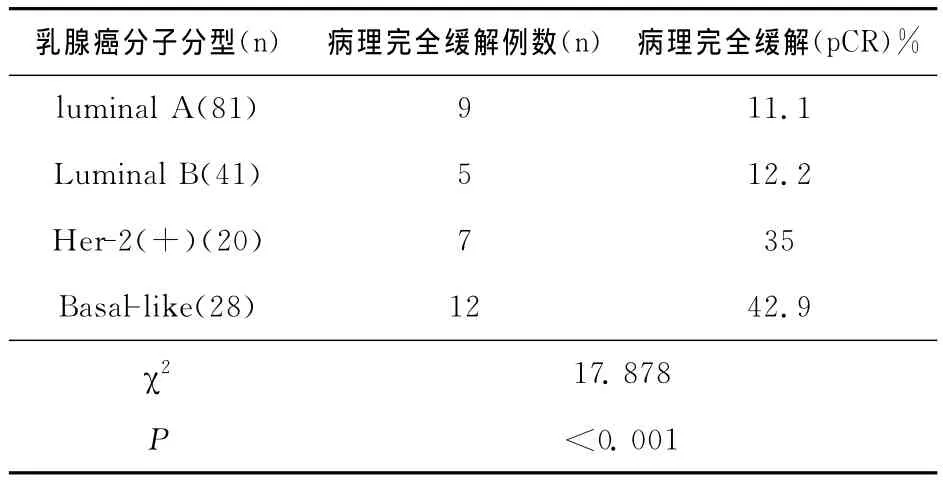
表3 新辅助化疗对不同乳腺癌分子分型临床效果比较(n,%)
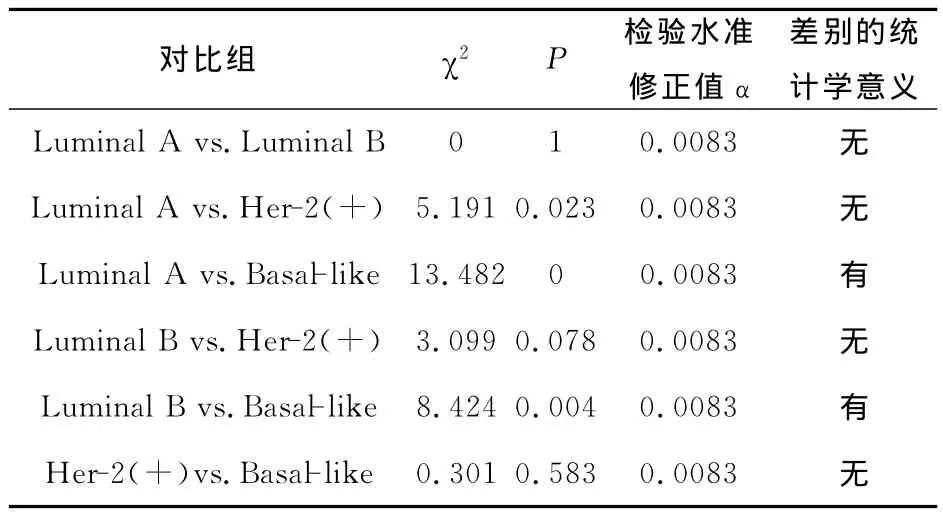
表4 不同乳腺癌分子分型新辅助化疗有效概率的两两比较
3 讨论
乳腺癌是一类严重危害女性健康的恶性肿瘤,具有高度的异质性。传统的病理形态学诊断及分期已经无法适应肿瘤学研究的需求,随着影像学技术和分子生物学技术的广泛应用,乳腺癌基因表达谱的研究持续深入,肿瘤临床个体化治疗得到快速发展。目前,在分子水平上结合肿瘤的发生发展、病理学机制及生物学行为的研究成为当前研究热点之一。
2011年《St.Gallen全球专家共识》推荐依据分子分型进行辅助治疗。然而,基因水平的检测操作复杂,工作量大,费用高昂,限制了其在临床上的应用。目前许多学者利用免疫组化方法确定乳腺癌分子分型,同时进行流行病学及临床特征的研究[3-5]。
我们在常规检测ER、PR、Her-2的基础上开展对 Ki-67、EGFR、CK5/6的检测。利用上述6个指标进行分类,观察鲁西南地区各分子亚型的临床特点。本组172例乳腺癌患者的临床资料,将其分为Luminal A型、Luminal B型、Her-2过表达型、Basal-like型,各亚型比例分别为47.1%、23.8%、11.6%、16.3%。本组Luminal A型占有较高的比例,与Ahn H J[6]的研究中Lumimal B型占有较高比例有所不同,可能由于本组研究例数较少所致。
新辅助化疗在局部晚期乳腺癌治疗中的作用尤为关键,能够显著减小肿瘤、降低分期。新辅助化疗后病理完全缓解(PCR)作为提高无病生存期(disease-free survival,DFS)及总生存期 (overall survival,OS)的独立预测因素,已为临床普遍接受。本文中Lumial A型、Luminal B型、Her-2过表达型以及Basal-like型病理完全缓解率分别为11.1%、12.2%、35.0%、42.9%。其中,Basal-like型有较高的病理完全缓解率,与Bhargava等[7]研究结果相同。
本组 Her-2过表达型乳腺癌的pCR与Luminal型无统计学差异,可能由于未联合使用分子靶向治疗所致。因此,对于Her-2过表达型乳腺癌患者,为了达到最大PCR,新辅助治疗宜选择化疗联合曲妥珠单抗(或拉帕替尼、帕妥珠单抗)。Basal-like型虽然有较高的病理完全缓解率,但预后相对较差,可能由于治疗手段单一所致。三阴性乳腺癌患者的DNA损伤修复存在一定缺陷,提示其对铂类及烷化剂等作用于DNA的药物可能较为敏感。一般而言,对于基底细胞样型乳腺癌,新辅助治疗推荐蒽环类、紫杉类以及铂类药物。另外,针对该型患者的一系列前瞻性研究正在开展,其中还包括了西妥昔单抗(EGFR单克隆抗体)、依维莫司(mTOR抑制剂)、PARPI抑制剂和贝伐珠单抗等靶向药物[8-9]。
Luminal A型患者对化疗相对不敏感,主要采用内分泌治疗。2015年《St.Gallen全球专家共识》推荐对于淋巴结阳性数≥4枚或肿瘤直径>5cm等高危因素需要考虑化疗,但化疗方案易选用环磷酰胺/甲氨蝶呤/氟尿嘧啶或多西他赛/环磷酰胺或表柔比星/环磷酰胺等较为“温和”的化疗方案[10]。
对于Luminal B型中 Her-2阴性但 Ki-67高表达(≥14%)患者,如果临床上无立即化疗指征,可首先考虑内分泌治疗。对于Luminal B-Her-2阳性型,化疗联合曲妥珠单抗治疗相对于单纯化疗不但提高有效率和延长无进展生存期(progression free survival,PFS),而且能显著延长OS。而内分泌治疗联合抗Her-2治疗仅可改善PFS,对OS改善无益处。本组Luminal A型与Luminal B型新辅助化疗疗效无明显差异,考虑未对Luminal BHer-2阳性患者联合分子靶向治疗。因此,Luminal B-Her-2阳性型患者,首先推荐在化疗基础上联合抗Her-2靶向治疗,内分泌治疗联合抗Her-2治疗仅适用于不宜或不愿意接受化疗的患者。
乳腺癌的分子分型已经成为判断乳腺癌患者复发风险以及治疗方法选择上的重要依据,针对分子分型设计的临床研究能够实现药物治疗的真正个体化,是今后乳腺肿瘤研究的方向。
[1] Perou C M.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[2] 江泽飞,邵志敏,徐兵河.人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识[J].中华肿瘤杂志,2010,32(2):158-160.
[3] García Fernández A,Chabrera C,García Font M.Differential patterns of recurrence and specific survival between luminal A and luminal B breast cancer according to recent changes in the 2013St Gallen immunohistochemical classification[J].Clin Transl Oncol,2015,17(3):238-246.
[4] Atif Ali Hashmi.Molecular subtypes of breast cancer in South Asian population by immunohistochemical profile and Her2neu gene amplification by FISH technique:association with other clinicopathologicparameters[J].Breast J,2014,20(6):578-585.
[5] Wang C H,Li J Z,Zhang W.Breast cancer molecular subtypes of Uygur and Han in Xinjiang of China[J].Int J ClinExp Med,2014,7(4):1116-1121.
[6] Ahn H J,Jung S J,Kim T H.Differences in clinical outcomes between Luminal A and B type breast cancers according to the St.Gallen consensus 2013[J].J Breast Cancer,2015,18(2):149-159.
[7] Bhargava R,Beriwal S,Dabbs D J.Immunohistochemical surrogate markers of breast cancer molecular classes predicts response to neoadjuvant chemotherapy:a single institutional experience with 359cases[J].Cancer,2010,116(6):1431-1439.
[8] Bose S.Triple-negative breast carcinoma:morphologic and molecular subtypes[J].Adv Anat Pathol,2015,22(5):306-313.
[9] He J,Yang J,Chen W.Molecular features of triple negative breast cancer:microarray evidence and further integrated analysis[J].PLoS One,2015,10(6):e0129842.
[10]Coldhirsch A,Winer E P,Coates A S,et al.Personalizing the treatment of women with early breast cancer:highlights of the St Callen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J].Ann Oncol,2013,24(9):2206-2223.

