绵羊UCP2基因的克隆及其在脂肪组织中的季节性差异表达
刘建华,乔利英,郭云雁,贾夏丽,刘文忠
(山西农业大学动物科技学院,太谷 030801)
绵羊UCP2基因的克隆及其在脂肪组织中的季节性差异表达
刘建华,乔利英,郭云雁,贾夏丽,刘文忠*
(山西农业大学动物科技学院,太谷 030801)
旨在研究绵羊UCP2基因的克隆和在脂肪组织中的季节性表达差异,以揭示季节对UCP2基因表达的调控作用。本研究采用RT-PCR和RACE法克隆UCP2 cDNA全长序列。以南非肉用美利奴和山西肉用绵羊为对象,用real-time PCR和免疫组化技术检测UCP2 mRNA及其编码蛋白在冬春和夏秋2个阶段6种脂肪组织(皮下脂肪、肠系膜、大网膜、小网膜、腹膜后脂肪和肾周脂肪)中的差异表达。结果表明,绵羊UCP2 cDNA全长1 641 bp,包括8个外显子,开放阅读框930 bp,编码309个氨基酸。UCP2 mRNA在6种脂肪组织中均有表达,其中肾周脂肪中的表达量最高,皮下脂肪中最低,即深层脂肪中的表达量高于浅层脂肪(P<0.05)。UCP2蛋白的组织表达趋势与mRNA相似,且均分布于细胞膜上。二者的表达均受季节的显著影响,冬春阶段的表达量高于夏秋季节(P<0.05)。这些结果说明绵羊脂肪组织中UCP2基因的表达与季节有关,以维持体温和调节机体能量平衡。
绵羊;UCP2基因;基因表达;脂肪组织;季节性
解偶联蛋白(Uncoupling proteins,UCPs)是机体组织特异表达的线粒体内膜转运蛋白,当它被激活时,可产生质子转运现象,使线粒体的氧化磷酸化解偶联,抑制ATP合成,能量以热能的形式消耗[1]。UCP2属于UCPs家族的6个成员之一,最早从人的肺和骨骼肌中克隆得到[2],分布于动物的多种组织和器官中[3]。研究发现,人[4]、鼠[5]、猪[6]、牛[7]UCP2基因的突变与能量失衡、肥胖、背膘厚和瘦肉率等有关。大鼠脂肪组织中UCP2基因的过表达能上调解偶联作用,导致基础能量代谢增强[8]。小鼠巨噬细胞中UCP2基因的表达产物通过调控脂肪酸合成酶FASN来调节脂质合成[9]。因而认为UCP2基因对能量代谢具有重要的调控作用。
脂肪是动物体内重要的能量贮存形式,主要通过产热作用来维持机体的能量代谢平衡。UCP2基因的表达受血液中脂肪酸浓度、激素等多种因素影响。在小鼠的白色脂肪组织中,UCP2 mRNA的表达量随脂肪酸的增加而提高[10]。在鼠的前脂肪细胞中,其表达受不饱和脂肪酸的显著诱导[11]。通过饲喂一定量的瘦素,绵羊骨骼肌[12]和猪脂肪组织[13]中UCP2 mRNA表达显著增加。甲状腺素[14-15]对人UCP2基因在脂肪组织中的表达具有上调作用,而生长激素[16]则下调其表达。
绵羊是一种重要的经济家畜,可生产肉、毛、皮、乳等多种产品。就肉用而言,脂肪代谢对肉质品质至关重要。绵羊UCP1[17]、UCP4[18]和UCP5[19]基因的克隆及其在脂肪组织中的表达研究已有报道,而UCP2基因的结构及其在脂肪代谢中的作用尚不得而知。作为草食家畜,绵羊的脂肪代谢和能量平衡与季节密切相关,特别是对于放牧管理的绵羊。本研究拟克隆绵羊UCP2 cDNA全长序列,分析UCP2 mRNA及其编码蛋白在不同季节绵羊脂肪组织中的表达差异,探讨该基因在脂肪代谢过程中的作用。
1 材料与方法
1.1 试验动物
试验所用南非肉用美利奴羊(South African Mutton Merino,SAM)和山西肉用绵羊(Shanxi Dam Line,SHD)来自山西省沁水示范牧场。南非肉用美利奴羊由澳大利亚引进,属肉毛兼用品种。山西肉用绵羊是以南非肉用美利奴为父本,以小尾寒羊、夏洛来×考力代杂种及本地绵羊为母本,培育的一个合成母本品系。公、母羊以放牧为主,18月龄配种。羔羊100日龄断奶,断奶后进行放牧加补饲。补饲料由干苜蓿、干草、玉米、豆粕和预混料组成。
1.2 组织样品采集
于冬春和夏秋两个季节,分别从两个群体中随机选取18月龄公羊各4只进行屠宰。采集皮下、大网膜、小网膜、肠系膜、腹膜后、肾周6种脂肪组织,一份迅速投入液氮中保存,用于RNA提取,另一份浸泡于Bouin’s液固定24 h,然后转入75%的乙醇,用于组织切片。
1.3 绵羊UCP2基因全长cDNA序列的克隆测序
参照Invitrogen的总RNA提取试剂盒说明书,提取脂肪组织总RNA。按照SYBR®PrimeScriptTMRT-PCR Kit反转录试剂盒说明书,合成cDNA第一链。用BLAST在线软件比对牛(BC102839)、人(BC011737)和鼠(BC012697)UCP2基因的cDNA序列,以保守区序列为模板,用Primer premier 5.0软件设计引物P1(表1),以获得部分cDNA序列。在此基础上,设计2条3′ RACE正向引物和2条5′ RACE反向引物(表1),按照Invitrogen的GeneRacer®Kit试剂盒说明书,通过巢式PCR,进行UCP2基因5′和3′端cDNA的克隆。用Cotig软件拼接序列。引物由上海生工公司合成,序列由TaKaRa测定。
1.4 Real-time PCR检测不同季节绵羊脂肪组织中UCP2 mRNA的表达水平
本研究根据绵羊UCP2基因(KC355436)和内参基因(18SrRNA)序列,利用Primer 3 plus在线软件设计real-time PCR引物(表1)。
以反转录合成的第一链cDNA为模板,2倍稀释8个浓度梯度,根据筛选优化结果,进行real-time PCR反应,建立标准曲线。用MXPro-MX3000P软件(Stratagene Co.Ltd)分析导出内参基因和目的基因标准曲线方程、扩增效率(R2)以及直线方程系数,并分析基因间的扩增效率。每个样本PCR反应重复3次。
Real-time PCR反应体系:SYBRPremixExTaqTM12.5 μL,正、反向引物(10 μmol·L-1)各1 μL,ROX 0.5 μL,cDNA模板2 μL,加灭菌超纯水至25 μL。反应程序:95 ℃预变性30 s;(95 ℃ 5 s,60 ℃ 30 s)循环40次;95 ℃ 30 s,60 ℃ 30 s,95 ℃ 30 s。

表1 引物序列、退火温度和扩增产物长度
1.5 免疫组织化学分析
将已固定好的组织用常规方法制作石蜡切片。切片厚度5 μm,二甲苯脱蜡,梯度乙醇脱水。3% H2O2室温孵育15 min,以灭活内源性过氧化物酶活性。PBS冲洗后,5% BSA封闭液室温孵育30 min。去封闭液,滴加1∶100稀释的UCP2一抗,4 ℃过夜。PBS冲洗后,滴加二抗,37 ℃孵育45 min。PBS冲片,DAB显色,苏木精轻度复染,梯度酒精脱水,二甲苯透明,中性树胶封片。用PBS替代第一抗体作阴性对照,细胞中出现棕黄色颗粒为染色阳性,根据细胞是否显色分为阳性和阴性。每个组织取5张切片,每张切片随机选取5个视野,40倍物镜下采集图像,用Image-Pro PlusTM(Olympus,日本)图像分析系统测定每个视野的光密度值。
1.6 数据分析
用2-ΔΔCT方法计算UCP2 mRNA的相对表达量,用光密度值表示UCP2蛋白阳性反应的表达量。配合一般线性模型(GLM),用SPSS 17.0软件(SPSS Science,Chicago,IL,USA)的GLM过程分析品种、季节和脂肪沉积部位对UCP2基因mRNA和蛋白表达的影响。模型:
yijkl=μ+Si+Fj+Tk+SFij+STik+
FTjk+SFTijk+eijkl
式中:yijkl表示第i个季第j个品种第k种组织的第l个表达量观察值,μ表示总体均值,Si表示第i个季节(i=1,2),Fj表示第j个品种(j= 1,2),Tk表示第k种组织(k= 1,2,…,6),SFij、STik和FTjk分别为季节、品种与组织间的二级互作,SFTijk表示其间的三级互作,eijkl表示残差效应。
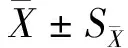
2 结 果
2.1 绵羊UCP2 cDNA全长序列
拼接3′ RACE和5′ RACE的扩增序列,获得绵羊UCP2 cDNA全长序列为1 641 bp,已提交NCBI(登录号:KC355436)。该基因包含8个外显子和7个内含子,开放阅读框长930 bp,编码309个氨基酸。其中,起始密码子为ATG368-370。5′ UTR长367 bp,包括外显子1、外显子2和部分外显子3(97 bp)。3′ UTR长347 bp,包含终止密码子TAG1295-1297和加尾信号ATAAA1610-1614。
将克隆的绵羊UCP2 基因CDS(Coding sequence,CDS)与牛(NM_001033611)、人(NM_003355 )和小鼠(NM_011671)该基因的相应序列进行比对,发现与牛的相似性最高为99%,与人和小鼠的相似性分别为91%和89%。
2.2 影响UCP2 mRNA及其蛋白表达的因素
基于GLM的方差分析,对绵羊UCP2 mRNA及其蛋白在不同季节和品种各脂肪组织中差异表达的影响因素进行了剖析,结果见表2。季节显著影响UCP2 mRNA及其蛋白的表达(P<0.001)。虽然品种对二者的表达无显著影响,但品种与季节的互作效应显著(P<0.05)。UCP2 mRNA(P<0.05)和蛋白(P<0.001)的表达也存在显著的组织间差异。季节与组织的互作显著影响UCP2 mRNA(P<0.05)及其蛋白(P<0.001)的表达。
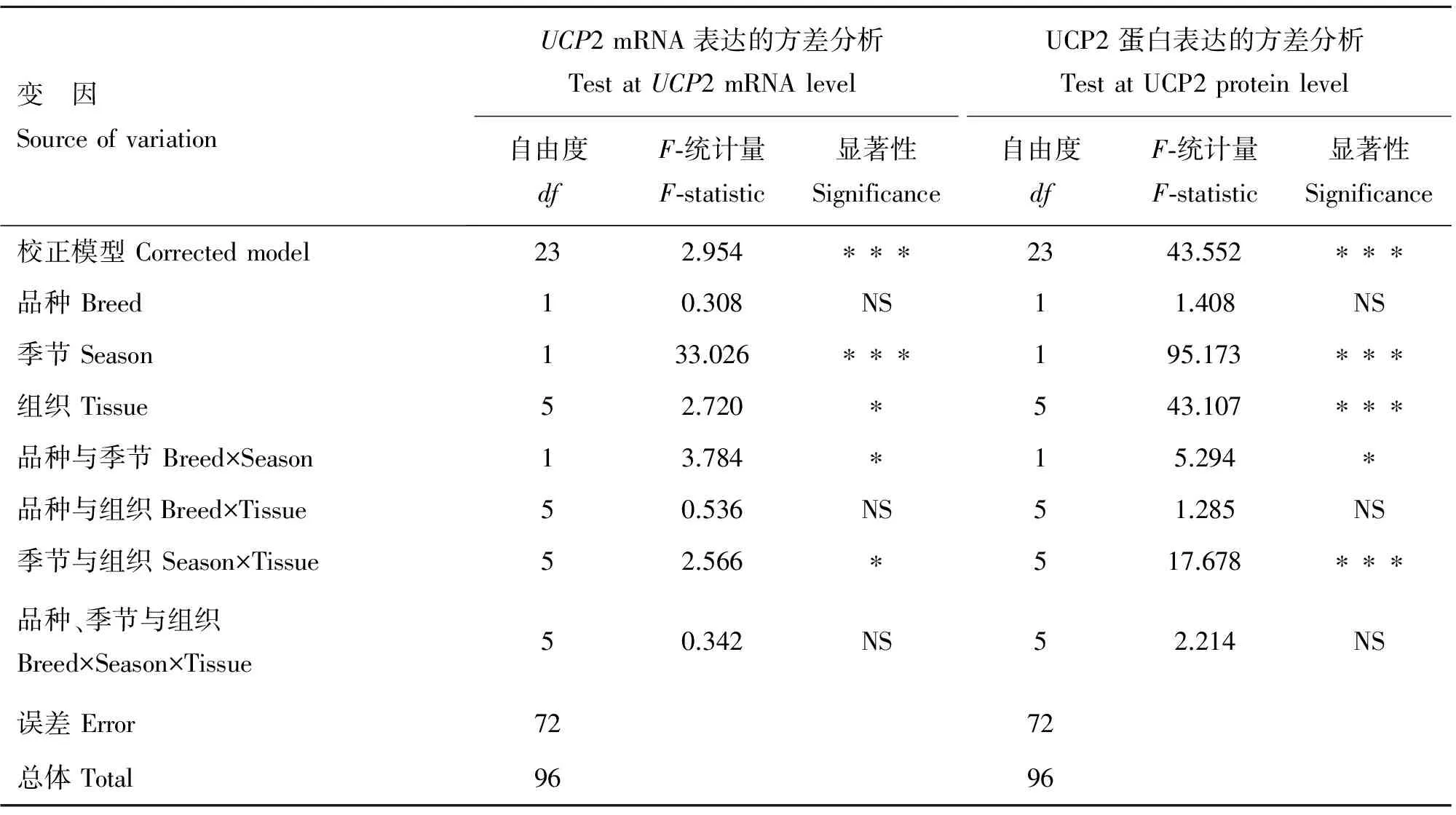
表2 绵羊UCP2 mRNA及其蛋白表达的方差分析
2.3 不同因素各水平下的UCP2 mRNA表达量
绵羊UCP2基因在不同季节和品种绵羊的各脂肪组织中mRNA表达量见表3。就季节而言,UCP2 mRNA在脂肪组织中的表达量冬春季节显著高于夏秋季节(2.884vs0.772)。就组织而言,除夏秋季节的南非肉用美利奴羊外,浅层脂肪组织中的表达量均显著低于深层脂肪(P<0.05),而深层脂肪组织中,冬春季节两品种中肾周和腹膜后脂肪组织中的表达量显著高于网膜脂肪组织(P<0.05);但夏秋季节两品种深层脂肪组织中的表达量差异不显著(P>0.05)。
显著影响UCP2 mRNA表达的品种与季节的互作效应表现在冬春季节南非肉用美利奴羊中的表达量高于山西肉用绵羊(3.139vs2.629),但在夏秋季节却低于山西肉用绵羊(0.312vs1.231)。
季节与组织间的互作效应表现在冬春季节大网膜和肠系膜脂肪中UCP2 mRNA的表达量高于小网膜;肾周脂肪中的表达量高于腹膜后脂肪。但在夏秋季节,表达趋势则正好相反。
2.4 UCP2蛋白在细胞中的分布
UCP2蛋白的免疫组化结果表明,冬春(图1)和夏秋(图2)季节,皮下、大网膜、小网膜、肠系膜、腹膜后、肾周6种脂肪组织中UCP2阳性反应着色良好。通过观察,发现其阳性反应主要表现在细胞膜上。说明UCP2蛋白位于脂肪细胞的细胞膜。
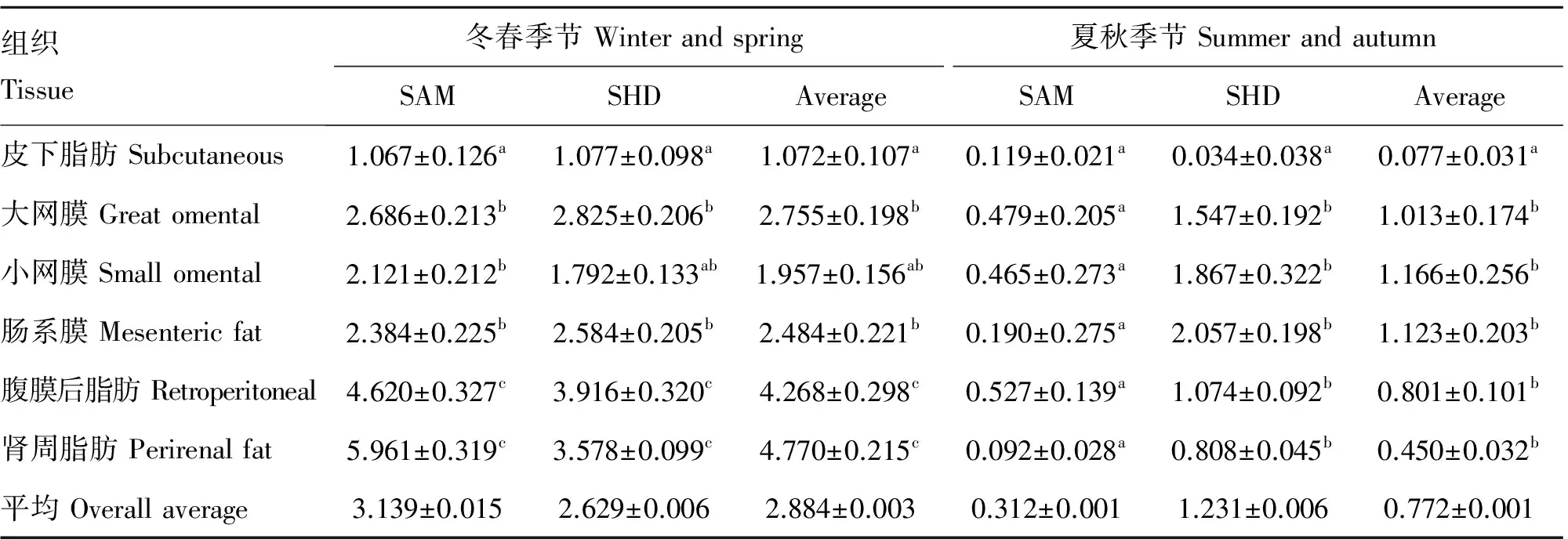
表3 不同季节绵羊UCP2基因mRNA在脂肪组织中的表达丰度
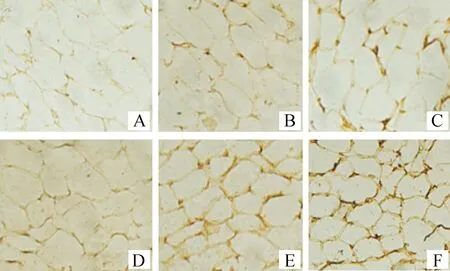
A.皮下脂肪;B.小网膜脂肪;C.大网膜脂肪;D.腹膜后脂肪;E.肠系膜脂肪;F.肾周脂肪A.Subcutaneous fat;B.Small omental fat;C.Great omental fat;D.Retroperitoneal fat;E.Mesenteric fat;F.Perirenal fat图1 UCP2在冬春季节绵羊脂肪细胞中的分布 400×Fig.1 The distribution of ovine UCP2 in adipocytes in winter and spring 400×
2.5 不同因素各水平下UCP2蛋白的表达量
绵羊UCP2蛋白在不同季节、不同品种的脂肪组织中的表达量列见表4。显著的季节影响表现为UCP2在脂肪组织中的表达量冬春季节高于夏秋季节。无论什么季节,组织间的差异主要表现在肾周和腹膜后脂肪中的表达量显著高于其他脂肪组织。其中,皮下脂肪中的表达量最低。
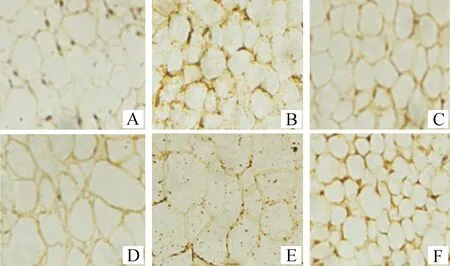
A.皮下脂肪;B.小网膜脂肪;C.大网膜脂肪;D.腹膜后脂肪;E.肠系膜脂肪;F.肾周脂肪A.Subcutaneous fat;B.Small omental fat;C.Great omental fat;D.Retroperitoneal fat;E.Mesenteric fat;F.Perirenal fat图2 UCP2在夏秋季节绵羊脂肪细胞中的分布400×Fig.2 The distribution of ovine UCP2 in adipocytes in summer and autumn 400×
品种与季节的互作对UCP2蛋白表达的显著影响与其编码 mRNA的表达相似,表现在冬春季节南非肉用美利奴羊中的表达量高于山西肉用绵羊(1.019vs0.946),但在夏秋季节却低于山西肉用绵羊(0.229vs0.458)。
3 讨 论
3.1 绵羊UCP2 cDNA序列
研究表明,人UCP2 cDNA序列长度为1 646 bp[20],牛为1 610 bp[21],小鼠为1 583 bp[22],三者CDS序列均为930 bp,编码309个氨基酸。本研究获得的绵羊UCP2 cDNA全长序列为1 641 bp,与牛、人和小鼠该基因的 cDNA序列长度相近,其CDS序列长度和编码氨基酸的数目也与这3个物种相同。经序列相似性比对,绵羊UCP2 CDS与牛、人和小鼠的相应序列相似性较高,说明UCP2基因在编码区保守性强,提示该基因的表达产物在不同物种中具有相似的功能。
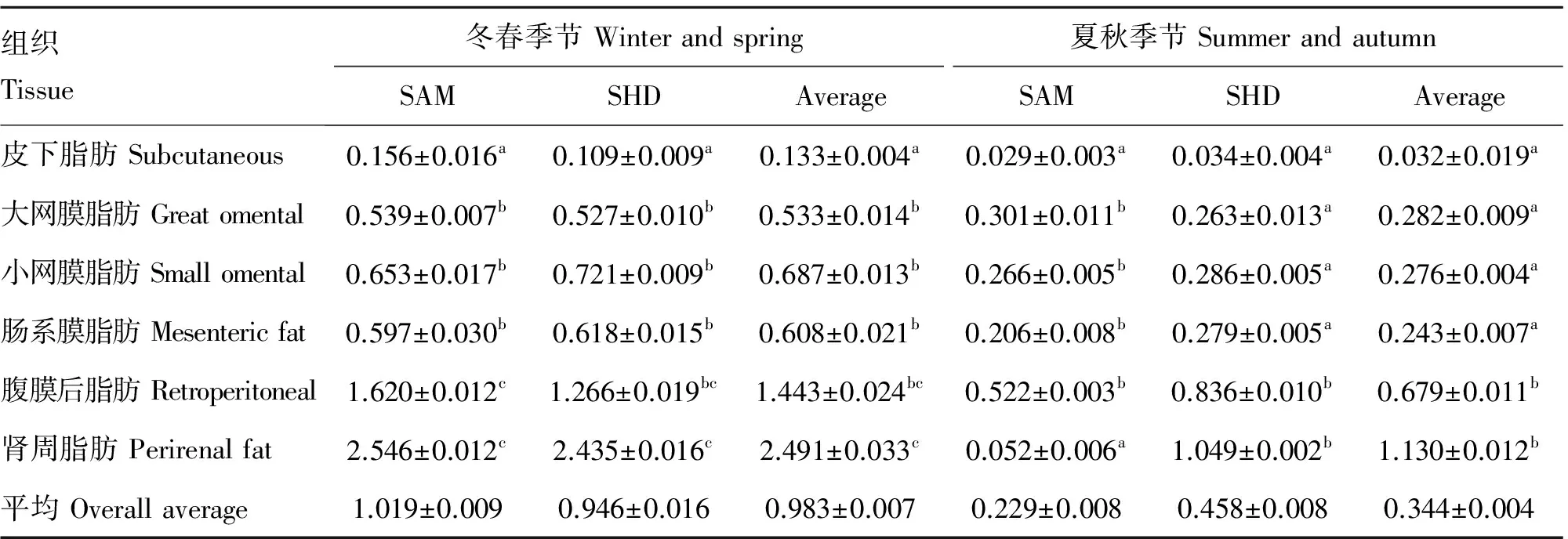
表4 不同季节绵羊UCP2蛋白在脂肪组织中的表达量
3.2 绵羊UCP2 基因在不同部位脂肪组织中的表达
UCP2广泛存在于动物机体的不同部位,且高表达于代谢活跃的组织和器官[3]。通过绝对定量,L.Aln等[23]检测了小鼠UCP2 mRNA在脾、心、肺和白色脂肪组织中的表达,结果发现,在白色脂肪组织和肺中UCP2 mRNA的含量较高。UCP2 mRNA在大鼠的肾周[24]和腹膜后[10]脂肪组织,以及人的皮下和网膜脂肪组织中都有表达[25]。本研究中,绵羊UCP2 mRNA及其编码蛋白在皮下脂肪、大网膜、小网膜、肠系膜、腹膜后脂肪以及肾周脂肪组织中都有表达,说明UCP2在脂肪代谢中具有重要作用。
同为脂肪组织,UCP2的表达也存在部位间的差异。本研究中绵羊UCP2 mRNA及其编码蛋白的表达量都是在肾周脂肪组织中最高,在皮下脂肪组织中最低。总体来说,表达量表现出深层脂肪组织高于浅层脂肪组织的趋势。相似的情形在人中也有报道。人网膜脂肪组织中UCP2 mRNA的表达量也显著高于皮下脂肪组织[25-26],其表达差异的主要原因是网膜区域的脂肪代谢,即甘油三酯的分解程度大于皮下区域[26]。因此,UCP2在深层脂肪组织中的高表达主要因满足生理需要的脂肪动员所致。
3.3 绵羊UCP2基因表达的季节差异
季节是一个复杂的环境因素,包括环境温度、光周期、营养条件等,是导致动物体重、体脂含量以及某些激素分泌改变的重要原因。本研究选取的两个时段,冬春季节日照短,环境温度低,饲草缺乏;夏秋季节与之正好相反。绵羊UCP2 mRNA及其编码蛋白的表达量均为冬春季节高于夏秋季节。相似的结果虽然在家畜中未见报道,但在其他物种中已有研究。光周期对袋鼬(Sminthopsiscrassicaudata)UCP2 mRNA在白色脂肪组织和肌肉中的表达无显著影响[27]。在金色仓鼠(M.auratus)中,光照本身对UCP2 mRNA的表达影响也不大,但短光照与寒冷的联合刺激促进了该基因的表达[28]。在人和鼠中,营养缺乏可上调UCP2 mRNA的表达[29]。可见,季节对UCP2基因表达的影响主要因寒冷和营养不足所致。
早期的研究认为,动物的生热作用主要由棕色脂肪组织中的UCP1介导,而UCP2对冷诱导下的适应性生热没有显著影响。如缺少UCP2的小鼠对冷刺激反应正常[30]。甚至有研究表明,在冷刺激作用下,缺少UCP2的小鼠比野生型小鼠具有更强的维持体温能力[31]。然而,最近的研究表明,人的非颤抖性生热由一个复杂的生理级联反应激活[32]。冷刺激、锻炼、甲状腺激素等不仅可以通过刺激过氧化物酶体增殖因子激活受体(PPARγ)共激活因子1α基因(PGC-1α)、核呼吸因子1基因(NRF-1)和线粒体转录因子A基因(mtTF-A)的表达,导致线粒体复制,使其密度增大而促进非颤抖性生热;而且还可通过交感神经系统增加β2和β3肾上腺素能受体基因(ADRB2和ADRB3)的表达,激活UCP2基因在白色脂肪组织中的表达,促进氧化磷酸化的解偶联,增加生热[32]。可见,UCP2不仅具有降低活性氧水平,保护机体组织免受伤害的作用,在一定条件下,还可以作为对UCP1生热作用的一种补充。本研究中,绵羊冬春季节的营养不足与人的锻炼(能量消耗)和动物的禁食和饥饿(能量不足)相似,加之寒冷刺激,结果导致UCP2 mRNA及其编码蛋白的表达量提高,发挥其生热作用,以维持体温和调节机体的能量平衡。
3.4 品种与季节的互作效应对绵羊UCP2基因表达的影响
品种与季节的互作效应显著影响绵羊UCP2 mRNA及其编码蛋白在脂肪组织中的表达。冬春季节南非肉用美利奴羊的表达量高于山西肉用绵羊,可以理解为南非肉用美利奴羊体型较大,且为引进品种,在寒冷和饲草料不足的环境条件下,需要通过增加UCP2 基因的表达,促进脂肪代谢,提供更多的能量来维持机体代谢平衡和抵御恶劣生存环境。本地绵羊在长期进化过程中已适应当地的环境条件。山西肉用绵羊是一个合成母本品系,UCP2基因的表达相对较低,可以认为是由于含有本地绵羊的血液所致。该研究结果在一定程度上反映了山西肉用绵羊具有更强的适应能力。夏秋季节南非肉用美利奴羊的表达量反而低于山西肉用绵羊,该结果究竟是由于样本代表性不足,或者试验数据误差造成的,还是绵羊真实生理机能的体现,尚需进一步探讨。
4 结 论
本研究获得绵羊UCP2 cDNA全长序列1 641 bp,其中开放阅读框为930 bp,编码309个氨基酸。绵羊UCP2 mRNA及其蛋白的表达具有组织和季节差异,即均为深层脂肪组织中的表达量高于浅层脂肪组织,冬春季节的表达量高于夏秋季节。UCP2基因的功能在于维持体温和调节机体的能量平衡。
[1] RICQUIER D,BOUILLAUDAUD F.Mitochondrial uncoupling roreins:from mitochondria to the regulation of energy balance[J].JPhysiol,2000,529:3-10.
[2] FLEURY C,NEVEROV A,COLLINS S,et al.Uncoupling protein 2:a novel gene linked to obesity and hyperinemia[J].NatGenet,1997,15:269-272.
[3] RICQUIER D,BOUILLAUD F.The uncoupling protein homologues:UCP1,UCP2,UCP3,StUCP and AtUCP[J].BiochemJ,2000,345:161-179.
[4] CHA M H,KIM I C,KIM K S,et al.Association of UCP2 and UCP3 gene polymorphisms with serum high-density lipoprotein cholesterol among Korean women[J].Metabolism,2007,56(6):806-813.
[5] DALGAARD L T.Genetic variance in uncoupling protein 2 in relation to obesity,type 2 diabetes,and related metabolic traits:Focus on the functional -866G>A promoter variant (rs659366)[J].JObes,2011,34(2):241-247.
[6] LI H,LI Y,ZHAO X,et al.Structure and nucleotide polymorphisms in pig uncoupling protein 2 and 3 gene[J].AnimBiotechnol,2005,16(2):209-220.
[7] SHERMAN E L,NKRUMAH J D,MURDOCH B M,et al.Polymorphisms and haplotypes in the bovine neuropeptide Y,growth hormone receptor,ghrelin,insulin-like growth factor 2,and uncoupling proteins 2 and 3 genes and their associations with measures of growth,performance,feed efficiency,and carcass merit in beef cattle[J].JAnimSci,2008,86(1):1-16.
[8] WU B,FENG Y H,LIU C B,et al.Effects of repeated fasting/refeeding on lipid metabolism and uncoupling proteins expression in rats[J].ZhongguoYingYongShengLiXueZaZhi,2013,29(4):363-367.
[9] MOON J S,LEE S,PARK M A,et al.UCP2-induced fatty acid synthase promotes NLRP3 inflammasome activation during sepsis[J].JClinInvest,2015,125(2):665-680.
[10] DE QUEIROZ K B 1,GUIMARAES J B,COIMBRA C C,et al.Endurance training increases leptin expression in the retroperitoneal adipose tissue of rats fed with a high-sugar diet[J].Lipids,2014,49(1):85-96.
[11] LI N,WANG J,GAO F,et al.The role of uncoupling protein 2 in the apoptosis induced by free fatty acid in rat cardiomyocytes[J].JCardiovascPharmacol,2010,55(2):161-167.
[12] HENRY B A,ANDREWS Z B,RAO A,et al.Central Leptin Activates Mitochondrial Function and Increases Heat Production in Skeletal Muscle[J].Endocrinology,2011,152(7):2609-2618.
[13] LUO G F,YU T Y,WEN X H,et al.Alteration of mitochondrial oxidative capacity during porcine preadipocyte differentiation and in response to leptin[J].MolCellBiochem,2008,307(1-2):83-91.
[14] AGUER C,HARPER M E.Skeletal muscle mitochondrial energetics in obesity and type 2 diabetes mellitus:Endocrine aspects[J].BestPractResClinEndocrinolMeta,2012,26 (6):805-819.
[15] TATA J R.The road to nuclear receptors of thyroid hormone[J].BiochimBiophysActa,2013,1830(7):3860-3866.
[16] RAMSAY T G,ROSEBROUGH R W.Regulation of uncoupling proteins 2 and 3 in porcine adipose tissue[J].DomestAnimEndocrinol,2005,28(4):351-366.
[17] 袁亚男,刘文忠,刘建华,等.绵羊UCP1基因碱基突变与其蛋白结构和功能[J].中国农业科学,2012,45(14):2973-2980. YUAN Y N,LIU W Z,LIU J H,et al.The base mutation of ovine UCP1 gene and its relationship with protein structure and function[J].ScientiaAgriculturaSinica,2012,45(14):2973-2980.(in Chinese)
[18] 周沙沙,刘宝凤,魏琳琳,等.绵羊UCP4基因编码序列的克隆和mRNA表达研究[J].中国农业科学,2013,46(10):2110-2118 . ZHOU S S,LIU B F,WEI L L,et al.Study on the cloning of coding sequence and ontogenetic mRNA expression of ovine UCP4 gene[J].ScientiaAgriculturaSinica,2013,46 (10):2110-2118.(in Chinese)
[19] 周沙沙.绵羊UCP4和UCP5基因的克隆、表达、多态性及其与性状的关联研究[D].太谷:山西农业大学,2013. ZHOU S S.Study on the cloning,expression and polymorphism of UCP4 and UCP5 gene and their associations with traits in sheep[D].Taigu:ShanxiAgriculturalUniversity,2013.(in Chinese)
[20] KOLATH W H,KERLEY M S,GOLDEN J W,et al.The relationships among mitochondrial uncoupling protein 2 and 3 expression,mitochondrial deoxyribonucleic acid single nucleotide polymorphisms,and residual feed intake in Angus steers[J].JAnimSci,2006,84 (7):1761-1766.
[21] CAO T,DONG Y,TANG R,et al.Mitochondrial uncoupling protein 2 protects splenocytes from oxidative stress-induced apoptosis during pathogen activation[J].CellImmunol,2013,286(1-2):39-44.
[22] ESTEVES P,PECQUEUR C,RANSY C,et al.Mitochondrial retrograde signaling mediated by UCP2 inhibits cancer cell proliferation and tumorigenesis[J].CancerRes,2014,74(14):3971-3982.
[23] ALAN L,SMOLKOVA K,KRONUSOVA E,et al.Absolute levels of transcripts for mitochondrial uncoupling proteins UCP2,UCP3,UCP4,and UCP5 show different patterns in rat and mice tissues[J].JBioenergBiomembr,2009,41(1):71-78.
[24] YANG L,LU K,WEN X Y,et al.Jueming Prescription reduces body weight by increasing the mRNA expressions of beta3-adrenergic receptor and uncoupling protein-2 in adipose tissue of diet-induced obese rats[J].ChinJIntegrMed,2012,18(10):775-781.
[25] MAHADIK S R,LELE R D,SARANATH D,et al.Uncoupling protein-2 (UCP2) gene expression in subcutaneous and omental adipose tissue of Asian Indians:Relationship to adiponectin and parameters of metabolic syndrome[J].Adipocyte,2012,1(2):101-107.[26] OBERKOFLER H,LIU Y M,ESTERBAUER H,et al.Uncoupling protein-2 gene:reduced mRNA expression in intraperitoneal adipose tissue of obese humans[J].Diabetologia,1998,41(8):940-946.
[27] HOPE P J,TURNBULL H,BREED W,et al.The effect of ovarian steroids and photoperiod on body fat stores and uncoupling protein 2 in the marsupial Sminthopsis crassicaudata[J].PhysiolBehav,2000,69(4-5):463-470.
[28] SABIR S,CHAU S,HAMILTON J,et al.Seasonal cues & hibernation alter expression of uncoupling proteins in the golden hamster[J].FASEBJ,2006,20 (MeetingAbstractSupplement):A828.
[29] ALLISTER E M,ROBSON-DOUCETTE C A,PRENTICE K J,et al.UCP2 regulates the glucagon response to fasting and starvation[J].Diabetes,2013,62(5):1623-1633.
[30] ARSENIJEVIC D,ONUMA H,PECQUEUR C,et al.Disruption of the uncoupling protein-2 gene in mice reveals a role in immunity and reactive oxygen species production[J].NatGenet,2000,26(4):435-439.
[31] ABDELHAMID R E,KOVACS K J,NUNEZ M G,et al.After a cold conditioning swim,UCP2-deficient mice are more able to defend against the cold than wild type mice[J].PhysiolBehav,2014,135:168-173.[32] NISHIMURA T,WATANUKI S.Relationship between mitochondrial haplogroup and seasonal changes of physiological responses to cold[J].JPhysiolAnthropol,2014,33:27.
(编辑 郭云雁)
Cloning of OvineUCP2 Gene and Its Seasonally Differential Expression in Adipose Tissues
LIU Jian-hua,QIAO Li-ying,GUO Yun-yan,JIA Xia-li,LIU Wen-zhong*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
This study focused on the cloning of ovineUCP2 gene and its seasonal expression differences in adipose tissues.The results would reveal the effects of seasonal regulation on theUCP2 expression.The full-length cDNA was cloned by RACE method.Real-time PCR and immunohistochemistry techniques were used to study the expressions ofUCP2 mRNA and its coding protein in 6 adipose tissues of South African Mutton Merino and Shanxi Mutton Sheep Dam Line during two season periods.The results showed that the ovineUCP2 cDNA was 1 641 bp in length with a 930 bp open reading frame.It contained 8 exons which encoded 309 amino acids.The mRNA expressed in all 6 adipose tissues detected in this study.Higher expression in deep than in superficial depots (P<0.05) was found as suggested by the highest expression in perirenal and lowest in subcutaneous fat.UCP2 expressed in similar trend at mRNA and protein levels,and distributed on the membrane of adipocytes.Both mRNA and protein expressions were higher in winter-spring period than that in summer-autumn period (P<0.05).These results indicate that UCP2 differentially expression in adipose tissues is related to seasonal changes and functions in maintaining body temperature and regulating energy balance.
sheep;UCP2 gene;gene expression;adipose tissues;seasonality
10.11843/j.issn.0366-6964.2015.07.006
2015-02-16
山西农业大学拔尖创新人才支持计划项目(BJRC201203);山西省科技攻关项目(011029;20120312010-2)
刘建华(1972-),女,山西原平人,博士,副教授,主要从事分子数量遗传与动物育种研究,E-mail:ljhbeth@163.com
*通信作者:刘文忠,博士,教授,E-mail:tglwzyc@163.com
S826.2
A
0366-6964(2015)07-1114-08

