麦冬多糖脂质体增强雏鸡免疫功能的分析
范云鹏,马 琳,张为民,宋晓平,郭 超,侯伟峰,童德文
(西北农林科技大学 动物医学院,杨凌 712100)
麦冬多糖脂质体增强雏鸡免疫功能的分析
范云鹏,马 琳,张为民,宋晓平*,郭 超,侯伟峰,童德文*
(西北农林科技大学 动物医学院,杨凌 712100)
为探讨麦冬多糖脂质体(OPL)的增强免疫活性,进行以下试验。体外试验,采用MTT法测定OPL对雏鸡脾中T、B淋巴细胞增殖的影响,并以麦冬多糖(OP)作为对照;体内试验,400只11日龄雏鸡随机均分为8组,先用环磷酰胺进行免疫抑制造模,14日龄时用新城疫疫苗进行免疫,在免疫的同时注射不同剂量的OPL,然后测定免疫后不同时间点OPL对外周血淋巴细胞增殖、抗体效价和细胞因子含量的影响。结果显示,在体外,OPL在7.813~125 μg·mL-1时无论是单独作用还是协同PHA、LPS作用均能显著促进鸡脾淋巴细胞的增殖,且效果显著优于OP(P<0.05);在体内,OPL高、中剂量能够显著促进淋巴细胞增殖,增强抗体效价,提高细胞因子IL-2和IFN-γ的含量,且效果显著优于OP(P<0.05)。结果表明,OPL能够显著提高OP的增强免疫活性,有望开发成新型的麦冬多糖制剂。
麦冬多糖脂质体;免疫功能;淋巴细胞增殖;免疫抑制
麦冬作为传统中药,始载于《神农本草经》,其味甘、微苦,性微寒,入心、肺、胃经,具有养阴生津、清心润肺的功效,主治肺热燥咳、热病伤阴、肠燥便秘等病症。现代药理研究表明,麦冬中的主要活性成分麦冬多糖具有较强的免疫促进作用,能够增强巨噬细胞的吞噬能力,促进机体的体液免疫和细胞免疫,从而发挥良好的免疫增强活性[1-2]。但由于其高度亲水性和约2 nm的分子尺寸,使得麦冬多糖口服或注射给药后在体内的消除期很短,快速以原型经肾排泄,在相应的靶组织分布较少,且在体内不稳定。这些不理想的药动学性质限制了它的临床应用[3]。因此研究新型的麦冬多糖制剂或是选择一种高效的载体以改善麦冬多糖的相关性质,使其更好地在体内进行代谢,发挥药效作用就显得特别重要。
脂质体,作为现代药物载体研究的内容之一,是由类脂质制备的具有复层或单层单位膜结构的小囊,其结构类似生物膜,易被摄取,由于具有增强疗效、提高稳定性、延长药效、降低毒性和靶向性等优点而日益受到重视[4-5]。目前,中药脂质体的研究已经成为中药领域的一大热点。作者所在课题组前期研究证明,将甘草次酸、蜂胶黄酮等中药有效成分制成脂质体后在体内外能够显著提高其免疫增强活性,并延长药效[6-7]。因此,我们推测将麦冬多糖制成脂质体后也能够提高其免疫增强作用,并改善在体内代谢过快等缺点。
本研究拟在前期工作基础上,以麦冬多糖脂质体为研究对象,以增强机体的免疫功能为目标,体外试验,测定麦冬多糖脂质体对鸡脾中T、B淋巴细胞增殖的影响;体内试验,测定麦冬多糖脂质体对免疫抑制雏鸡外周血淋巴细胞增殖、抗体效价和细胞因子含量的影响。本研究旨在探讨麦冬多糖脂质体的增强免疫活性,并为进一步研制和应用效果明确的新型中药免疫增强剂提供参考依据。
1 材料与方法
1.1 药物准备
1.1.1 麦冬多糖(OP)的制备 称取麦冬1 000 g,加2 000 mL 95%乙醇,80 ℃水浴回流2次,药渣晾干后加9倍量水煎煮3次,合并滤液至1 000 mL,缓慢加入95%乙醇至含醇量达80%,搅匀,静置24 h,取沉淀,用三氯乙酸法去除蛋白质,DEAE纤维素柱层析分离纯化后,冷冻干燥,得麦冬多糖,经苯酚-硫酸法测定,其多糖净含量为98.8%。
1.1.2 麦冬多糖脂质体(OPL)的制备 根据前期试验响应面法优化结果,采用逆向蒸发法制备[8]。具体操作:称取大豆磷脂190 mg和胆固醇23.75 mg,加入三氯甲烷15 mL,使其溶解;将含麦冬多糖20 mg的磷酸盐缓冲溶液(PBS,pH=7.4)5 mL缓慢注入到三氯甲烷中,后置于冰水浴超声,至形成稳定的W/O型乳剂;然后将乳剂置于旋转蒸发仪上,50 ℃减压蒸发除去三氯甲烷,使其在瓶壁上形成一层均匀的胶质,后加入PBS 20 mL,继续旋转洗脱至胶质完全溶解,经水浴超声20 min,形成均匀的麦冬多糖脂质体;最后将其依次通过孔径为0.45 和0.22 μm的微孔滤膜,重复操作两次,最终制得麦冬多糖脂质体。
临用前OPL用生理盐水稀释为4.0、2.0、1.0 mg·mL-1三个质量浓度,OP稀释为4.0 mg·mL-1,用于体内试验;用不含小牛血清的RPMI1640培养液将OPL和OP均稀释成5种质量浓度:125、62.5、31.25、15.625和7.813 μg·mL-1,以0.22 μm微孔滤膜过滤,4 ℃保存,用于体外试验。
1.2 主要试剂
大豆卵磷脂,购于上海太伟药业有限公司;胆固醇,购于天津市博迪化学有限公司;RPMI1640培养液(Gibco公司),按说明书用三蒸水配制,0.22 μm的微孔滤膜过滤除菌并分装,于4 ℃保存备用。临用前加入青链霉素(终浓度为100 IU·mL-1),10%的小牛血清,用5.6% NaHCO3调pH至7.4。四甲基偶氮唑蓝(MTT,Amresco公司)溶液,用pH 7.4的PBS配制成5 mg·mL-1的溶液,0.22 μm微孔滤膜过滤,分装,4 ℃避光保存;二甲亚砜(DMSO),天津科密欧化学试剂公司;植物血凝素(PHA,Sigma公司),用无小牛血清RPMI1640培养液配制成100 μg·mL-1,0.22 μm的微孔滤膜过滤除菌,-20 ℃保存;脂多糖(LPS,Sigma公司),用无小牛血清RPMI1640培养液配制成50 μg·mL-1,0.22 μm的微孔滤膜过滤除菌,-20 ℃保存。淋巴细胞分离液,购自上海浩洋生物有限公司;其他化学试剂均为国产分析纯。
1.3 主要仪器
RE-52A型旋转蒸发仪,上海亚荣生化仪器厂;SHB-B95A型循环水真空泵,郑州科工贸有限公司;KQ-500DE型超声波清洗器,昆山超声仪器有限公司;PT-3502G型酶标仪,北京普天新桥技术有限公司;CO2培养箱,美国Thermo公司,ICX-40型倒置显微镜,浙江舜宇光学科技有限公司;96孔细胞培养板和24孔细胞培养板,德国Nunclon公司生产;ELISA试剂盒,上海继锦科技有限公司。
1.4 麦冬多糖脂质体对体外脾淋巴细胞增殖的影响
取40日龄罗曼蛋公鸡颈静脉放血处死,浸入75%的乙醇中消毒5 min。打开腹腔,取出脾,用灭菌PBS冲洗3次,移入200目细胞筛网,研磨脾,边研边加Hank's液,收集细胞液,缓慢均匀地加在淋巴细胞分离液上层。以2 000 r·min-1离心20 min,吸取中间云雾状白细胞层,用Hank's液洗涤2次。用RPMI1640完全培养基调节细胞密度至2.5×106个·mL-1;将细胞悬液加到96孔细胞板中,100 μL·孔-1。每孔加入各浓度的OPL、OP和空白脂质体(BL)80 μL,每个药物浓度重复4孔。另取培养板,在加入药物的同时,分别加入20 μL PHA或LPS以刺激T、B淋巴细胞增殖(终浓度分别为20、10 μg·mL-1),另设PHA、LPS和细胞对照组(CC)。然后置于37.5 ℃、5% CO2条件下培养44 h,取出每孔加入MTT 30 μL,继续培养4 h后,将每孔中的上清弃去,加入100 μL DMSO,在微量振荡器上振荡5 min左右使沉淀完全溶解。用酶联免疫仪检测570 nm波长处的吸光值(A570 nm),作为淋巴细胞增殖的指标[9]。
1.5 麦冬多糖脂质体对免疫抑制鸡免疫功能的影响
11日龄健康雏鸡400只,随机均分为8组,每组50只。分别为OPL的高(4.0 mg·mL-1)、中(2.0 mg·mL-1)、低剂量组(1.0 mg·mL-1)、OP组(4.0 mg·mL-1)、空白脂质体组(BL)、环磷酰胺模型对照组(MC)、疫苗对照组(VC)和空白对照组(BC)。除VC和BC组外,其余各组雏鸡均每羽肌肉注射8 mg·mL-1的环磷酰胺溶液0.5 mL,每天1次,连续3 d;14日龄时,除空白对照组外均用新城疫Ⅳ系疫苗免疫,28日龄二免。在首次免疫的同时,1~5组分别肌肉注射相应药物,1.0 mL·只-1,MC、VC和BC组注射等量生理盐水,每天1次,连续3 d。分别于首免后第7(D7)、14(D14)、21(D21)和28(D28)天,每组随机抽取6羽心脏采血,用MTT法测定外周血T淋巴细胞增殖;每组再随机抽取6只,翅静脉采血,分离血清,用β-微量法检测抗体效价,ELISA法测定细胞因子IFN-γ和IL-2的含量变化。
1.6 数据分析

2 结 果
2.1 体外试验结果2.1.1 OPL及OP单独作用时对脾淋巴细胞增殖的影响 结果见图1。在 7.813~125 μg·mL-1,OPL和OP组的A570 nm值显著高于BL和CC组(P<0.05),且在5个质量浓度范围内,OPL组的A570 nm值均为最高,并显著高于OP组(P<0.05)。结果表明,在单独作用时,OPL和OP均能促进淋巴细胞增殖,且OPL的效果显著优于OP。
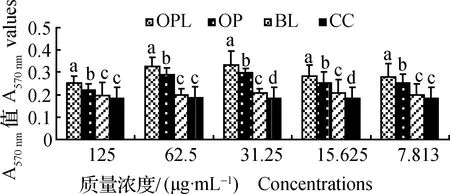
柱形图中标注不同字母者差异显著(P<0.05)。以下图同Bars in the figure with different superscripts differ significantly (P<0.05).The followings are the same图1 药物单独刺激时对脾淋巴细胞增殖的影响(A570 nm值)Fig.1 Effects of splenic lymphocyte proliferation in single stimulation of drugs (A570 nm values)
2.1.2 OPL及OP协同PHA刺激时对脾淋巴细胞增殖的影响 在 125~7.813 μg·mL-1,PHA组的A570 nm值显著高于CC组(P<0.05),表明PHA能够显著促进淋巴细胞增殖。在5个质量浓度范围内,OPL组的A570 nm值均为最高,并显著高于其它4个组(P<0.05)。在125、62.5、31.25和7.813 μg·mL-1时,OP组的A570 nm值显著高于PHA和CC组(P<0.05)。结果表明,在协同PHA作用时,OPL和OP均能促进淋巴细胞增殖,且OPL的效果显著优于OP(图2)。
2.1.3 OPL及OP协同LPS刺激时对脾淋巴细胞增殖的影响 在7.813~125 μg·mL-1,LPS组的A570 nm值显著高于CC组(P<0.05),表明LPS能够显著促进淋巴细胞增殖。在5个质量浓度范围内,OPL组的A570 nm值均为最高,并显著高于OP、BL、LPS和CC组(P<0.05)。在125、62.5、31.25和15.625 μg·mL-1时,OP组的A570 nm值显著高于LPS和CC组(P<0.05)。结果表明,在协同LPS作用时,OPL和OP均能促进淋巴细胞增殖,且OPL的效果显著优于OP(图3)。
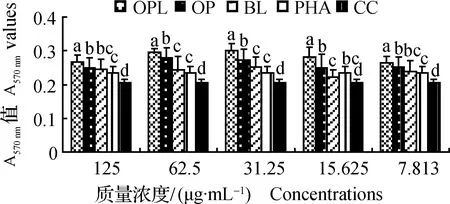
图2 药物协同PHA刺激时对脾淋巴细胞增殖的影响(A570 nm值)Fig.2 Effects of splenic lymphocyte proliferation in synergistical stimulation of drugs with PHA (A570 nm values)

图3 药物协同LPS刺激时对脾淋巴细胞增殖的影响(A570 nm值)Fig.3 Effects of splenic lymphocyte proliferation in synergistical stimulation of drugs with LPS (A570 nm values)
2.2 体内试验结果
2.2.1 麦冬多糖脂质体对外周血淋巴细胞增殖的影响 在首次免疫后的所有时间点,MC组的A570 nm值均显著低于VC组(P<0.05),表明造模成功。首免后第7—28天,OPLH、OPLM和OP组的A570 nm值显著高于MC组,且OPLL组的A570 nm值在首免后第14—28天也高于MC组(P<0.05)。首免后第14—28天,OPLH组的A570 nm值均显著高于OP组(P<0.05)。首免后第21和28天,OPLM组的A570 nm值也显著高于OP组(P<0.05)(图4)。结果表明,OPL的高、中剂量能够促进机体的淋巴细胞增殖,促进机体的免疫功能恢复,且效果显著优于OP。

H.高剂量组;M.中剂量组;L.低剂量组。下同H.High dose group;M.Medium dose group;L.Low dose group.The followings are the same图4 各组淋巴细胞增殖的动态变化(A570 nm值)Fig.4 The changes of lymphocyte proliferation in every group (A570 nm values)
2.2.2 麦冬多糖脂质体对抗体效价的影响 在首次免疫后的所有时间点,MC组的抗体效价均显著低于VC组(P<0.05),表明造模成功。首免后第7—28天,OPLH、OPLM、OPLL和OP组的抗体效价显著高于MC组(P<0.05)。首免后第14—28天,OPLH和OPLM组的抗体效价均高于OP组,且在第21和28天时,OPLH与OP差异显著,在第28天时,OPLM与OP差异显著(P<0.05)(图5)。结果表明,OPL的高、中剂量能够提高机体的抗体效价,促进机体的免疫功能恢复,且效果显著优于OP。

图5 各组抗体效价的动态变化Fig.5 The changes of antibody titers in every group
2.2.3 麦冬多糖脂质体对IL-2含量的影响 首免后第7—28天,OPLH、OPLM、OPLL和OP组的IL-2含量均显著高于MC组(P<0.05)。首免后第14~28天,OPLH和OPLM组的IL-2含量高于OP组,且在第28天时,OPLH与OP差异显著,在第21和28天时,OPLM与OP差异显著(P<0.05)(图6)。结果表明,OPL的高、中剂量能够促进机体IL-2的生成,且效果显著优于OP。

图6 各组IL-2含量的动态变化Fig.6 The changes of IL-2 in every group

图7 各组IFN-γ含量的动态变化Fig.7 The changes of IFN-γ in every group
2.2.4 麦冬多糖脂质体对IFN-γ含量的影响 首免后第7—28天,OPLH、OPLM和OP组的IFN-γ含量均显著高于MC组(P<0.05)。首免后第14—28天,OPLM组的IFN-γ含量显著高于OP组(P<0.05),OPLH组的IFN-γ含量也高于OP组,且在第14和21天时,差异显著(P<0.05)(图7)。结果表明,OPL的高、中剂量能够促进机体IFN-γ的生成,且效果显著优于OP。
3 讨 论
环磷酰胺属于烷化剂类药物,是医学上常用的抗癌药,也是一种免疫抑制剂,具有细胞毒性,它的作用机制与病毒的免疫抑制相似。主要表现为对活化增殖细胞的毒性,通过肝酶P450水解成醛磷酰胺,与DNA双链交叉连接破坏DNA,杀死有丝分裂期和进入循环周期的细胞,破坏和干扰母细胞的增殖和分化,非特异性地杀伤抗原敏感性小淋巴细胞,限制其转化为免疫母细胞,还能够抑制体液免疫和细胞免疫应答作用[10-12]。因此,在试验中,经常使用环磷酰胺对动物进行免疫抑制或免疫缺陷造模。在当前的研究中,试验结果显示,环磷酰胺能够显著降低模型组雏鸡的淋巴细胞增殖、抗体效价、IFN-γ和 IL-2的含量,表明造模成功,可以用来评价OPL的免疫增强活性。
T、B淋巴细胞是机体中参与免疫应答的重要细胞类群,T细胞具有介导细胞免疫及调节免疫的双重功能,B细胞主要参与体液免疫。淋巴细胞增殖是反映机体细胞免疫最直接的指标[13]。淋巴细胞在受到抗原刺激后能分裂增殖,发生特异性免疫应答、产生抗体或分泌细胞因子。A570 nm值与淋巴细胞增殖状态呈正相关,A570 nm越大,细胞增殖越强[14]。本试验中使用的PHA、LPS在体外可以分别刺激T、B淋巴细胞的增殖。本研究体外试验结果显示,OPL无论是单独作用,还是协同PHA或LPS刺激时,均能够显著促进脾中T、B淋巴细胞的增殖,且效果优于OP。但是中药对机体免疫功能的作用,有的可能是直接作用于免疫系统,有的却可能是通过作用其他系统间接影响免疫功能。因此,为了进一步验证体外作用与体内作用是否一致,而进行了体内试验。体内试验结果显示,在首免后第7—28天,OPL的高、中剂量能够显著促进淋巴细胞增殖,加快雏鸡免疫功能的恢复,且在大多数时间点,OPL的高、中剂量的效果显著优于OP。体内外试验结果表明,OP被脂质体包封后,其促进淋巴细胞增殖的能力得到了显著地增强。黄叶娥等研究也已证明中药成分被制成脂质体后,在体内外同样能够显著提高T、B淋巴细胞的增殖能力[15-16]。
机体免疫包括体液免疫和细胞免疫。体液免疫是机体防御传染病的主要因素之一,体液免疫是B淋巴细胞介导的机体一种重要的特异性免疫反应,是抗御传染病的主要因素之一。而抗体是介导体液免疫的重要分子[17-18]。抗体效价的高低直接反映机体的体液免疫状态,在疾病中起着关键的作用[19]。因此,本试验通过对各组雏鸡血清中抗体效价的测定,来反映不同剂量的OPL对免疫抑制雏鸡体液免疫功能的影响。结果显示,在首免后第7—28天,OPL三个剂量组的抗体效价均显著高于模型对照组,且在大多数时间点,OPL高、中剂量的抗体效价显著高于OP。表明,OPL制成脂质体后,能够产生缓释效果,且能够使OP保持较高的血药浓度,能够对机体的体液免疫系统进行持续的刺激,从而使机体的抗体效价维持在较高的水平。我们前期研究也已证明将黄芪多糖被制成脂质体后,在体内同样能够显著提高小鼠和雏鸡的特异性抗体水平[20-21]。
IL-2是机体内重要的淋巴因子,主要由T淋巴细胞分泌,它与靶细胞膜的IL-2受体结合是其增殖条件。IL-2能激活多种免疫细胞,诱导T淋巴细胞、自然杀伤细胞等的增殖、分化和抗体分泌,同时可诱生分泌多种细胞因子等免疫活性物质,尤其可促进IFN-γ的生成[22]。IFN-γ是一种同源二聚体糖蛋白,具有重要的免疫调节活性,在一定条件下可促进T、B淋巴细胞的功能,同时又可作为效应因子激活细胞表面的IL-2受体,使IL-2发挥活性[23]。基于IL-2和IFN-γ具有如此广泛而重要的免疫调节作用,所以本试验选择其作为探究OPL增强机体免疫功能机制的一个指标。试验结果显示,在首免后的大多数时间点,OPL组的IL-2和IFN-γ含量均显著高于OP组,由此可见,OPL可以促进机体的IL-2和IFN-γ的分泌,且效果显著高于PF。
4 结 论
麦冬多糖脂质体能够显著提高麦冬多糖的免疫增强活性,主要包括:在体外能够单独或协同PHA和LPS,促进脾淋巴细胞的增殖;在体内,能够促进免疫抑制雏鸡外周血T淋巴细胞增殖、提高抗体效价、促进细胞因子IL-2和IFN-γ的分泌。因此,将麦冬多糖制成脂质体后,能够增强其免疫活性和药效,麦冬多糖脂质体可以作为一种新型的麦冬多糖制剂。
[1] XIONG S L,LI A L,HUANG N,et al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicus[J].CarbohydPolym,2011,86(3):1273-1280.
[2] WANG X M,SUN R G,ZHANG J,et al.Structure and antioxidant activity of polysaccharide POJ-U1a extracted by ultrasound from Ophiopogon japonicus[J].Fitoterapia,2012,83(8):1576-1584.
[3] LIN X,WANG S,JIANG Y,et al.Poly (ethylene glycol)-radix Ophiopogonis polysaccharide conjugates:preparation,characterization,pharmacokinetics andinvitrobioactivity[J].EurJPharmBiopharm,2010,76(2):230-237.
[4] PATIL Y P,JADHAV S.Novel methods for liposome preparation[J].ChemPhysLipids,2014,177:8-18.
[5] YU Y,LU Y,BO R N,et al.The preparation of gypenosides liposomes and its effects on the peritoneal macrophages functioninvitro[J].IntJPharm,2014,460(1-2):248-254.
[6] ZHAO X J,FAN Y P,WANG D Y,et al.Immunological adjuvant efficacy of glycyrrhetinic acid liposome against Newcastle disease vaccine[J].Vaccine,2011,29(52):9611-9617.
[7] YUAN J,LIU J G,HU Y L,et al.The immunological activity of propolis flavonoids liposome on the immune response against ND vaccine[J].IntJBiolMacromol,2012,51(4):400-405.
[8] FAN Y,SONG X,GAO Y,et al.Preparation and optimization of ophiopogon polysaccharide liposome and its activity on Kupffer cells[J].IntJPharm,2014,477(1-2):421-430.
[9] THEKISOE M M,MBATI P A,BISSCHOP S P.Different approaches to the vaccination of free ranging village chickens against Newcastle disease in Qwa-Qwa,South Africa[J].VetMicrobiol,2004,101(1):23-30.
[10] EL-ABASY M,MOTOBU M,NAKAMURA K,et al.Preventive and therapeutic effects of sugar cane extract on cyclophosphamide-induced immunosuppression in chickens[J].IntImmunopharmacol,2004,4(8):983-990.
[11] CRUZ-CHAMORRO L,PUERTOLLANO M A,PUERTOLLANO E,et al.Examination of host immune resistance againstListeriamonocytogenesinfection in cyclophosphamide-treated mice after dietary lipid administration[J].ClinNutr,2007,26(5):631-639.
[12] ATSAMO A D,NGUELEFACK T B,DATTÉ J Y,et al.Acute and subchronic oral toxicity assessment of the aqueous extract from the stem bark of Erythrina senegalensis DC (Fabaceae) in rodents[J].JEthnopharmacol,2011,134(3):697-702.
[13] MINATO K,KAWAKAMI S,NOMURA K,et al.An exo β-1,3-glucanase synthesized de novo degrades lentinan during storage of Lentinule edodes and diminishes immunomodulating activity of the mushroom[J].CarbohydPolym,2004,56(3):279-286.
[14] HUANG X Y,HU Y L,ZHAO X N,et al.Sulfated modification can enhance the adjuvant activity of astragalus polysaccharide for ND vaccine[J].Carbohydpolym,2008,73(2):303-308.
[15] HUANG Y,WU C,LIU Z,et al.Optimization on preparation conditions of Rehmannia glutinosa polysaccharide liposome and its immunological activity[J].CarbohydrPolym,2014,104:118-126.
[16] YU Y,WANG D Q,ABULA S,et al.The immunological adjuvant activity of gypenosides liposome against Newcastle disease vaccine[J].IntJBiolMacromol,2013,60:116-121.
[17] PARRA F,PRIETO M.Purification and characterization of a calicivirus as the causative agent of a lethal hemorrhagic disease in rabbits[J].JVirol,1990,64(8):4013-4015.
[18] 邱 妍,胡元亮,崔保安,等.怀牛膝多糖对雏鸡疫苗免疫效果的影响[J].畜牧兽医学报,2007,38(7):723-727. QIU Y,HU Y L,CUI B A,et al.Effects of achyranthes bidentata polysaccharide on immune efficacy of vaccine in chickens[J].ActaVeterinariaetZootechnicaSinica,2007,38(7):723-727.(in Chinese)
[19] UNG C Y,LI H,KONG C Y,et al.Usefulness of traditionally defined herbal properties for distinguishing prescriptions of traditional Chinese medicine from non-prescription recipes[J].JEthnopharmacol,2007,109(1):21-28.
[20] FAN Y P,HU Y L,WANG D Y,et al.Effects of astragalus polysaccharide liposome on lymphocyte proliferationinvitroand adjuvanticityinvivo[J].CarbohydPolym,2012,88(1):68-74.
[21] FAN Y P,MA L,ZHANG W M,et al.Liposome can improve the adjuvanticity of astragalus polysaccharide on the immune response against ovalbumin[J].IntJBiolMacromol,2013,60:206-212.
[22] NHIEM N X,KIEM P V,MINH C V,et al.Structure-activity relationship of lupane-triterpene glycosides fromAcanthopanaxkoreanumon spleen lymphocyte IL-2 and IFN-γ[J].BioorgMedChemLett,2010,20 (16):4927-4931.
[23] LETSCH A,SCHEIBENBOGEN C.Quantification and characterization of specific T-cells by antigen-specific cytokine production using ELISPOT assay or intracellular cytokine staining[J].Methods,2003,31(2):143-149.
(编辑 白永平)
Analysis of Ophiopogon Polysaccharide Liposome on Enhancing the Immune Function in Chickens
FAN Yun-peng,MA Lin,ZHANG Wei-min,SONG Xiao-ping*,GUO Chao,HOU Wei-feng,TONG De-wen*
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling712100,China)
In order to investigate the immune-enhancing activity of ophiopogon polysaccharide liposome (OPL),two experiments were carried out.Invitro,the effects of OPL on splenocyte proliferation of chicken were determined by MTT method,and ophiopogon polysaccharide (OP) was used as control.Invivo,four hundred 11-day-old chickens were randomly assigned into 8 groups,and the chickens were injected with cyclophosphamide to build the immunosuppression model.At 14-day-old,the chickens were vaccinated with Newcastle disease vaccine.At the same time of the first vaccination,the chickens were injected respectively with OPL at different dosages.At various time points after the first vaccination,the peripheral lymphocyte proliferation,serum antibody titer and the contents of cytokines were measured.The results showed that OPL could significantly promote splenocyte proliferation singly or synergistically with PHA and LPS at 7.813-125 μg·mL-1invitro,and the efficacy was superior to OP (P<0.05);Invivo,OPL at high and medium doses could significantly promote lymphocyte proliferation,enhance antibody titer and improve the contents of IL-2 and IFN-γ compared with OP at most time points (P<0.05).These results indicated that OPL could significantly improve the immune-enhancing activity of OP,OPL would be expected to exploit into a new-type preparation of OP.
ophiopogon polysaccharide liposome;immune function;lymphocyte proliferation;immunosuppression
10.11843/j.issn.0366-6964.2015.07.023
2014-11-07
国家自然科学基金项目(31402240);中央高校基本科研业务费(2452015037);中国博士后科学基金项目(2014M550516)
范云鹏(1983-),男,山东烟台人,讲师,博士,主要从事兽医中药学与中药药理学研究,E-mail:ypfan@nwsuaf.edu.cn
*通信作者:童德文,教授,E-mail:dwtong@nwsuaf.edu.cn;宋晓平,教授,E-mail:sxpxbnl@163.com
S853.74
A
0366-6964(2015)07-1246-07

