山羊睾丸和附睾头β防御素家族的表达谱及生物信息学分析
张春香,杜海燕,张彩霞,郑亚琳,任有蛇,姜玉锁
(山西农业大学动物科技学院,太谷 030801)
山羊睾丸和附睾头β防御素家族的表达谱及生物信息学分析
张春香#,杜海燕#,张彩霞,郑亚琳,任有蛇,姜玉锁*
(山西农业大学动物科技学院,太谷 030801)
为探明山羊睾丸和附睾头β防御素家族基因表达特点及其蛋白的特性。利用3只7日龄羔羊睾丸和3只成年种公羊睾丸和附睾头的Illumina HiSeqTM2000高通量转录组测序数据,筛选出β防御素家族基因并进行差异表达基因比较分析,利用生物信息学对β防御素家族蛋白特性进行预测。结果显示:在山羊7日龄睾丸、成年睾丸和附睾头中分别表达7、12和33种β防御素,其表达量最高的分别是gDB123、gDB119和gDB124,成年睾丸中特异性表达是gDB33,附睾头中特异表达有21种β防御素。山羊β防御素分子量在6.89~13.85 ku,为小分子、极性、带正电荷、疏水性的强碱性多肽。山羊β防御素也是含高度保守6个半胱氨酸的空间构象,基本结构-C-X2-45-C-X3-6-C-X3-13-C-X4-7-CC-,其中24种β防御素结构为-C-X5,6-C-X3,4-C-X9-C-X5,6-CC-。有16种β防御素是分泌型糖蛋白,除gDB126无磷酸化位点外,其余的β防御素蛋白均有磷酸化位点。山羊附睾头特异性高度表达有丰富β防御素,它们是一类抗微生物的阳离子肽,在精子成熟过程中形成精子膜上糖被,或精子运动获得的过程中发挥重要作用;也可作为信号分子,某些信号通路中发挥作用。
β防御素家族;表达谱;生物信息、睾丸;附睾;公山羊
β防御素(beta-defensin,DB)是一种重要的内源性抗菌肽,作为新型的抗生素替代品,其功能的研究及其体外提纯对畜产品的安全生产具有重要意义。在雄性生殖器官中,免疫处于相对抑制状态,因此,在其中必须有一套可替代的有效保护机制,以保证生殖系统能够不受侵害。β防御素家族正是起到这种保护作用,雄性生殖器官表达有30多种β防御素,不仅保护精子免受微生物的侵袭[1-2],而且对附睾中精子成熟和贮存也有重要作用[3-4]。研究表明有35种β防御素在大鼠生殖器官中表达,仅大鼠附睾头中就有29种表达[1],有38种β防御素在男性睾丸和附睾中表达[2],29种公猪β防御素中有14种是在睾丸中表达[5]。F.Narciandi等[6]发现,牛13号染色体上编码的19种β防御素均在成年公牛生殖器官中表达,在6周龄公犊生殖器官中表达有10种。比较前人的研究发现哺乳动物(人、牛、猪)和啮齿类(大鼠、小鼠)生殖器官中β防御素表达差异很大,这种差异不仅体现在表达量上,而且也表现在种类上。然而有关山羊β防御素的研究报道很少,仅有E.Bagnicka等[7]克隆了山羊舌头β防御素1和β防御素2基因,并比较了其在几个山羊品种间的变异。目前山羊生殖器官β防御素的表达特性尚未见报道。本研究利用7日龄和成年山羊睾丸、成年山羊附睾头组织的高通量转录组测序结果,分析了公羊繁殖器官中表达β防御素家族表达特点,利用生物信息学分析对附睾头表达的β防御素进行分类,为山羊附睾头生物学功能的研究提供宝贵的基因组数据;为研究β防御素功能、表达特性和体外表达生产等提供依据。
1 材料与方法
1.1 试验样品采集及转录组数据获得
试验动物为7日龄,2岁太行青山羊((47.8±2.5)kg)公羊各3只。采用手术去势采集其睾丸和附睾头,液氮保存后,干冰包裹冻存管后送深圳华大基因科技有限公司进行转录组测序。转录组数据获取及分析方法参照张春香等[8]基于高通量转录组测序的睾丸和附睾差异基因分析。注释后总Unigene分为两部分,一部分是singletons(以Unigene开头),另一部分是clusters(以CL开头)。将获取部分β防御素的序列整理后递交NCBI数据库(KJ508072-KJ508084)。
1.2 生物信息学分析
利用EditSeq程序(DNAStar Lasergene V5.02)预测山羊β防御素的氨基酸数量、组成和蛋白质分子量;应用在线软件InterProScan预测β防御素的结构域和功能区域。通过NetOGlyc 3.1和NetNGlyc 1.0预测β防御素潜在O、N糖基化位点。用在线Scansite网站中motif Scan软件预测潜在磷酸化位点;在线网站PSORT上进行β防御素蛋白的信号肽预测和亚细胞定位;应用在线软件protscale程序预测山羊β防御素的疏水性(Hydrophobic constants derived from HPLC peptide retention times);利用在线iTOL软件(Version 2.1)构建人、牛、猪和山羊β防御素系统进化树[9-10]。
2 结 果
2.1 山羊附睾头和睾丸β防御素种类及表达特点
山羊附睾头和睾丸中表达的无可变剪接的β防御素(Goat beta-defensin,gDB)种类及表达特点见表1,7日龄山羊睾丸中表达的有6种:gDB123>gDB104>gDB114>gDB120>gDB108>gDB107;在成年山羊睾丸中表达的有7种,其表达量顺序:gDB119>gDB123>gDB120>gDB15>gDB104>gDB29>gDB107;7日龄和成年山羊睾丸中β防御素表达的种类和表达量不同。成年山羊附睾头中表达的有25种,表1中β防御素顺序按照附睾头中由高到低的排列,从表1可以看出附睾头特异表达有16种:gDB124、gDB109、gDB110 like、gDB116、gDB121、gDB132、gDB118、gDB130、gDB134、gDB126、gDB127、gDB131、gDB103B、gDB117、gDB115和SPAG11V。在这些β防御素中表达量最高的是在附睾头中特异性表达的gDB124,其片段长度494 bp;其次是gDB109,长度611 bp。表达量排名第3的是在7日龄山羊睾丸和附睾头中均表达的gDB108,长度483 bp,其在附睾头的表达量分别是7日龄山羊睾丸的表达量10 875倍。成年公羊睾丸中仅有gDB119和gDB123的表达量显著高于附睾头。

表1 山羊睾丸和附睾头中β防御素基因(单一)表达量 (FPKM值a)
山羊睾丸和附睾头中表达有可变剪接的β防御素种类及表达特点见表2。在成年公羊睾丸和附睾头中共有9种有可变剪切的β防御素。在7日龄公羔睾丸中有gDB128的2个转录本和gDB112的1个转录本,其表达量均较低,FPKM值<1。在成年公羊睾丸中表达有5种可变剪接的β防御素,其中gDB122的2个转录本,为睾丸最高表达量,有可变剪接的β防御素;gDB33转录本1和2是成年睾丸中特异性表达的;除此之外,还有gDB128的转录本1、gDB112的转录本2和gDB105的转录本5。在成年公羊附睾头中有8种可变剪切的β防御素,其中可变转录本gDB122a的表达量最高,是成年睾丸中表达量的54倍。在附睾头中特异性表达的有gDB108l的3个转录本、gDB112的转录本1、gDB105的转录本1~5、gDB30的2个转录本、gDB110的2个转录本和SPAG11E的2个转录本。

表2 山羊睾丸和附睾头中β防御素基因(可变剪切)表达量
2.2 山羊β防御素家族生物信息学分析
2.2.1 山羊β防御素蛋白的理化性质分析 从表3可以看出,山羊附睾头中β防御素为小分子、极性和疏水性蛋白,分子量在6.89~13.85 ku,其中分子量最高的是gBD112,分子量最低的是gBD121。除gBD134和gBD108ltr3为酸性AA外,其余的β防御素均为碱性AA,其中碱性最强的AA是gBD129,等电点9.729。当pH=7.0时,gBD117带电量最大11.855(正电荷);其次是gBD129,带电量11.617;gBD110tr2带电量最低(正电荷)0.898。gBD108tr3和gBD134是带负电荷,带电量分别为-1.928和-1.296。
2.2.2 β防御素家族系统发育分析 将从NCBI数据库中获取的37个人β防御素(Human defensins,hDBs)、28个牛β防御素(Cattle defensins,cDBs)、14个猪β防御素(Pig defensins,pDBs)和山羊附睾头中38个β防御素(包括转录本)(gDBs)共117个蛋白质序列用在线构建系统发育树(图1)。从进化树分析可以看出,4个物种的β防御素蛋白被划分为类群A-类群H共8个类群,β防御素129、123和132单独形成进化支。其中类群A和E成员数较少,类群A包含β防御素123和122;类群E包含β防御素117、118和125。类群G包含15种共19个β防御素:8种牛β防御素聚为一个次级分支,人和猪的β防御素1、2和103各聚一个次级分支,人β防御素136和137聚为一个次级分支。大多数进化树未端分支是不同物种的同一种类β防御素,说明β防御素种间保守性较强。从基因组家族进化历史分析,最先β防御素129,其次是β防御素123和132,类群由A~H发生历史越来越晚。

表3 山羊睾丸和附睾头中β防御素蛋白理化性质
2.2.3 β防御素蛋白的结构特点及其功能区域 从表4可以看出山羊的无可变剪切的单一β防御素蛋白都具有6个半胱氨酸残基(阴影区域),其结构为-C-Xn-C-Xn-C-Xn-C-Xn-CC-。除gBD112为-C-X45-C-X6-C-X3-C-X7-CC-,gBD114为-C-X14-C-X3-C-X13-C-X6-CC-,gBD107为-C-X6-C-X3-C-X9-C-X7-CC-,gBD130为-C-X2-C-X5-C-X4-C-X5-CC-外,其余β防御素蛋白均为C-X6-C-X3-C-X9-C-X5-CC-。
从表5可以看出山羊可变剪切β防御素蛋白具有2~8个半胱氨酸残基(阴影区域)。其中gBD105转录本2和gBD110转录本1仅含有2个半胱氨酸残基;gBD128tr 1和gBD105tr1含有3个半胱氨酸残基;
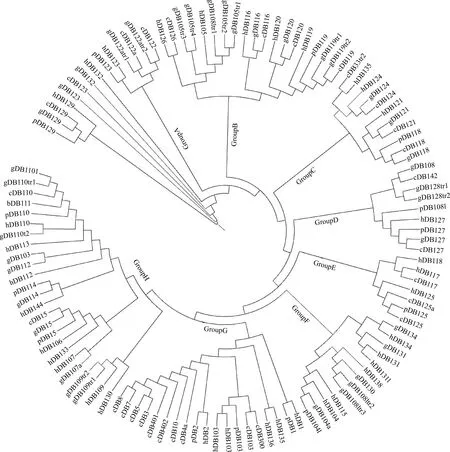
图1 人、牛、猪和山羊β防御素家族的进化树 (NJ法,自展值>80)Fig.1 A phylogenic analysis of beta-defensin genes among humans,cattle,pigs and goats (Neighbor joining method,Bootstrap>80)
gBD105tr3和4的结构特殊,有8个半胱氨酸残基:-C-X17-C-X2-C-X6-C-X3-C-X9-C-X5-CC-,gBD108ltr3为-C-X2-C-X8-C-X6-C-X3-C-X9-C-X5-CC-;SPAG11Etr 2有5个半胱氨酸残基,结构为-C-X9-C-X9-C--X6-CC-。其余β防御素均为-C-X5,6-C-X3,4-C-X9-C-X5,6-CC-。
InterProScan预测除gBD105tr1和tr2、gBD110tr1、gBD128tr1外,其余β防御素蛋白的功能区域在6个半胱氨酸残基的区域内,具有β防御素抗微生物的三级结构特征。
2.2.4 山羊附睾头β防御素蛋白糖基化位点和磷酸化分析 从表6可知,gDB117、gDB116、gDB129、gDB112、gDB118、gDB127、gDB131、gDB134、gDB126和gDB108ltr3均有N糖基化位点。除gDB107、gDB114、gDB120~124、gDB131、gDB134、gDB105tr4、gDB1101、gDB110tr2、gDB119trl和gDB122trl无O糖基化位点,其余的14个β防御素蛋白均含有O糖基化位点。从N和O糖基化位点的情况看,gDB107、gDB114、gDB119~124和gDB105tr4既无N糖基化位点,也无O糖基化位点,推测其不是糖蛋白。其余16个β防御素蛋白均可能是糖蛋白。除gDB126无磷酸化位点外,其余的β防御素蛋白磷酸化位点。2.2.5 山羊附睾头β防御素蛋白信号肽预测及亚细胞定位 表6结果显示,gDB104、gDB120、gDB121、gDB126、gDB105tr4、gDB108ltr3、gDB110tr2和gDB122tr1有信号肽,亚细胞定位到细胞外,是分泌蛋白。gDB117、gDB123和 gDB131也有信号肽,亚细胞定位在细胞核内。gDB118、 gDB124和gDB109tr1也有信号肽,亚细胞定位在线粒体内。gDB108、gDB112、gDB116、gDB127、gDB129、 gDB119tr1、 gDB128tr2和SPAG 11Etr2均定位在细胞核内。gDB107、gDB114、gDB132、gDB134和gDB110like定位在细胞质中。PSORT预测结果还显示在gDB107、gDB112、gDB129、gDB131、gDB134和gDB122tr1蛋白的C端有ER膜保留信号(ER Membrane Retention Signals):KKXX-like 元件,而gDB119tr1 和gDB109tr1蛋白不仅C端有ER膜保留信号KKXX-like 元件,N端还有ER膜保留信号XXRR-like 元件,因此,这些β防御素有可能是内质网膜的分子伴侣。

表4 山羊睾丸和附睾头中β防御素(单一序列)蛋白序列

表5 山羊睾丸和附睾头中β防御素(可变剪切)蛋白序列
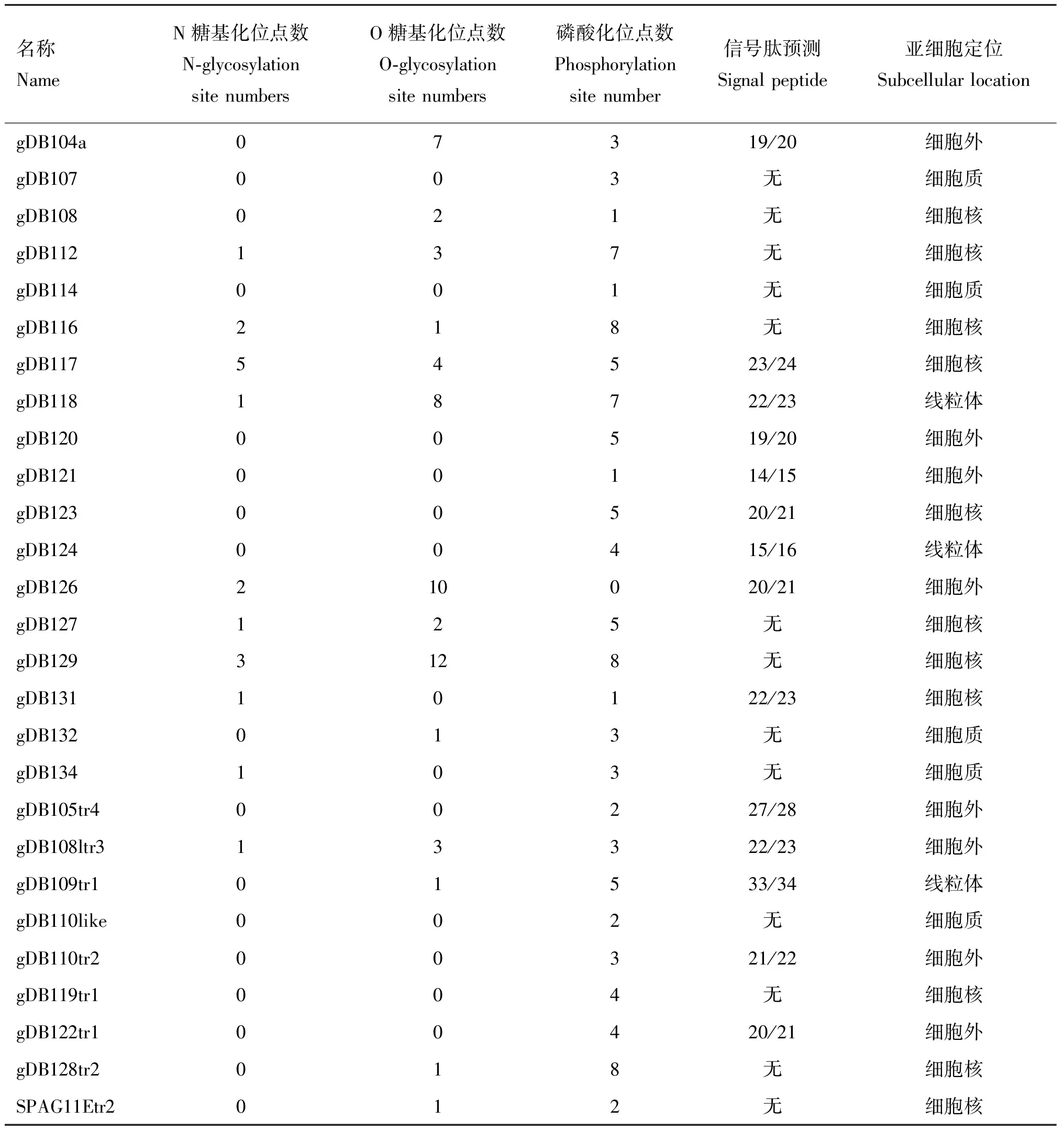
表6 山羊β防御素蛋白修饰及亚细胞定位
3 讨 论
3.1 附睾头和睾丸β防御素种类及表达特点
在雄性生殖器官内β防御素发挥双重功能,它们不仅是内源性抗微生物肽而且还对精子的成熟发挥重要作用[3-4,11-12]。S.H.Hall等研究显示表达在男性生殖器官中β防御素有38种之多[1],其中高度表达的有19种:hDB120、hDB133、hDB104、hDB111、hDB118、SPAG11E、hDB105、hDB119、hDB107、hDB121、hDB108、hDB125、hDB126、hDB127、hDB128、hDB129、hDB132、hDB122p和hDB123。J.S.Zhang等[13]用RT-PCR检测男性附睾13种β防御素中,其中附睾头中hDB104、hDB118和hDB119表达量较高,hDB107、hDB108、hDB123和hDB1是在附睾头中特异表达的。在大鼠生殖器官中β防御素有35种[14],RT-PCR检测结果显示在睾丸中表达有7种,表达量顺序由高到低是:rDB24、rDB14、rDB33、rDB27、rDB37、rDB29和rDB36;附睾头有29种,其中特异性表达的有rSPAG11E、rDB12、rDB17和rDB18,高度表达的有rDB39、rDB44、rDB25和rDB29[2]。家鼠附睾头表达β防御素种类与大鼠基本相同,大多数β防御素的表达部位和表达量也相同,仅有mDB15和rDB15、mDB1和rDB1、mDB44和rDB44的表达部位和表达量不同[15],还有研究表明mDB11和mDB12是家鼠附睾头特异性表达的[16]。M.K.Choi等[5]用RT-PCR方法检测到2周龄公猪睾丸中表达有12种β防御素,表达量顺序由高到低是:pDB4、pDB119、pDB104、pDB122、pDB115、pDB108、pDB128、pDB112、pDB129、pDB124、pDB116和pDB118,其表达β防御素种类多于本研究7日龄公羔睾丸中8种gDB123、gDB104、gDB114、gDB120、gDB108、gDB107、gDB128和gDB112。B.Guyonnet等在公猪附睾中发现了7种β防御素,在附睾头中高度表达的有pDB109、pDB111、pSPAG11B、pDB121和pDB113(按照由高到低排序),仅pDB129在附睾头中没有检测到[17]。现研究发现在荷斯坦奶牛和挪威红牛的公牛附睾头中表达有位于13号染色体上19种β防御素,其中cDB142、cDB120、cDB122a、cDB116、cDB119和cDB117表达量最高,其次是cDB124、cDB122和cDB118,然后是cDB127、cDB128、cDB129、cDB115、cDB121和cDB123,表达量最低的是cDB132、cDB126、cDB125和cDB125a[6]。本研究转录组分析结果发现成年公羊附睾头中表达25种单一β防御素和8种有可变剪切β防御素(共22个转录本),其种类较男性生殖器官38种少,这可能是本研究没有检测附睾体和附睾尾而引起的种类上差异。与公牛附睾头中β防御素相比,除没有检测到DB142、DB125和DB125a,其余16种均在公羊附睾头中检测到,但表达量高低有较大的差异,除了品种差异外,所检测的年龄阶段(18、24月龄公羊)差异也有可能引起表达的差异。
3.2 山羊β防御素的生物信息学分析
3.2.1 β防御素的理化性质 β防御素是一类阳离子肽,分子量4~10 ku[18-20]。山羊睾丸和附睾头β防御素的理化性质分析结果显示当pH 7.0时,除gBD108tr3(-1.928)和gBD134(-1.296)是带负电荷,其余均是带正电荷,说明山羊β防御素是带阳离子短链多肽,均为碱性;山羊β防御素分子量在6.89~13.85 ku,高于人、鼠上报道的β防御素的分子量,这可能是种间差异引起的。
3.2.2 β防御素的结构特点 A.A.Patil等[2]研究发现人、大鼠、小鼠和狗β防御素都有由6个半胱氨酸构成的高度保守的空间模式,基本模式:-C-X5-8-C-X3-7-C-X5-13-C-X4-7-CC-,由此形成了严格的3个反平行β折叠[21-23],这种结构有利于形成可与细胞膜相互作用的低聚体,使其通透性增加[24],使β防御素具有了抗微生物的活性。本研究中山羊无可变剪切的单一β防御素蛋白也都具有6个半胱氨酸残基,基本结构为-C-X2-45-C-X3-6-C-X3-13-C-X4-7-CC-。除gBD112 、gBD114、gBD105和gBD130外,其余β防御素蛋白均为C-X6-C-X3-C-X9-C-X5-CC-,该模式与现人、大鼠、小鼠和狗β防御素的基本结构一致,gBD112的N端比较长,这可能会增强本身的免疫功能[21]。对于有可变剪切gBD105转录本3和4、gBD108l有8个半胱氨酸残基,SPAG11E有5个半胱氨酸残基,这种现象在人β防御素也有,例如hDB105、hDB133等,半胱氨酸超出或缺失是否会引起三级空间结构的变化目前还尚待进一步研究。
3.2.3 β防御素蛋白修饰与功能 现已报道的大鼠rDB22和猕猴β防御素126是糖蛋白[3-4,25],在精子整个表面形成糖基化外壳,可以与抗精子的抗体结合,使其不受免疫识别[26-27]。大鼠rDB15是包被精子头部顶体部分,该基因敲除后精子运动能力下降,受精率降低[13]。任有蛇等[28]研究结果显示gDB104a也是糖蛋白,包被在山羊精子的顶体部分和精子中段的线粒体上。在山羊睾丸和附睾头发现的β防御素有16种可能是糖蛋白,有些是N糖基化位点,有些是O糖基化位点,还有一部分既有N糖基化位点也有O糖基化位点。山羊gDB126有10个O糖基化位点,推测其功能与猕猴β防御素126相似[29]。除gDB126无磷酸化位点外,其余的β防御素蛋白磷酸化位点,这说明β防御素蛋白可能还是信号分子[30-31],大鼠Bin 1可与未成熟精子质膜Ca2+离子通道结合,激活Ca2+离子通道促进了Ca2+吸收,使精子获得了运动能力[12]。人附睾中高度表达hDB29通过与趋化因子受体CCR6的作用促进精子运动及其亲CCL20的趋化运动[32]。hDB3通过CCR6作用激活caspases 1 and 4、 Smad3、MAPKs 和NF-κB的通路增加皮肤角质细胞的IL-37的表达[33]。已有研究显示hDB5行使细胞信号的功能[34]。山羊附睾头中β防御素的功能还有待进一步深入研究。
4 结 论
山羊7日龄睾丸、成年睾丸和附睾头中分别表达有7、12和33种β防御素,表达量最高的β防御素依次是gDB123、gDB119和gDB124。成年睾丸中特异性表达是gDB33,附睾头中特异表达有21种β防御素。山羊β防御素分子量在6.89~13.85 ku,为小分子、极性、带正电荷的、疏水性的强碱性多肽。β防御素结构-C-X2-45-C-X3-6-C-X3-13-C-X4-7-CC-。有16种β防御素是糖蛋白,除gDB126外其余β防御素具有磷酸化位点,可作为信号分子。这些β防御素在精子成熟和母畜生殖道内运输过程中发挥重要作用。
[1] HALL S H,YENUGU S,RADHAKRISHNAN Y,et al.Characterization and functions of beta defensins in the epididymis[J].AsianJAndrol,2007,9 (4):453-462.[2] PATIL A A,CAI Y,SANG Y,et al.Cross-species analysis of the mammalian β-defensin gene expression in the male reproductive tract family:presence of syntenic gene clusters and preferential expression in the male reproductive tract[J].PhysiolGenomics,2005,23(1):5-17.
[3] YUDIN A I,TOLLNER T L,TREECE C A,et al.Beta -defensin 22 is a major component of the mouse sperm glycocalyx[J].Reprod,2008,136(6):753-765.
[4] YUDIN A I,TREECE C A,TOLLNER T L,et al.The carbohydrate structure of DEFB126,the major component of the cynomolgus macaque sperm plasma membrane glycocalyx[J].MembraneBiol,2005,207(3):119-129.
[5] CHOI M K,LE M T,NGUYEN D T,et al.Genome-level identification,gene expression,andcomparative analysis of porcine β-defensin genes[J].BMCGenetics,2012,13:98.
[6] NARCIANDI F,LLOYD A T,CHAPWANYA A,et al.Reproductive tissue-specific expression profiling and genetic variation across a 19 gene bovine β-defensin cluster[J].Immunogen,2011,63(10):641-651.
[8] 张春香,张国林,郭丽娜,等.基于高通量转录组测序的山羊睾丸和附睾头差异表达基因分析[J].畜牧兽医学报,2014,44(3):391-401. ZHANG C X,ZHANG G L,GUO L N,et al.The analysis of differentially expressed genes between caprine testes and caput of epididymis based on transcriptomes with high-throughput RNA-seq technology[J].ActaVeterinariaetZootechnicaSinica.2014,44(3):391-401.(in Chinese)
[9] LETUNIC I,BORK P.Interactive tree of life (iTOL):an online tool for phylogenetic tree display and annotation[J].Bioinformatics,2006,23(1):127-128.
[10] LETUNIC I,BORK P.Interactive tree of life v2:online annotation and display of phylogenetic trees made easy[J].NucleicAcidsRes,2011,W475-478,doi:10.1093/nar/gkr201.
[11] YENUGU S,HAMIL K G,RADHAKRISHNAN Y,et al.The androgen-regulated epididymal sperm-binding protein,human beta-defensin 118 (DEFB118) (formerly ESC42),is an antimicrobial beta-defensin[J].Endocrinol,2004,145(7):3165-3173.
[12] ZHOU C X,ZHANG Y L.XIAO L,et al.An epididymis-specific beta-defensin is important for the initiation of sperm maturation[J].NatCellBiol,2004,6(5):458-464.
[13] ZHAO Y,DIAO H,NI Z,et al.The epididymis-specific antimicrobial peptide β-defensin 15 is required for sperm motility and male fertility in the rat (Rattusnorvegicus)[J].CellMolLifeSci,2011,68:697-708.[14] ZHANG J S,LIU Q,LI Y M,et al.Genome-wide profiling of segmental-regulated transcriptomes in human epididymis using oligo microarray[J].MolCellEndocrinol,2006,250(1-2):169-177.
[15] JELINSKY S A,TURNER T T,BANG H J,et al.The rat epididymal transcriptome:comparison of segmental gene expression in the rat and mouse epididymides[J].BiolReprod,2007,76(4):561-570.
[16] YAMAGUCHI Y,NAGASE T,MAKITA R.Identification of multiple novel epididymis-specific beta-defensin isoforms in humans and mice[J].JImmunol,2002,169(5):2516-2523.
[17] GUYONNET B,MAROT G,DACHEUX J L,et al.The adult boar testicular and epididymal transcriptomes[J].BMCGenomics,2009,10:369.
[18] LEHRER R I,GANZ T.Defensins of vertebrate animals[J].CurrOpinImmunol,2002,14:96-102.
[19] BAUER F,SCHWEIMER K,KLÜVER E,et al.Structure determination of human and murine beta-defensins reveals structural conservation in the absence of significant sequence similarity[J].ProteinSci,2001,10:2470-2479.
[20] HOLLOX E J,BARBER J C,BROOKES A J,et al.Defensins and the dynamic genome:what we can learn from structural variation at human chromosome band 8p23.1[J].GenomeRes,2008,18(11):1686-1697.
[21] GANZ T.Defensins:Antimicrobial peptides of innate immunity[J].NatRevImmunol,2003,3:710-720.
[22] GANZ T.Defensins:Antimicrobial peptides of vertebrates[J].CRBiol,2004,327(6):539-549.
[23] LEHRER R I.Primate defensins[J].NatRevMicrobiol,2004,2:727-738.
[24] HOOVER D M,RAJASHANKAR K R,BLUMENTHAL R,et al.The structure of human defensin-2 sows evidence of higher order oligomerization[J].JBiolChem,2000 275:32911-32918.
[25] YENUGU S,HAMIL K G,BIRSE C E,et al.Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family;salt sensitivity,structural dependence and their interaction with outer and cytoplasmic membranes ofEscherichiacoli[J].BiochemJ,2003,372(Pt 2):473-483.
[26] RAO J,HERR J C,REDDI P P,et al.Cloning and characterization of a novel sperm-associated isoantigen (E-3) with defensin- and lectin-like motifs expressed in rat epididymis[J].BiolReprod,2003,68:290-301.
[27] YUDIN A I,GENERAO S E,TOLLNER T L,et al.Beta-defensin 126 on the cell surface protects sperm from immunorecognition and binding of anti-sperm antibodies[J].BiolReprod,2005,73:1243-1252.
[28] 任有蛇,张国林,郭丽娜,等.公山羊β防御素104a生物信息学分析及表达特性研究[J].畜牧兽医学报,2015,45(2):41-49. REN Y S,ZHANG G L,GUO L N,et al.Bioinformatic analysis and expression characteristics of goat beta-defensin 104a gene in adult bucks[J].ActaVeterinariaetZootechnicaSinica,2014,45(2):41-49.(in Chinese)[29] TOLLNER T L,YUDIN A I,TARANTAL A F,et al.Beta-defensin 126 on the surface of macaque sperm mediates attachment of sperm to oviductal epithelia[J].BiolReprod,2008,78:400-412.
[30] YANG D,CHEN Q,HOOVER D M,et al.Many chemokines including CCL20/MIP-3 display antimicrobial activity[J].JLeukocBiol,2003,74:448-455.
[31] YANG D,CHERTOV O,BYKOVAKAIA S N,et al.Beta-defensins:Linking innate and adaptive immunity through dendritic and T cell CCR6[J].Science,1999,286(5439):525-528.
[32] CABALLERO-CAMPO P,BUFFONE M G,BENENCIA F,et al.A role for the chemokine receptor CCR6 in mammalian sperm motility and chemotaxis[J].JCellPhysiol,2014,229(1):68-78.
[33] SMITHRITHEE R,NIYONSABA F,KIATSURAYANON C,et al.Human β-defensin-3 increases the expression of interleukin-37 through CCR6 in human keratinocytes[J].JDermatolSci, 2015,77(1):46-53.[34] LU W,DE LEEUW E.Functional intersection of Human defensin 5 with the TNF receptor pathway[J].FEBSLett,2014,588(10):1906-1912.
(编辑 程金华)
Expression Profiles and Bioinformatics Analysis of beta-defensin Family Genes in the Testes and Epididymal Caput of Bucks
ZHANG Chun-xiang#,DU Hai-yan#,ZHANG Cai-xia,ZHENG Ya-lin,REN You-she,JIANG Yu-suo*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
The study was conducted to investigate the expression characteristics and bioinformatics analysis of beta-defensin family genes in the testes and epididymal caput of bucks.The data were from the transcriptomes of three testes of 7-day-old kids,testes and epididymal caput of three adult bucks of known fertility analyzed by Illumina HiSeqTM2000 high-throughput RNA sequencing.All beta-defensin family genes were sorted out according to annotation of unigenes and contigs for analysis of different expression.Protein profile of beta-defensins was analyzed by bioinformatics methods.The results showed that a total of 7,12 and 33 β-defensins were discovered in testes of 7-day-old kids,testes and epididymal caput of adult bucks respectively,whilegDB123,gDB119 andgDB124 were the highest expression in the testes of 7-day-old kids,testes and epididymal caput of adult bucks respectively.gDB33 was specifically expressed in testes of adult bucks.Twenty-one β-defensins were specifically expressed in epididymal caput of adult bucks.The molecular weight of β-defensins was from 6.89 to 13.85 ku.The bioinformatics analysis showed that goat β-defensins protein were small molecular,polar,hydrophobicity and basic polypeptide with positive charge.A high degrees of conservation in spacing pattern was 6 cysteines in peptides sequence of β-defensins,which consensus pattern was -C-X2-45-C-X3-6-C-X3-13-C-X4-7-CC-.However,the pattern of 24 β-defensins was -C-X5,6-C-X3,4-C-X9-C-X5,6-CC-.A total of 16 β-defensins were secreted glycoprotein.Except forgDB126,the rest of 24 β-defensins had the phosphorylation sites.The goat β-defensins family protein were also the antimicrobial cationic peptides.The rich specific-epididymis β-defensins were expressed in epididymal caput,which could coat sperm plasma membrane with glycocalyx in sperm maturation and play a vital role in making sperm motion.And β-defensins maybe were cell signal in some pathways.
β-defensins family;expression profiles;bioinformatics;testis;epididymal caput;bucks
10.11843/j.issn.0366-6964.2015.07.007
2015-01-23
山西省科技攻关计划项目(20110311029;20130311025-2)
张春香(1972-),女,山西侯马人,副教授,博士,主要从事动物遗传育种与繁殖研究,Tel:0354-6285990,E-mail:zhchx66@126.com。杜海燕(1978-),女,山西偏关人,博士生,主要从事动物遗传育种与繁殖研究,E-mail:dhy782@126.com。张春香与杜海燕为并列第一作者
*通信作者:姜玉锁,教授,主要从事动物遗传育种与繁殖研究,Tel:0354-6285990,E-mail:jiangys_001 @126.com
S827.2
A
0366-6964(2015)07-1122-12

