鸡肌肉组织实时荧光定量PCR及Western杂交内参基因的筛选
王红杨,刘冉冉,赵桂苹,郑麦青,李庆贺,李 鹏,刘 丽,文 杰
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
鸡肌肉组织实时荧光定量PCR及Western杂交内参基因的筛选
王红杨,刘冉冉,赵桂苹,郑麦青,李庆贺,李 鹏,刘 丽,文 杰*
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
本研究对5种常用“持家基因”作为鸡肌肉组织发育早期基因和蛋白检测内参基因的有效性进行了评价,为鸡肌肉发育相关分子检测中内参基因的选择提供科学依据。应用实时荧光定量PCR(RT-qPCR)和Western blot技术,分别检测了鸡12胚龄、17胚龄、1日龄和14日龄胸肌中β肌动蛋白(ACTB)、β微管蛋白(TUBB)、TATA结合蛋白(TBP)、甘油醛-3-磷酸脱氢酶(GAPDH)和热休克蛋白70(HSP70)的mRNA和蛋白表达水平。结果表明,在鸡发育早期胸肌组织中,仅HSP70 mRNA和蛋白在各阶段间表达水平差异不显著,GAPDH、TUBB、TBP和ACTB的mRNA和蛋白表达水平在检测的各个时间点间均差异显著或极显著(P<0.05或P<0.01)。HSP70更适合作为鸡肌肉发育早期基因和蛋白检测的内参基因。本结果为研究发育期鸡肌肉组织相关功能基因和蛋白提供了必要的方法学基础,对其他物种的相关研究也有重要借鉴意义。
鸡;肌肉组织;早期发育阶段;实时荧光定量PCR;Western杂交;内参基因
实时荧光定量PCR(RT-qPCR)和Western杂交是相对定量组织或细胞中特定基因或蛋白表达水平的常用技术,广泛应用于基因功能等分子生物学基础研究、转基因产品检测、抗体活性检测和疾病早期诊断等方面[1-3]。在实际操作中,RNA或蛋白浓度测定、加样、反转录或转膜效率等都有可能导致RT-qPCR和Western杂交上样量的差异,这就需要用内参基因对上样量进行校正[4-7]。理想的内参基因或蛋白是表达水平维持恒定或不受试验条件和机体发育变化影响的一类基因或蛋白,通常为持家基因或其所表达的蛋白。β肌动蛋白(ACTB)、β微管蛋白(TUBB)、TATA结合蛋白(TBP)、甘油醛-3-磷酸脱氢酶(GAPDH)、核纤层蛋白B1(LMNB1)、组蛋白H3(H3)、ATP合成酶亚基(ATP1A)等持家基因因其在各种组织、细胞中均表达且表达水平相对恒定而常作为内参基因。然而,部分持家基因的mRNA或蛋白表达水平可能会随着机体发育变化而产生差异。M.Bionaz等[8]发现,不同泌乳阶段奶牛乳房中ACTB和GAPDH的mRNA表达水平差异较大;S.Mamo等[9]发现体内外培养不同发育阶段小鼠胚胎中ACTB的mRNA表达水平差异较大;M.Rocha-Martins等[10]发现,ACTB蛋白表达水平随着大鼠视网膜的发育明显下降。因此,特定试验条件下,内参基因的选择就成为试验的关键点和难点。目前,有关鸡肌肉组织不同发育时期基因及蛋白检测内参基因的研究尚未见报道,制约了肌肉发育分子机制等相关研究的开展。
本研究通过对北京油鸡胚胎期至生长早期胸肌4个时间点、5个持家基因的mRNA和蛋白表达水平比较研究,旨在筛选出稳定表达的内参基因,为今后肌肉生长发育、肉质性状和疾病性状相关功能基因及蛋白的挖掘和功能验证提供科学依据。
1 材料与方法
1.1 试验材料
本试验中的北京油鸡种蛋和雏鸡来自于中国农业科学院北京畜牧兽医研究所昌平试验基地。在12胚龄(Ed 12)、17胚龄(Ed 17)、1日龄(1 d)、14日龄(14 d)分别随机选择3只,取其双侧胸肌组织。所采集样本迅速放入液氮中冷冻,-80 ℃保存备用。
1.2 总RNA提取
利用总RNA提取试剂盒(天根,北京)提取各日龄胸肌组织总RNA。琼脂糖凝胶电泳鉴定总RNA完整性,并经核酸定量仪NanoDrop2000(Thermo scientific,美国)测定浓度及根据A260 nm/A280 nm值确定RNA纯度。
1.3 PCR引物设计
根据定量PCR引物设计原则,利用Primer Premier 5.0软件,分别设计ACTB、TUBB、TBP、GAPDH和HSP70等5个候选内参基因的定量PCR引物,并由华大基因科技有限公司合成。引物信息如表1所示。

表1 实时荧光定量PCR检测所用5个候选内参基因的引物信息
1.4 cDNA合成和实时荧光定量PCR
cDNA反转录参照PrimerScriptTM RT Master Mix(Perfect Real time)试剂盒(TaKaRa,美国)操作说明进行,-20 ℃保存备用。RT-qPCR参照KAPA SYBR®FAST qPCR Kit Master Mix(2×) Universal(KAPA,美国)试剂盒说明书进行。每个样品3个技术重复。
1.5 总蛋白提取和浓度测定
取100 mg左右胸肌组织,加入20倍体积的RIPA裂解液(碧云天,上海),用干净剪刀将组织剪碎,然后置于2 mL玻璃匀浆器中进行匀浆,匀浆后冰上静置30 min,不时摇晃。4 ℃,12 000 r·min-1离心30 min,取上清液。所得样品总蛋白用BCA蛋白定量试剂盒(Thermo scientific,美国)测定蛋白浓度,并用1×PBS缓冲液将蛋白浓度均一化为2 μg·μL-1,分装,-80 ℃保存备用。
1.6 SDS聚丙烯酰胺凝胶电泳
用SDS-PAGE凝胶制备试剂盒(康为世纪,北京)制备分离胶浓度为12%、浓缩胶浓度为5%、厚度为1.5 mm的配制胶。将蛋白样品与5×还原型SDS-PAGE上样缓冲液(康为世纪,北京)以4∶1进行混合,95 ℃金属浴10 min,4 ℃,12 000 r·min-1离心5 min,取上清液并分装,-20 ℃保存备用。取20 μL即32 μg总蛋白上样,样品依次为蛋白分子量标准(Thermo scientific,美国),Ed 12、Ed 17、1 d和14 d胸肌总蛋白样品。初始电压80 V,约30 min后样品压成一条细线,提高电压至120 V,继续电泳直至溴酚蓝泳出分离胶下缘。
1.7 转膜和封闭
将大小适中的PVDF膜(0.22 μm,Millipore,美国)无水甲醇浸泡5 min;胶纯水浸泡5 min,然后将PVDF膜、胶、滤纸、夹子和海绵(Bio-Rad,美国)在转膜液中浸泡10 min。按照黑板→海绵→滤纸→胶→膜→滤纸→海绵→白板的顺序制作“三明治”,确保每层之间没有气体。200 mA转膜90 min。转膜后采用5%脱脂奶粉(BD,美国)室温摇床封闭1 h。TBST洗膜2次,TBS洗膜1次,每次5 min。
1.8 抗体孵育和显影
ACTB(abcam,ab8227,英国,1∶3 000)、TUBB(abcam,ab6046,英国,1∶500)、TBP(Millipore,MAB3658,美国,1∶3 000)、GAPDH(abcam,ab22555,英国,1∶10 000)、HSP70(abcam,ab69412,英国,1∶2 000)4 ℃摇床孵育过夜。TBST洗膜4次,TBS洗膜2次,每次5 min。羊抗兔二抗-HRP(康为世纪,北京)或羊抗鼠二抗-HRP(碧云天,上海)室温摇床孵育1 h。TBST洗膜4次,TBS洗膜2次,每次5 min。化学发光检测试剂(Millipore,美国)孵育2 min,于ImageQuant LAS 4000 mini仪器(GE,美国)自动曝光,采集Western杂交图像。每个时间点3个生物学重复。
1.9 数据分析
根据公式Q=E△Ct计算各基因的相对表达量Q。其中E为基因扩增效率(一般情况下将基因扩增视为理想扩增,扩增效率E默认为2),△Ct=Ctmin-Ct样品(Ctmin为每个基因不同样品中最小Ct值,Ct样品为每个样品的Ct值)[11-12]。应用BestKeeper软件分析候选内参基因的表达稳定度[13]。采用Image-Pro Plus 6.0软件分析Western杂交条带累积光密度值(IOD),利用SAS软件对数据进行单因素方差分析。
2 结 果
2.1 RNA样品和总蛋白质量检测
总RNA琼脂糖凝胶电泳如图1所示,RNA样品均有完整带型的5S rRNA、18S rRNA和28S rRNA。核酸定量仪检测时A260 nm/A280 nm在2.0左右,A260 nm/A230 nm在2.0~2.4,总RNA提取质量和纯度较高,可用于后续试验。
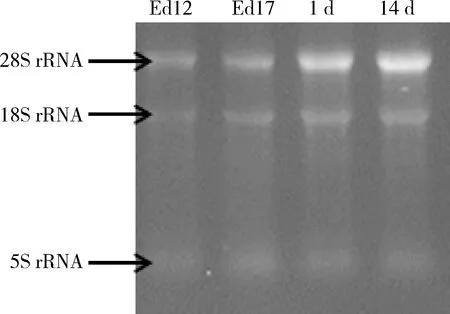
图1 总RNA琼脂糖凝胶电泳Fig.1 Total RNA agarose gel electrophoresis
总蛋白SDS聚丙烯酰胺凝胶电泳后,考马斯亮蓝染色,结果如图2所示。各泳道蛋白条带清晰,无高丰度蛋白和杂质,同一时间点样本生物学重复性较好,但在同一分子量位置蛋白沉积量明显不同,说明4个时间点因发育变化而蛋白表达模式可能存在较大差异。

图2 总蛋白考马斯亮蓝染色胶图Fig.2 Total protein Coomassie blue-stained gel
2.2 候选内参基因的引物检测
以胸肌cDNA为模板,进行RT-qPCR,产物经琼脂糖凝胶电泳,结果如图3所示,各内参基因扩增片段大小与引物设计预期片段大小一致,无杂带,引物特异性较好。

1.ACTB;2.TBP;3.HSP70;4.GAPDH;5.TUBB;M.DL2000 DNA marker图3 胸肌候选内参基因RT-qPCR产物琼脂糖凝胶电泳检测Fig.3 Agarose gel electrophoresis analysis of RT-qPCR products of candidate reference genes in breast muscle
2.3 候选内参基因相对表达水平及表达稳定度评价
以Ed 12胸肌mRNA表达水平为参照,候选内参基因相对表达水平如表2所示。在发育早期不同日龄胸肌组织中,ACTB、TBP、TUBB和GAPDH的mRNA相对表达水平差异极显著(P<0.01),仅HSP70的mRNA相对表达水平在各日龄间差异不显著(P>0.05)。
BestKeeper软件根据各样品候选内参基因Ct值对样品进行配对相关分析,计算标准偏差(SD)、变异系数(CV)及各基因间的泊松相关系数。根据SD评估内参基因的表达稳定度,SD越小,基因表达稳定度越高,反之,稳定度越低。发育早期鸡胸肌组织5个候选内参基因中,ACTB、TBP、TUBB的SD较大,并高于HSP70和GAPDH(图4)。从基因相对表达水平和表达稳定度两方面考虑,HSP70更适合作为发育早期鸡胸肌组织的内参基因。
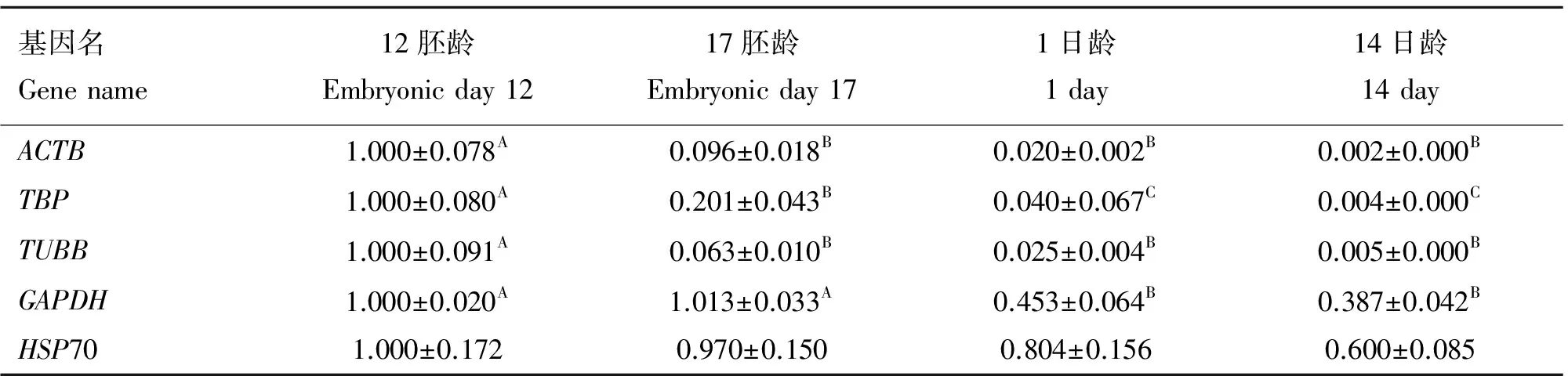
表2 发育早期胸肌候选内参基因的相对表达水平

图4 发育早期胸肌候选内参基因表达稳定度(BestKeeper)Fig.4 Stability of candidate reference genes in the early developmental stages of breast muscle by BestKeeper
2.4 Western blot结果
在预测分子量42 ku(ACTB)、33 ku(TBP)、50 ku(TUBB)、36 ku(GAPDH)和69 ku(HSP70)处分别检测到5种蛋白的Western杂交图像,如图5(A、C、E、G、I)所示。以Ed 12 IOD为对照,构建柱状图(图5B、D、F、H、J)。胸肌中ACTB、TBP和TUBB蛋白表达水平随机体发育显著或极显著降低(P<0.05或P<0.01);GAPDH蛋白表达水平随机体发育逐渐升高,且在14 d的表达极显著高于1 d(P<0.01);仅HSP70蛋白表达水平随机体发育未呈现显著性变化(P>0.05)。

A、C、E、G和I分别为ACTB、TUBB、TBP、GAPDH和HSP70的Western blot结果;B、D、F、H和J分别为相应IOD分析结果。**.P<0.01;*.P<0.05Western blot results for ACTB (A),TUBB (C),TBP (E),GAPDH (G) and HSP70 (I);IOD analysis for ACTB (B),TUBB (D),TBP (F),GAPDH (H) and HSP70 (J).** .P<0.01;*.P<0.05图5 Western blot及IOD分析结果Fig.5 Results of Western blot and IOD analysis
3 讨 论
实时荧光定量PCR和Western blot技术是定量基因或蛋白表达水平的常用检测技术[14-15]。对于Western blot而言,虽然丽春红染色、Sypro Ruby染色、考马斯亮蓝染色等总蛋白染色法为校正蛋白上样量提供了一些选择,但是这些方法存在着效果差、耗时间、灵敏度低和背景高等缺陷[16-18]。因此,选择合适的内参基因或蛋白对上样量进行校正是不可或缺的。
本研究表明,HSP70和GAPDH基因表达稳定度较高,ACTB等其他3个基因表达稳定度较差;ACTB、TUBB、TBP和GAPDH在鸡不同日龄胸肌组织中mRNA和蛋白表达水平均存在显著性变化,HSP70 mRNA和蛋白表达水平则无显著性变化。可能的原因是,对于哺乳动物及家禽骨骼肌发育而言,胚胎期是肌肉细胞数量增加(Hyperplasia)的时期,至出生(出雏)时肌纤维数量已经固定;生长早期则主要是肌肉细胞肥大(Hypertrophy),即体积增大的时期[19]。此外,随着胸肌的发育,肌纤维直径增加,密度减小,IIB型快速酵解纤维比例升高,肌肉的酵解性增强,最终胸肌完全由IIB型快速酵解纤维组成[20-21],这也可能与ACTB、TUBB、TBP和GAPDH等肌纤维发育相关基因表达不稳定和蛋白表达水平存在发育性变化相关。
HSP70在所有细胞内均能表达,环境中存在高温、缺氧、饥饿等应激原的情况下,HSP基因即被激活,高效表达[22]。S.Greer等[2]研究发现,HSP90在不同细胞培养密度情况下可以作为内参蛋白。鸡是恒温动物,本研究鸡从胚胎发育、出雏到14日龄的过程中,并未受到冷热应激。虽然HSP70在14日龄胸肌组织中的蛋白分子量大小与其他时间点稍有不同,这可能是蛋白翻译后修饰原因造成的,但是其蛋白表达水平与其他时间点差异不显著,相比较其他常规内参蛋白而言,是用于鸡发育早期肌肉组织目标蛋白Western blot检测相对理想的内参基因。
4 结 论
本研究从mRNA和蛋白水平证实HSP70更适合作为发育早期鸡胸肌组织实时荧光定量PCR和Western杂交的内参基因。
[1] ZHANG R F,YANG D Y,ZHOU C J,et al.β-actin as a loading control for plasma-based Western blot analysis of major depressive disorder patients[J].AnalBiochem,2012,427(2):116-120.
[2] GREER S,HONEYWELL R,GELETU M,et al.Housekeeping genes;expression levels may change with density of cultured cells[J].JImmunolMethods,2010,355(1):76-79.
[3] YOU J,HODGE C,WEN L,et al.Using soybean trypsin inhibitor as an external loading control for Western blot analysis of tear proteins:Application to corneal disease[J].ExpEyeRes,2012,99:55-62.
[4] COLELLA A D,CHEGENII N,TEA M N,et al.Comparison of Stain-Free gels with traditional immunoblot loading control methodology[J].AnalBiochem,2012,430(2):108-110.
[5] GHOSH R,GILDA J E,GOMES A V.The necessity of and strategies for improving confidence in the accuracy of Western blots[J].ExpRevProteomics,2014,11(5):549-560.
[6] EATON S L,ROCHE S L,LIAVERO HURTADO M,et al.Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting[J].PLoSONE,2013,8(8):e72457.
[7] GILDA J E,GOMES A V.Stain-Free total protein staining is a superior loading control to β-actin for Western blots[J].AnalBiochem,2013,440(2):186-188.[8] BIONAZ M,LOOR J J.Identification of reference genes for quantitative real-time PCR in the bovine mammary gland during the lactation cycle[J].PhysiolGenomics,2007,29(3):312-319.
[9] MAMO S,GAL A B,BODO S,et al.Quantitative evaluation and selection of reference genes in mouse oocytes and embryos culturedinvivoandinvitro[J].BMCDevBiol,2007,7:14.
[10] ROCHA-MARTINS M,NJAINE B,SILVEIRA M S.Avoiding pitfalls of internal controls:validation of reference genes for analysis by qRT-PCR and Western blot throughout rat retinal development[J].PLoSONE,2012,7(8):e43028.
[11] 孙美莲,王云生,杨冬青,等.茶树实时荧光定量PCR分析中内参基因的选择[J].植物学报,2010,45(5):579-587. SUN M L,WANG Y S,YANG D Q,et al.Reference genes for Real-time fluorescence quantitative PCR in Camellia sinensis[J].ChineseBulletinofBotany,2010,45(5):579-587.(in Chinese)
[12] 吴文凯,刘成前,周志刚,等.用于莱茵衣藻荧光定量PCR分析的内参基因选择[J].植物生理学通讯,2009,45(7):667-672. WU W K,LIU C Q,ZHOU Z G,et al.The selection of reference genes in Chlamydomonas reinhardtii P.A.dangeard by Real-Time quantitative PCR[J].PlantPhysiologyJournal,2009,45(7):667-672.(in Chinese)
[13] PFAFFL M W,TICHOPAD A,PRGOMET C,et al.Determination of stable housekeeping genes,differentially regulated target genes and sample integrity:BestKeeper-Excel-based tool using pair-wise correlations[J].BiotechnolLett,2004,26(6):509-515.
[14] HELENIUS A,MCCASLIN D R,FRIES E,et al.Properties of detergents[J].MethodsEnzymol,1979,56:734-749.
[15] KURIEN B T,SCOFIELD R H.A brief review of other notable protein blotting methods[J].MethodsMolBiol,2009,536:367-384.
[17] HAGIWARA M,KOBAYASHI K,TADOKORO T,et al.Application of SYPRO Ruby- and Flamingo-stained polyacrylamide gels to Western blot analysis[J].AnalBiochem,2010,397(2):262-264.
[18] WELINDER C,EKBLAD L.Coomassie staining as loading control in Western blot analysis[J].JProteomeRes,2011,10(3):1416-1419.
[19] VELLEMAN S G,ANDERSON J W,COY C S,et al.Effect of selection for growth rate on muscle damage during turkey breast muscle development[J].PoultSci,2003,82(7):1069-1074.
[20] 单艳菊,束婧婷,胡 艳,等.不同鸭种肌纤维早期发育特性及其与骨骼肌生长发育的相关性研究[J].农业生物技术学报,2014,22(2):225-231. SHAN Y J,SHU J T,HU Y,et al.Study on myofiber characteristics during early development stage and associations with skeletal growth and development in different duck breeds[J].JournalofAgriculturalBiotechnology,2014,22(2):225-231.(in Chinese)
[21] 赵景鹏.肉鸡肌纤维特性与肉质形状的形成规律及日龄营养调控研究[D].北京:中国农业科学院,2010. ZHAO J P.The formation of muscle fiber characteristics and meat quality traits and their modulation by dietary nutrient density in broiler chickens[D].Beijing:Chinese Academy of Agricultural Sciences,2010.(in Chinese)
[22] 张晓鹏.HSP70的生物学功能新进展[J].国外医学卫生学分册,2002,29(6):337-343. ZHANG X P.New progress in biological function of HSP70[J].ForeignMedicalSciences(SectionofHygiene),2002,29(6):337-343.(in Chinese)
(编辑 郭云雁)
Identification of Reference Genes by Real-Time Quantitative PCR and Western Blot in Chicken Muscle Tissues
WANG Hong-yang,LIU Ran-ran,ZHAO Gui-ping,ZHENG Mai-qing,LI Qing-he,LI Peng,LIU Li,WEN Jie*
(StateKeyLaboratoryofAnimalNutrition,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
This research evaluated the availability of 5 “housekeeping genes”as reference genes for gene expression detection in different early developmental stages of muscle tissues in chicken,which would provide scientific evidences for selecting reference genes in the molecules detection related to muscle development of chicken.Real-Time quantitative PCR (RT-qPCR) and Western blot were used to test the mRNA and protein levels of β-actin (ACTB),β-tubulin (TUBB),TATA-binding-protein (TBP),Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) and Heat shock 70 kDa protein (HSP70) in breast muscle of chicken at embryonic day 12 and 17,day 1 and day 14 post-hatch,respectively.The results showed that,only mRNA and protein levels of HSP70 didn’t significantly change in the early developmental stages of breast muscle in chicken,while that of other genes significantly altered (P<0.05 orP<0.01).HSP70 was more suitably used as reference gene for gene or protein expression detection in the early developmental stages of muscle tissues in chicken.This study provides methodological basis for functional genes and proteins studies of muscle development in chicken.It also could play a referential role in other species.
chicken;muscle tissues;early developmental stages;Real-Time quantitative PCR;Western blot;reference gene
10.11843/j.issn.0366-6964.2015.07.005
2014-10-10
国家自然基金青年基金项目(31201797);国家“863”项目(2011AA100301);中国农业科学院科技创新工程(ASTIP-IAS04)
王红杨(1991-),女,河南人,硕士,主要从事单胃动物营养与饲料科学研究,E-mail:wanghy0112@163.com
*通信作者:文 杰,E-mail:wenjie@caas.cn
S831.2
A
0366-6964(2015)07-1107-07

