可溶性环氧化物水解酶抑制剂对内皮祖细胞归巢功能的影响*
王振河,许丹焰,李卫华,谢 强,黄峥嵘,姜德谦△
1.厦门大学附属第一医院心内科,福建厦门361003;2.中南大学湘雅二医院心内科,长沙410011;
3.厦门市心血管病研究所,福建厦门361003)
环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)是具有强大生物活性的内生脂质环氧化合物,具有舒张血管、抗炎等作用[1-3]。EETs在细胞内由可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)迅速降解[4],使其作用明显受限。因此,使用sEH抑制剂,抑制EETs在体内降解可有效增加EETs在细胞内浓度及效用。内皮祖细胞(endothelial progenitor cells,EPCs)在干细胞移植修复心肌梗死中扮演重要角色,研究表明EETs可通过多种机制激活EPCs[5-7]。EPCs从外周向心肌组织归巢为EPCs修复心肌梗死重要途径[8-10],因此,增强EPCs归巢功能可能有效增强EPCs对梗死心肌的修复。本研究观察不同浓度sEH抑制剂对EPCs归巢功能的影响,以便为其在促进EPCs修复心肌梗死的研究奠定基础。
1 材料与方法
1.1 材料 本实验选用6周龄清洁级雄性云南昆明小鼠(中南大学湘雅二医院实验动物中心提供)作为EPCs的来源;CD34、CD133、CD31、Flk-1、Dil-acLDL、FITC-UEA-1购自美国Molecular probes公司;小动物呼吸机购自美国哈佛大学;胃蛋白酶、柠檬酸抗原修复缓冲液、DAB显色剂购自美国Vector公司。
1.2 方法
1.2.1 实验分组 依据可溶性环氧化物水解酶抑制剂(t-AUCB)不同浓度干预组分为6组,分别为0μmol/L t-AUCB、1μmol/L t-AUCB、10μmol/L t-AUCB、50μmol/L t-AUCB、100μmol/L t-AUCB干预组。
1.2.2 EPCs的分离、培养 小鼠胫骨及股骨骨髓通过密度梯度离心法分离单个核细胞,按5×105/cm密度放置预先包被fibronectin的细胞培养皿中,加入EBM-2培养基培养,培养基预先加入5%FBS和生长因子,4d后去除悬浮细胞,隔天半量更换培养基,倒置相差显微镜下观察不同时间点细胞形态。
1.2.3 EPCs的鉴定 双染色(Dil-acLDL,FITC-UEA-1):细胞培养7d后,依序往培养瓶内加入Dil-acLDL及FITCUEA-1(10mg/L),观察上述培养细胞摄取 Dil-acLDL及结合FITC-UEA-1能力,同时结合 Dil-ac-LDL、FITC-UEA-1细胞为EPCs;EPCs表面抗原鉴定:培养7d的细胞洗涤、离心后应用流式细胞仪检测 CD34、CD133、CD31、Flk-1表面标志表达。
1.2.4 t-AUCB体外对EPCs归巢功能的影响 EPCs培养7 d后,上述不同浓度t-AUCB(0、1、10、50、100μmol/L)预干预24h,加入Dil-acLDL至上述细胞悬液,浓度为2μg/mL,避光孵育1h,显微镜下观察Dil-acLDL吸收情况;开胸呼吸机辅助下结扎冠脉左前降支,1h后经尾静脉注射上述干预的EPCs,24h后处死小鼠,按不同区域分为梗死区、边缘区、正常区,边缘区为距离梗死区5mm,将上述各区域心脏剪成小粒,消化离心,荧光显微镜下记数不同区域心肌消化后Dil标记阳性细胞数。
1.3 统计学处理 采用SPSS 17.0统计软件进行统计分析,计量资料用x±s表示,并进行正态性和方差齐性检验,组间均数显著性检验用多个样本均数比较的方差分析(LSD-t检验),以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠EPCs的生长情况 刚接种时骨髓来源分离的单个核细胞呈圆形,散在悬浮于培养液内,24~48h后,部分细胞开始贴壁;4d后首次换液,去除培养瓶内未贴壁悬浮细胞,倒置相差显微镜下观察贴壁细胞生长状况(图1),细胞呈菊花状集落,中央为圆形细胞,周围为梭形细胞(图1A);7d后,细胞集落明显扩大,集落中央圆形细胞逐渐向梭形细胞转化(图1B);第8天可见细胞形成条索状(图1C);第10天细胞可达80%~90%融合,以多角形、类圆形及梭形细胞为主(图1D)。
2.2 荧光双染色结果 荧光显微镜下观察小鼠骨髓来源EPCs摄 取 Dil-acLDL、结 合 FITC-UEA-1 能 力,摄 取 DilacLDL阳性细胞呈红色荧光,结合UEA-1阳性细胞呈绿色荧光,双阳性细胞呈黄色荧光,结果示95%以上培养的细胞呈双阳性黄色荧光:双阳性细胞为EPCs(图2)。
2.3 表面分化抗原流式细胞仪鉴定结果 流式细胞仪检测结果示:相较于同型分化抗原,小鼠骨髓来源EPCs各表面分化抗原 含 量 CD34 为 (53.89±0.34)%,CD133 为 (52.79±0.67)%,CD31 为 (36.67±0.93)%,Flk-1 为 (43.88±0.48)%,见图3。
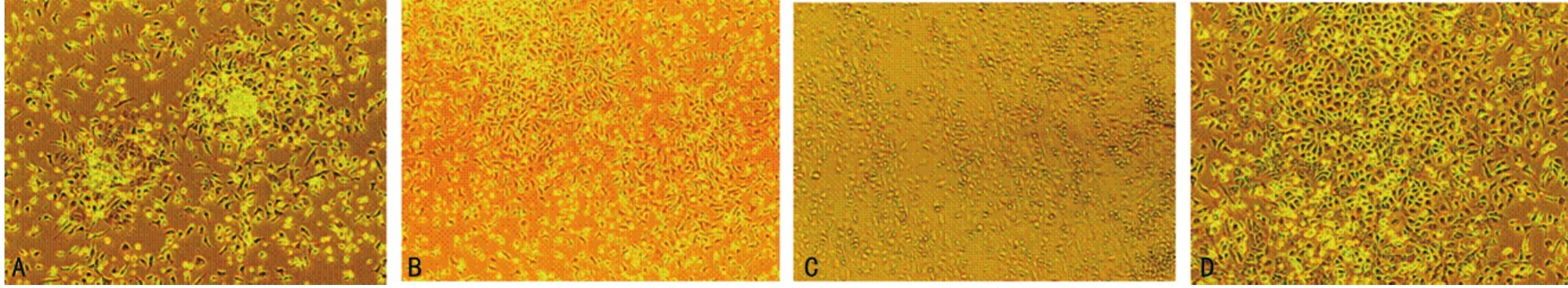
图1 内皮祖细胞培养结果(×200)
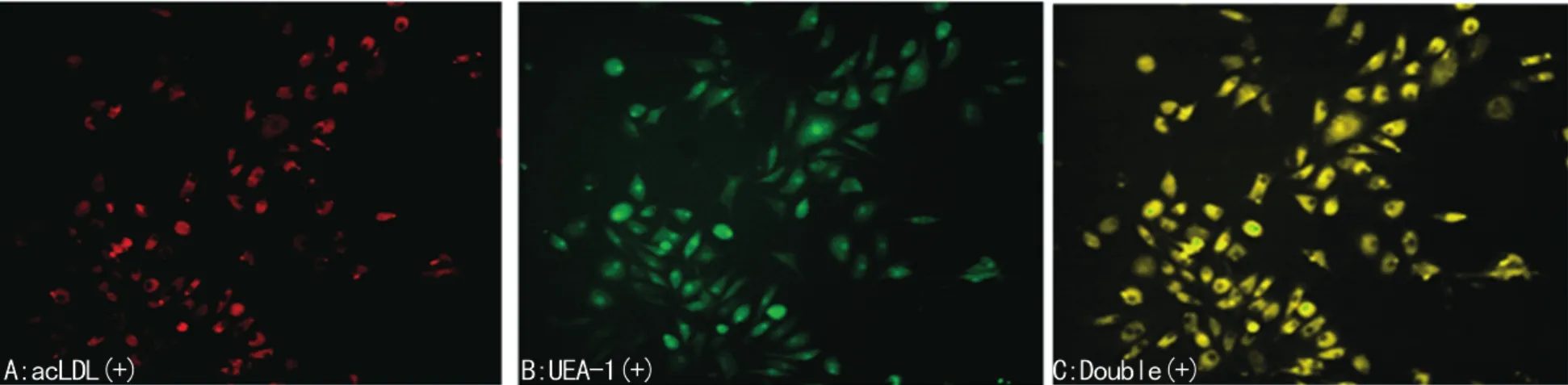
图2 EPCs摄取Dil-acLDL及FITC-UEA-1荧光染色结果(×200)
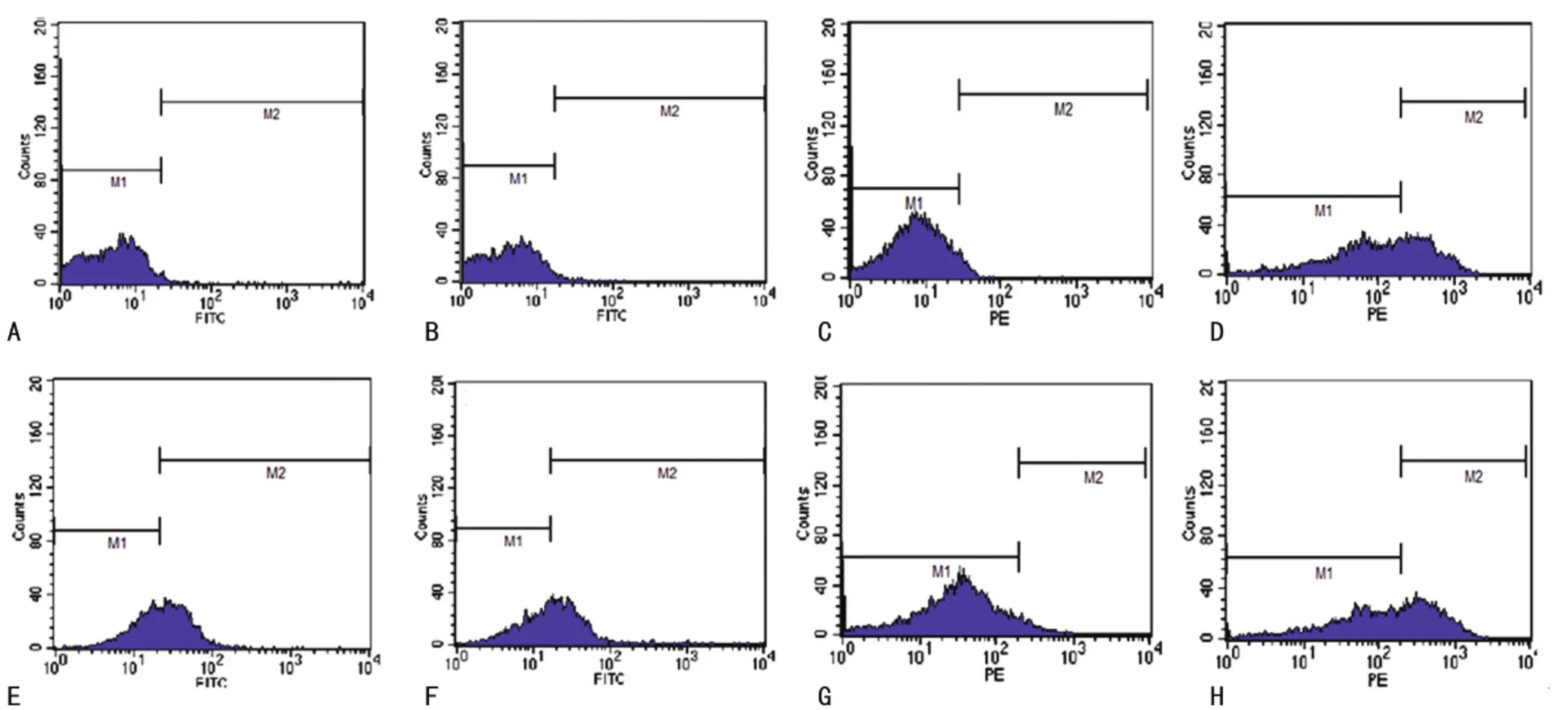
图3 小鼠骨髓来源EPCs表面分化抗原流式细胞仪分析结果
2.4 t-AUCB对小鼠EPCs归巢功能的影响
2.4.1 心肌梗死模型制作 称重小鼠,戊巴比妥那50mg/kg腹腔注射麻醉,连接各心电图电极,正常心电图示S-T段在基线水平位置(图4A),小鼠气管插管后连接呼吸机,打开胸腔,剪开心包,暴露左心耳(图4C)结扎冠状动脉中1/3,结扎后可见心电图呈ST段弓背向上抬高(图4B),结扎远端心肌活动度减弱(图4D),心肌苍白后紫绀(图4E),表明模型制作成功(图4)。

图4 正常、梗死心电图形态及心梗模型制作过程中心肌演变过程
2.4.2 不同浓度t-AUCB对EPCs归巢至梗死心肌不同部位的影响 从0~100μmol/L t-AUCB干预组,随着浓度增加,t-AUCB可明显呈浓度依赖性增强EPCs归巢至梗死心肌边缘区、正常区及梗死区能力,与0μmol/L t-AUCB相比,1、10、50、100μmol/L t-AUCB可显著增强EPCs归巢至上述区域能力(P<0.05),见表1。
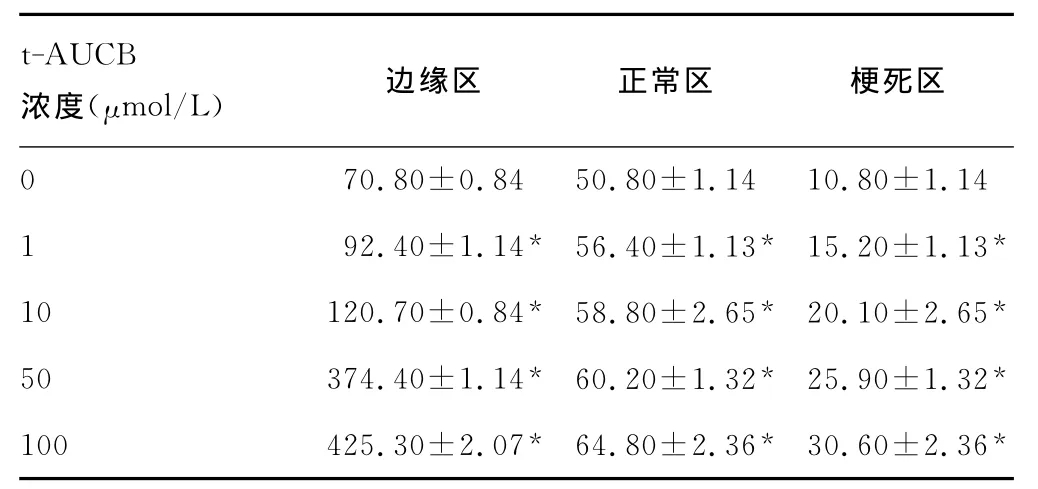
表1 不同浓度t-AUCB干预对EPCs归巢至心肌不同部位的影响(x±s)
3 讨 论
EPCs从外周向心肌组织归巢为EPCs修复心肌梗死重要途径。观察t-AUCB干预对EPCs归巢的影响可发现:在梗死心肌边缘区,增加t-AUCB浓度,边缘区的EPCs明显增多,达数百个,并且呈浓度依赖性,提示t-AUCB促进EPCs归巢至梗死心肌边缘区;从0μmol/L至100μmol/L,t-AUCB可呈浓度依赖性增强EPCs向心梗边缘区归巢;在正常心肌区域,随着t-AUCB干预浓度变大,正常心肌组织的EPCs细胞数虽有增多(组间P<0.05),但各组差异不大,只有数个细胞,且归巢至正常心肌细胞的细胞基数都不大,50个左右,提示在正常心肌,t-AUCB虽有作用,但明显减弱;计数梗死心肌细胞时作者发现:随着干预浓度逐渐增加,不同浓度t-AUCB干预的EPCs归巢至梗死心肌细胞数明显增加,各组之间比较差异有统计学意义(P<0.05),但归巢的细胞数均少,最多只有30个左右。
分析原因:(1)t-AUCB对外周培养的EPCs激活对归巢具有刺激作用;(2)心肌方面,完整的心肌组织需要有完整的血管内皮,开通的血管及活动的血流,以利于EPCs向心肌组织归巢,此为EPCs顺利归巢的前提条件及重要影响因素。在梗死区,由于结扎冠脉中断血流,EPCs经静脉进入小鼠后不能随血流运行至梗死区;EPCs虽有迁移能力[11-13],但心肌梗死后细胞肿胀、坏死,处于缺血缺氧环境,亦为EPCs向梗死心肌迁移提供障碍,心肌梗死后虽然有促进刺激EPCs归巢的细胞因子分泌[14-15],但抑制EPCs归巢至梗死区的因素远远大于其促进因素,所以,经外周静脉注射的EPCs归巢至梗死区域的细胞数少,而大量聚集在梗死心肌边缘区域;在正常区域,虽然供应心肌组织的血流没有中断,但缺少促进EPCs归巢的细胞因子,所以,归巢的细胞数介于上述两区域之间。
综上所述,从0~100μmol/L,随着浓度增加,可溶性环氧化物水解酶抑制剂t-AUCB进行性增强其正向调控EPCs归巢功能。心肌梗死后归巢至正常区域及梗死区域内EPCs较少,正常区虽有差异,但差异较小,经t-AUCB干预的EPCs主要归巢至梗死心肌边缘区域。所以,在后继检测t-AUCB干预EPCs对梗死心肌的影响研究时,研究对象只选取最有代表性的边缘区,可明显增加实验的特异性及准确性。
[1] Feng W,Xu X,Zhao G,et al.EETs and CYP2J2inhibit TNF-α-induced apoptosis in pulmonary artery endothelial cells and TGF-β1-induced migration in pulmonary artery smooth muscle cells[J].Int J Mol Med,2013,32(3):685-693.
[2]Jiang JX,Zhang SJ,Liu YN,et al.EETs alleviate ox-LDL-induced inflammation by inhibiting LOX-1receptor expression in rat pulmonary arterial endothelial cells[J].Eur J Pharmacol,2014,727:43-51.
[3] Xu DY,Davis BB,Wang ZH,et al.A potent soluble epoxide hydrolase inhibitor,t-AUCB,acts through PPARγto modulate the function of endothelial progenitor cells from patients with acute myocardial infarction[J].Int J Cardiol,2013,167(4):1298-1304.
[4] Shao J,Li Q,Wang H,et al.P-450-dependent epoxygenase pathway of arachidonic acid is involved in myeloma-induced angiogenesis of endothelial cells[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(5):596-601.
[5] Li L,Li N,Pang W,et al.Opposite effects of gene deficiency and pharmacological inhibition of soluble epoxide hydrolase on cardiac fibrosis[J].PLoS One,2014,9(4):e94092.
[6] Shen L,Peng H,Zhao S,et al.A potent soluble epoxide hydrolase inhibitor,t-AUCB,modulates cholesterol balance and oxidized low density lipoprotein metabolism in adipocytes in vitro[J].Biol Chem,2014,395(4):443-451.
[7] Borghini A,Sbrana S,Vecoli C,et al.Stromal cell-derived factor-1-3′A polymorphism is associated with decreased risk of myocardial infarction and early endothelial disturbance[J].J Cardiovasc Med(Hagerstown),2014,15(9):710-716.
[8] Wan C,Li J,Yang C,et al.Dynamics of endogenous endothelial progenitor cells homing modulated by physiological ischaemia training[J].J Rehabil Med,2015,47(1):87-93.
[9] Bertelsen LB,Hagensen M,Busk M,et al.In vivo bio-distribution and homing of endothelial outgrowth cells in a tumour model[J].Nucl Med Biol,2014,41(10):848-855.
[10]Liberda EN,Cuevas AK,Qu Q,et al.The acute exposure effects of inhaled Nickel nanoparticles on murine endothelial progenitor cells[J].Inhal Toxicol,2014,26(10):588-597.
[11]Huang L,Wang F,Wang Y,et al.Acidic fibroblast growth factor promotes endothelial progenitor cells function via Akt/FOXO3apathway[J].PLoS One,2015,10(6):e0129665.
[12]Li W,Du D,Wang H,et al.Silent information regulator 1(SIRT1)promotes the migration and proliferation of endothelial progenitor cells through the PI3K/Akt/eNOS signaling pathway[J].Int J Clin Exp Pathol,2015,8(3):2274-2287.
[13]Liu LH,Lai Y,Linghu LJ,et al.Effect of different concentrations of medroxy-progesterone acetate combined with 17β-estradiol on endothelial progenitor cells[J].Eur Rev Med Pharmacol Sci,2015,19(10):1790-1795.
[14]Kwon YW,Heo SC,Jeong GO,et al.Tumor necrosis factor-α-activated mesenchymal stem cells promote endothelial progenitor cell homing and angiogenesis[J].Biochim Biophys Acta,2013,1832(12):2136-2144.
[15]Shih CM,Chen YH,Lin YW,et al.MK-0626,a dipeptidyl peptidase-4inhibitor,improves neovascularization by increasing both the number of circulating endothelial progenitor cells and endothelial nitric oxide synthetase expression[J].Curr Med Chem,2014,21(17):2012-2022.

