脑源性神经生长因子的基因多态性与中国汉族人群缺血性卒中90天预后的相关性研究
赵静 吴慧 翁迎峰
(上海市闵行区中心医院神经内科,上海 201100)
·论著·
脑源性神经生长因子的基因多态性与中国汉族人群缺血性卒中90天预后的相关性研究
赵静吴慧翁迎峰
(上海市闵行区中心医院神经内科,上海201100)
摘要目的:探讨中国汉族人群中脑源性神经生长因子(brain-derived neurotrophic factor, BDNF)基因的单核苷酸多态性与缺血性卒中(ischemic stroke,IS)的关系。方法: 采用聚合酶链式反应-连接酶检测反应(polymerase chain reaction-ligase detection reaction,PCR-LDR)在494例IS患者(IS组)和337例健康对照者(对照组)中检测BDNF基因G196A位点的单核苷酸多态性,计算等位基因的频率分布。IS组在入院当天依据神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS)评估神经功能缺损程度,脑梗死后3个月随访时根据改良Rankin评分标准(modified Rankin Scale,mRS)评估患者的神经功能恢复情况。结果:IS组BDNF基因G196A位点AA基因型的频率高于对照组,差异有统计学意义(P<0.05)。IS组中轻症和重症患者在BDNF 基因G196A位点的基因型和等位基因频率分布上无显著差异(P=0.800)。但出院后90 d的随访结果显示,BDNF基因G196A位点AA基因型患者较GG基因型患者预后不良的相对风险度为1.406[P=0.008,比值比(OR)=0.406,95%可信区间(95%CI):1.203~1.813];采用Logistic回归方法对其他危险因素进行校正后,这种相关性仍然存在(P=0.012,OR=2.134,95%CI:1.178~3.866)。结论:BDNF基因G196A位点多态性与中国汉族人群IS急性期神经功能缺损程度可能无关, BDNF基因G196A位点呈GA+AA基因型的IS患者预后更差, A等位基因可能是预测中国汉族人群IS预后不良的独立生物学指标。
关键词脑源性神经生长因子;单核苷酸多态性;缺血性卒中;预后
卒中的病死率、病残率很高,即使在卒中幸存者中,仍有约75%的患者有不同程度的劳动力丧失[1]。缺血性卒中(ischemic stroke,IS)约占全部卒中的43%~79%[2]。临床发现,IS患者中不同个体的梗死部位、面积几近相同,但临床症状的严重程度及远期功能恢复却不尽相同。这提示,某些遗传因素可能在脑组织的可塑性上起了重要作用。
研究[3]发现,无论短暂性还是持续性脑缺血,都会诱导内源性脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达增加,这可能是机体的一种内源性自我保护机制。BDNF是中枢神经系统中广泛分布的一种蛋白质,对神经元的存活、分化、生长均起重要作用,是维持中枢及周围神经系统神经元生存和正常生理功能所必需。BDNF功能编码区内的G196A位点突变可能影响BDNF蛋白在细胞内的加工及分泌过程,进而影响脑的结构和功能-[4-5]。最近的研究显示,BDNF多态性与动脉瘤性蛛网膜下腔出血患者及外伤性脑损伤患者的预后相关[6-7],还可能与可逆性脑血管收缩综合征(RCVS)患者的神经功能缺损程度相关[8]。然而,目前有关BDNF多态性与卒中远期预后的相关性研究却极少。本研究用病例对照的方法, 采用聚合酶链式反应-连接酶检测反应(polymerase chain reaction-ligase detection reaction,PCR-LDR)技术探讨汉族人群中BDNF基因G196A位点的多态性与IS的急性期神经功能缺损严重程度及90天预后之间的相关性,以期为IS的急性及慢性期的治疗提供科学依据。
1资料与方法
1.1一般资料2008年9月—2012年5月在上海市闵行区中心医院神经内科住院的急性IS患者494例(IS组),均符合WHO缺血性卒中的诊断标准,均为首次发生卒中或曾经发生卒中但无后遗症的患者,均完成心电图、颈部血管彩超及头颅MRl检查。对照组选自同期的337名健康体检者。两组的年龄及性别差异无统计学意义(P>0.05)。所有研究对象间均无血缘关系,均为汉族。排除标准 :既往有严重心、肝、肾功能不全及其他严重基础疾病;本次卒中前患有运动功能受限的严重身体疾病;合并痴呆、帕金森病、脑肿瘤、癫痫、精神病或有酗酒和药物依赖。
IS组的494例患者按急性卒中Org 10172治疗试验(the Trial of Org 10172 in Acute Stroke Treatment,TOAST)分型分为大动脉粥样硬化性卒中(large-artery atherosclerosis,LAA)、心源性脑栓塞(cardioembolism,CE)、小动脉闭塞性卒中(small-artery occlusion Lacunar,SAO)或腔隙性卒中(SAA)、其他原因所致的IS(acute stroke of other determined etiology,SOE)、不明原因的IS(stroke of other undeterminedetiology,SUE)。
1.2神经功能缺损程度以及日常生活能力评定
1.2.1神经功能缺损程度评定在患者入院当天,由两名经过培训的神经内科医师根据NIHSS[9]评分标准对神经功能缺损程度进行评分,≥7分为严重 ,≤6分为轻型。
1.2.2日常生活能力评定 由于卒中后3个月时神经元的修复达高峰,故对患者进行90 d的回访。由两名经过培训的神经内科医师依据改良Rankin评分标准(modified Rankin Scale,mRS)[10]评定患者的日常生活能力。0~1分为良好,表明无或仅有轻微残疾,但不影响日常生活;≥2分为差,表明影响日常生活能力。
1.3实验方法
1.3.1标本采集所有被检者禁食 12~14 h,晨起测血压并采空腹静脉血5 mL。在采集后1 h内离心,分离血细胞。
1.3.2基因组DNA的提取及PCR取血细胞200 μL,严格按UNIQ-10柱式临床样品基因组抽提试剂盒(上海生工生物工程股份有限公司)说明书提取基因组DNA。PCR引物由上海博尚生物技术有限公司合成,上游引物: 5′ACTCTGGAGAGCGTGAATGGG 3′,下游引物: 5′AGAAGAGGAGGCTCCAAAGG 3′。BDNF基因PCR扩增体系为20 μL,其中DNA 1 μL,10×buffer 2 μL,MgCl2(3 mM) 0.6 μL,dNTP (2 mM) 2 μL,Primer F(10 pmoL/μL) 0.2 μL,Primer R(10 pmoL/μL) 0.2 μL,Taq酶(1 U/μL) 0.3 μL,H2O补至20 μL。反应条件为:95℃预变性;94℃变性30 s,56℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。反应结束后,取 2 μL反应产物,用3.0%琼脂糖凝胶进行电泳,观察PCR 是否成功(图 1),将剩余PCR产物保存于-20℃。
1.3.3LDR设计分别用于识别两种不同碱基的左端探针和带荧光的右端共用探针,其终产物的长度差别即为左端探针的差别,探针序列见表1。

图1 PCR 电泳图
LDR的反应体系: PCR产物(100 ng/μL)1 μL,10×Buffer 1 μL,连接酶2U,探针(12.5 pmoL/μL) 1 μL,补H2O至10 μL。
LDR反应条件:95℃反应2 min,94℃反应15 s,
50℃反应25 s,循环30次。
取LDR连接液1~2 μL,加入10 μL Hidi、0.1 μL Liz500,充分混匀并置于PCR仪中,98℃变性5 min后立即将96孔板置于冰水混合物上冷却,并用3730序列分析仪( 美国 ABI 公司)进行检测。在含5 moL/L尿素的5%聚丙烯酰胺凝胶中进行毛细管电泳(电压为3000 V),电泳2.5 h。采用Gene ScanTM672软件收集数据、测量迁移片段大小、校正泳道线和内在分子量标准。采用Genemapper软件进行数据分析,分析各SNP位点的基因分型。随机选取BDNF基因G196A位点的野生型、杂合子、突变纯合子PCR产物各2例,用上海生工生物工程股份有限公司合成的引物直接测序验证。

表1 LDR探针序列

2结果
2.1IS组和对照组的一般资料比较IS组和对照组的一般资料比较见表2。IS组494例患者的年龄为40~85岁,平均年龄(69.75±11.32)岁;其中男性283例,女性211例。对照组共337例,年龄40~85岁,平均年龄(69.75±11.32)岁;其中男性186例,女性151例。两组在年龄(P=0.303)和性别(P=0.550)方面的差异无统计学意义。常见的卒中危险因素中,IS组包括高血压374例(75.7%)、糖尿病68例(34.0%)、高胆固醇血症164例(33.2%),吸烟202例(40.9%);对照组包括高血压205例(60.8%)、糖尿病56例(16.6%)、高胆固醇血症80例(23.7%)、吸烟91例(27.0%)。IS组中以上各危险因素的比例均明显高于对照组。进一步对IS组患者进行TOAST分型:LAA患者200例,其中男性109例、女性91例,平均年龄(70.03±10.72)岁;SAO患者165例,其中男性101例、女性64例,平均年龄(68.39±10.78)岁;CE患者82例,其中男性42例、女性40例,平均年龄(70.99±13.09)岁。TOAST分型各亚型患者与对照组相比,在年龄、性别方面差异无统计学意义(P>0.05)。
2.2G196A位点的基因分型采用Genemapper软件分析STR(short tandem repeat)数据,G196A位点的3种基因型GG、AG和AA的分型截图见图2。
2.3SNP位点的PCR引物序列及测序图用引物对各SNP位点的PCR产物进行序列分析验证,结果见图3。
2.4IS组与对照组BDNF基因G196A位点的基因型比较IS组的BDNF基因G196A位点AA基因型频率高于对照组,AA基因型人群较GG基因型人群发生IS的相对风险度为1.541[P=0.021,比值比(OR)=1.541,95%可信区间(95%CI):1.034~2.298)]。AA基因型人群较GG+GA基因型人群发生IS的相对风险度为1.409(P=0.026,OR=1.409, 95%CI:1.008~1.970)。见表3。
2.5IS组BDNF基因G196A位点的基因型与神经功能缺损严重度的关联在入院当天依据NIHSS评分标准对IS组患者的神经功能缺损程度进行评分,轻型382例,重型112例。BDNF基因G196位点的A基因型频率和等位基因频率分布在轻、重型患者间差异无统计学意义(P>0.05),见表4。
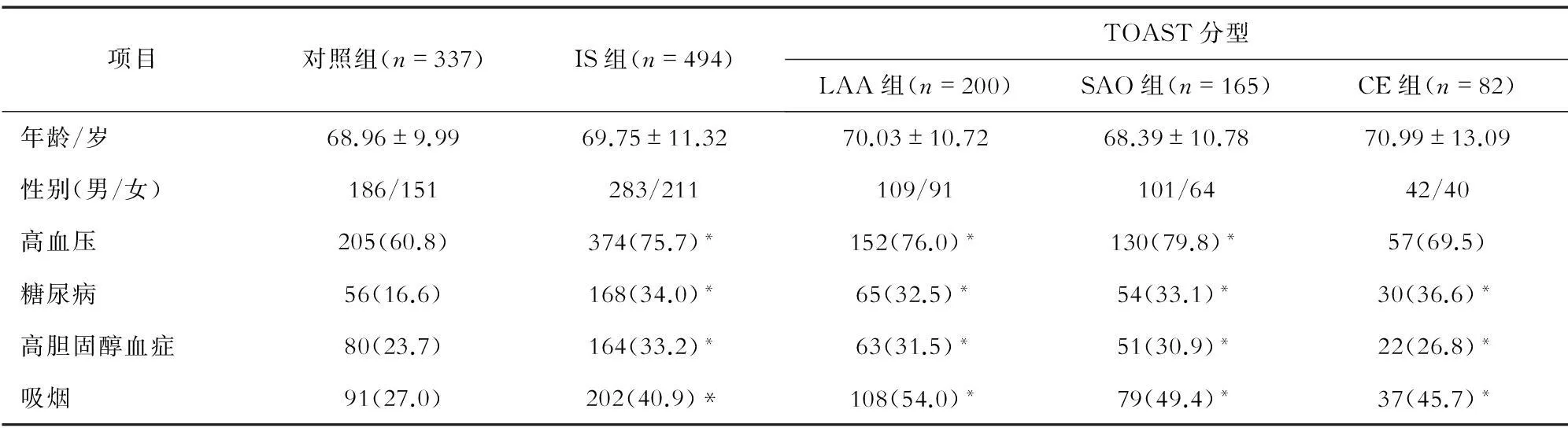
表2 IS组和对照组的一般资料比较 (n,%)
注:与对照组比较,*P<0.05

图2 G196A位点的基因型GG、AG和AA型

图3 PCR产物的序列验证
2.6IS组BDNF基因G196A位点的基因型与90 d预后的关联对知情同意参加随访研究的308例脑梗死患者进行90 d随访,依据mRS评分标准进行日常生活能力评分。0~1分为转归良好 (n=193), 2分及以上为预后差(n=115)。结果显示,BDNF基因G196A位点AA基因型患者较GG基因型患者发生预后不良的相对风险度为1.406(P=0.008,OR=1.406,95%CI:1.203~1.813)。BDNF基因G196A位点GA基因型患者较GG基因型患者发生预后不良的相对风险度为1.546(P=0.034,OR=1.546,95%CI:1.296~2.000)。AA+GA基因型患者较GG基因型患者发生预后不良的相对风险度为2.014(P=0.011,OR=2.014,95%CI:1.124~3.607)。见表5。
2.7IS患者90天预后的多因素分析采用二分类反应变量的回归模型(SPSS 19.0软件包Logistic回归模型)分析年龄(75岁分界)、性别、糖尿病、高血压、高脂血症、吸烟史等危险因素,计算各自的OR值及其95%CI,同时筛选出独立危险因素。结果显示,除高龄是IS患者90天预后不良的独立危险因素外,BDNF基因G196A位点的A等位基因也是IS患者90天预后不佳的独立危险因素(P=0.012,OR=2.134, 95%CI:1.178~3.866),携带A等位基因的IS患者较携带G等位基因的IS患者不良预后的相对风险度为2.134。见表6。

表3 IS组与对照组BDNF基因G196A位点基因型频率的比较 (n,%)
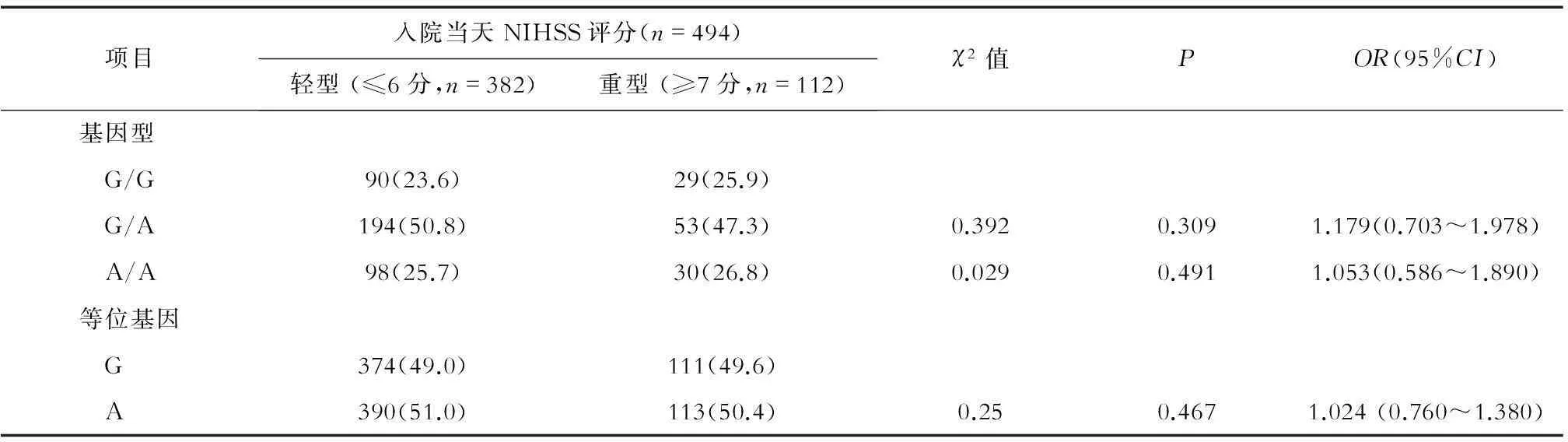
表4 IS组BDNF基因G196A位点基因型频率与神经功能缺损严重度的关联 (n,%)
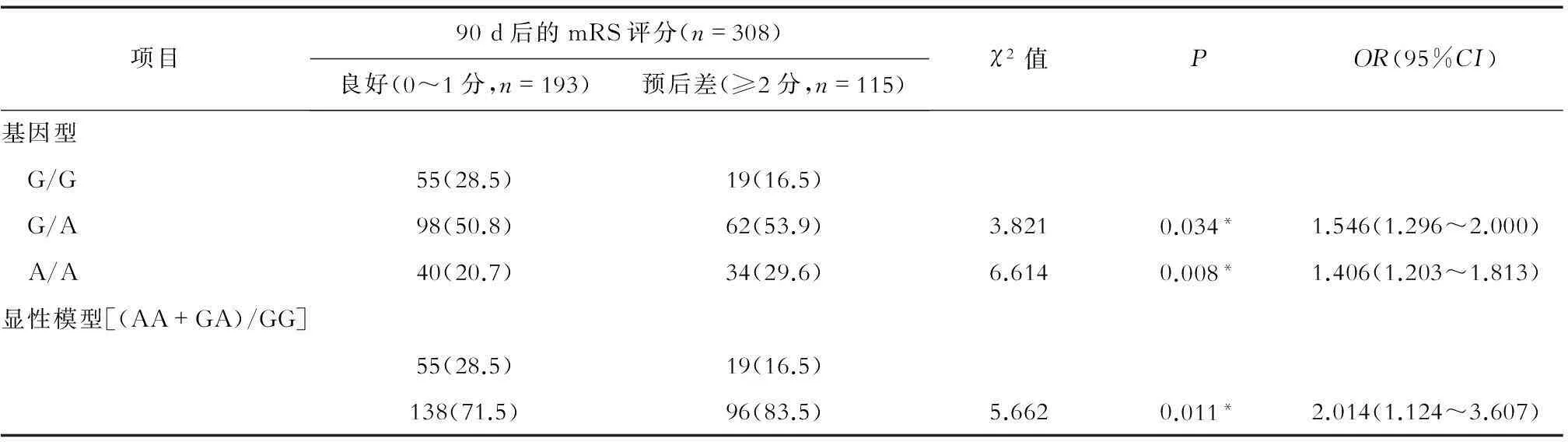
表 5 BDNF基因G196A位点基因型频率与缺血性卒中90天预后的关联 (n,%)
注:*P<0.05

表 6 BDNF基因G196A位点基因型与缺血性卒中90天预后的Logistic回归校正结果
注:*P<0.05
4讨论
目前,IS的治疗效果仍不尽人意。如何预防及减少卒中后的残疾率已成为普遍关注的问题。遗传变异可能影响个体对于卒中后治疗模式的反应。
BDNF是脑发育过程中最丰富的神经营养因子,它在调控神经元的存活、增强突触传递以及促进神经可塑性方面起着至关重要的作用[11]。BDNF能刺激胞体发出突起并使突起延伸,刺激轴突和树突出芽,还可以使神经递质经胞体顺行运输至轴突末端、释放并被次级神经元摄取和利用,增强突触间递质的释放和信号传递,参与突触可塑性。因此,BDNF是在神经元受到损伤和发生病变时促使其存活和再生的必需因子[12]。
本研究采用PCR-LDR方法分析了494例IS患者和337例健康对照者中BDNF 基因G196A位点的基因多态性。结果发现,IS组BDNF基因G196A位点AA基因型的频率高于对照组,AA基因型人群发生IS的风险是GG基因型人群的1.541倍 (P=0.021,OR=1.541,95%CI:1.034~2.298)。我们还对患者入院当天的神经功能缺损程度与基因型进行关联分析,结果未见显著差异(P=0.800)。出院后90 d的随访显示,BDNF基因G196A位点AA+GA基因型患者发生预后不良的风险是GG基因型患者的2.014倍;采用Logistic回归方法对其他可能影响IS患者预后的危险因素(年龄、高血压、糖尿病、吸烟)进行校正后,这种相关性仍然存在 (P=0.012,OR=2.134,95%CI:1.178~3.866);提示 BDNF基因G196A位点的A等位基因是预测IS预后不良的独立生物学指标。
BDNF分子单体共有119个氨基酸残基,是由β折叠和无规则卷曲二级结构组成的碱性蛋白质,等电点为9.99,相对分子质量为3.5103。有证据显示, BDNF等位基因变异小鼠在卒中后,其运动功能受损和血管生成减少更为明显[13]。Barbey等[14]发现,BDNF基因vaL66met多态性与老年脑血管病的认知功能无关,但与外伤性脑损伤后认知功能改变有关。临床研究[15]发现,BDNF 基因VaL66Met多态性与未破裂脑动脉畸形的预后有关,但是不影响外伤后植物状态的预后[16]。 目前,关于BDNF基因vaL66met多态性与卒中预后的关联仍不确定,且尚少见对卒中慢性阶段的IS患者的功能恢复与BDNF基因 vaL66met多态性的相关性分析[17]。有研究[18]发现,BDNF 基因C270T位点的多态性与卒中亚型有关;BDNF基因 G196A位点可能与出血性卒中的早期神经功能缺损程度有关,而与30 d预后无关;但这种基因型效应并不存在于并发脑梗死的病例中。对韩国人群的研究[19]发现,BDNF基因 G196A位点的多态性与卒中的早期神经功能缺损程度以及90天预后相关。我们的部分结果与韩国人群的结果一致,但与西方人群中的研究结果不一致,后者认为BDNFG196A位点 A等位基因与IS的预后无关[20],这种差异可能与病例数、人种、遗传素质、饮食习惯、地理环境、人的生长状态以及检测方法等有关。
据我们检索文献得知,本研究是对中国汉族人群BDNF 基因G196A位点多态性和IS预后之间的关系的首次报道。但需要特别注意的是,卒中是一种由遗传和环境等多种因素共同引发的疾病,众多复杂因素的累积与叠加抑或抵消与减弱,均可能对卒中的发生以及预后产生不同程度的影响。本研究也有一些局限性,例如样本量小,病例来自局部地区,随访时间不够长。今后拟扩大样本量开展多中心、多区域合作并进行长期随访,以期得出更有说服力的结论。
致谢:本研究项目获得上海市闵行区人才发展专项资金资助。
参考文献
[1]Tunstall-Pedoe H, Kuulasmaa K, Amouyel P, et al. Myocardial infarction and coronary deaths in the World Health Organization MONICA Project. Registration procedures, event rates, and case-fatality rates in 38 populations from 21 countries in four continents[J]. Circulation, 1994, 90(1): 583-612.
[2]Liu L, Wang D, Wong KS, et al. Stroke and stroke care in China: huge burden, significant workload, and a national priority[J]. Stroke, 2011, 42(12): 3651-3654.
[3]Greenberg ME, Xu B, Lu B, et al. New insights in the biology of BDNF synthesis and release: implications in CNS function[J]. J Neurosci, 2009, 29(41): 12764-12767.
[4]Chen ZY, Ieraci A, Teng H, et al. Sortilin controls intracellular sorting of brain-derived neurotrophic factor to the regulated secretory pathway[J]. J Neurosci, 2005, 25(26): 6156-6166.
[5]Cirillo J, Hughes J, Ridding M, et al. Differential modulation of motor cortex excitability in BDNF Met allele carriers following experimentally induced and use-dependent plasticity[J]. Eur J Neurosci, 2012, 36(5): 2640-2649.
[6]Siironen J, Juvela S, Kanarek K, et al. The Met allele of the BDNF VaL66Met polymorphism predicts poor outcome among survivors of aneurysmal subarachnoid hemorrhage[J]. Stroke, 2007, 38(10): 2858-2860.
[7]Rostami E, Krueger F, Plantman S, et al. Alteration in BDNF and its receptors, full-length and truncated TrkB and p75(NTR) following penetrating traumatic brain injury[J]. Brain Res, 2014, 1542: 195-205.
[8]Chen SP, Fuh Jl, Wang SJ, et al. Brain-derived neurotrophic factor gene Val66Met polymorphism modulates reversible cerebral vasoconstriction syndromes[J]. PLoS One, 2011, 6(3): e18024.
[9]Meyer BC, Hemmen TM, Jackson CM, et al. Modified National Institutes of Health Stroke Scale for use in stroke clinical trials: prospective reliability and validity[J]. Stroke, 2002, 33(5): 1261-1266.
[10]Quinn TJ, Dawson J, Walters MR, et al. Reliability of the modified Rankin Scale[J]. Stroke, 2007, 38(11): e144; author reply e145.
[11]Schinder AF, Berninger B, Poo M. Postsynaptic target specificity of neurotrophin-induced presynaptic potentiation[J]. Neuron, 2000, 25(1): 151-163.
[12]Pearson-Fuhrhop KM, Cramer SC. Genetic influences on neural plasticity[J]. PM R, 2010, 2(12 Suppl 2): S227-40.
[13]Qin L, Kim E, Ratan R, et al. Genetic variant of BDNF (Val66Met) polymorphism attenuates stroke-induced angiogenic responses by enhancing anti-angiogenic mediator CD36 expression[J]. J Neurosci, 2011, 31(2): 775-783.
[14]Barbey AK, Colom R, Paul E, et al. Preservation of General Intelligence following Traumatic Brain Injury: Contributions of the Met66 Brain-Derived Neurotrophic Factor[J]. PLoS One, 2014, 9(2): e88733.
[15]Westbroek EM, Pawlikowska L, Lawton MT, et al. Brain-derived neurotrophic factor Val66Met polymorphism predicts worse functional outcome after surgery in patients with unruptured brain arteriovenous malformation[J]. Stroke, 2012, 43(8): 2255-2257.
[16]Bagnato S, Minafra L, Bravata V, et al. Brain-derived neurotrophic factor (Val66Met) polymorphism does not influence recovery from a post-traumatic vegetative state: a blinded retrospective multi-centric study[J]. J Neurotrauma, 2012, 29(11): 2050-2059.
[17]Mirowska-Guzel D, Gromadzka G, Czlonkowski A, et al. BDNF -270 C>T polymorphisms might be associated with stroke type and BDNF -196 G>A corresponds to early neurological deficit in hemorrhagic stroke[J]. J Neuroimmunol, 2012, 249(1-2): 71-75.
[18]Kim JM, Stewart R, Park MS, et al. Associations of BDNF genotype and promoter methylation with acute and long-term stroke outcomes in an East Asian cohort[J]. PLoS One, 2012, 7(12): e51280.
[19]Kim JM, Stewart R, Park MS, et al. Associations of BDNF genotype and promoter methylation with acute and long-term stroke outcomes in an East asian cohort[J]. PLoS One,7:e51280.
[20]Cramer SC, Procaccio V, Americas G, et al. Correlation between genetic polymorphisms and stroke recovery: analysis of the GAIN Americas and GAIN International Studies[J]. Eur J Neurol, 2012, 19(5): 718-724.
Study of Correlation between Genetic Polymorphism of Brain-Derived Neurotrophic Factor and 90-day Outcome of Ischemic Stroke in Chinese Han Population
ZHAOJingWUHuiWENGYingfengDepartmentofNeurology,MinhangDistrictCentralHospital,Shanghai201100,China
AbstractObjective:To investigate the correlation between single nucleotide polymorphism(SNP) of BDNF gene and ischemic stroke(IS). Methods:The SNP of BDNF gene G196A in 494 patients with IS(IS group) and 337 healthy controls(control group) was detected by polymerase chain reaction-ligase detection reaction (PCR-LDR) assay, and the allele frequency was calculated. The degree of neural function defect in IS group was assessed at the admission day with the National Institutes of Health Stroke Severity Scale (NIHSS). On post-infarction 3-month follow-up, the neural function recovery of patients was assessed with the modified Rankin Scale (mRS). Results: The frequency of genotype AA at BDNF gene G196A in IS group was higher than that in control group, and the difference was statistically significant(P<0.05). There was no significant difference with regard to the genotype at BDNF gene G196A and the allele frequency between the mild patients and the severe patients(P=0.800).According to the outcomes on post-discharge 90-day follow-up, the relative risk of poor outcome in patients with genotype AA at BDNF gene G196A to that in patients with genotype GG at BDNF gene G196A was 0.046 (P=0.008,OR=0.406,95%CI:203-0.813). After the other risk factors had been adjusted with logistic regression method, the correlation was still significant(P=0.012,OR=2.134,95%CI: 1.178-3.866). Conclusions: Perhaps there was no association between the polymorphism of BDNF gene G196A and the severity of neural function defect during acute phase of IS in Chinese Han population. The presence of genotype GA+AA at BDNF gene G196A was associated with much poorer outcome in patients with IS. Allele A might be the independent bioindicator of poor outcome of IS in Chinese Han population.
Key WordsBrain-derived neurotrophic factor;Single nucleotide polymorphism;Ischemic stroke;Outcome
基金项目:上海市卫生和计划生育委员会2012年基金项目(编号:20124266)
中图分类号R 743
文献标识码A

