Fe3O4-还原石墨烯复合材料的制备及对Pb 离子吸附性能的研究*
江 华,杨洁晨,布和巴特尔
(黑龙江工程学院材料与化学工程学院,黑龙江哈尔滨150050)
地表和地下水资源因为受到日益严重污染而带来了严峻的环境问题[1]。怎样有效的除去这些有机和无机污染物已成为全世界研究的重点,其中研究重金属污染的去除工作尤为重要。虽然这些重金属污染对野生动植物及人类的长期影响仍未知,但实际上,水环境中的高浓度重金属离子对人类健康有很大威胁,可以带来肾脏损伤、各种骨病、胃肠病、肾功能紊乱甚至诱发癌症等[2-4]。目前,我国由于对铅酸电池的使用不当和为了汽油防爆而加入其中做抗爆剂的四乙基铅在燃烧过程中产生的含铅尾气直接排入大气和水体造成污染。青少年摄入体内的铅中的50%可以被身体直接吸收,因而,铅中毒对青少年的影响更为严重。Pb2+一但通过肠胃摄入体内,就会在各种重要器官,如肾脏、肝脏、大脑等部位沉积[5]。
为了应对这些挑战,人们尝试用各种各样的方法来解决这些问题,其中应用最为广泛是制备功能化Fe3O4纳米粒子来从废水中提取Pb(II)等重金属离子[6-8]。但由于Fe3O4粒子稳定性较差(对氧敏感,在氧存在下易于氧化变成Y-Fe2O3),所以不适于在处理含铅污水中长期使用。如果能将Fe3O4纳米粒子与稳定性好的还原石墨烯复合,提高其稳定性,不但能用于处理含污水中重金属离子,在而且能够循环使用[9]。
本文中我们采取简单、低成本的共沉淀法制备了Fe3O4纳米粒子并使其生长在石墨烯表面,得到了Fe3O4-还原石墨烯(RGO)复合材料,并测试了对水中Pb2+的吸附能力,结果表明,制备的Fe3O4-RGO复合材料具有良好吸附性能,并可以重复利用。
1 实验部分
1.1 原材料
NH3·H2O(28%)、FeCl3·6H2O(A.R.)、FeSO4·7H2O(A.R.)、蒸馏水、H2SO4、KMnO4H6N2、H2O、HCl均来自天津科密欧化学试剂开发中心;石墨粉。
1.2 Fe3O4-还原石墨烯复合材料
采用修正的Hummers 法制备石墨烯[10],将其分散到水溶液中,称取0.2g FeCl3·6H2O 和0.05g FeSO4·7H2O 放入200mL 的烧杯中,用50mL 蒸馏水溶解,快速搅拌条件下将NH3·H2O(28%)50mL 迅速倒入烧杯中。搅拌10min 后迅速升温到90℃后继续保温搅拌60min,冷却至室温。用磁铁进行分离,用水清洗5 次后在200℃烘箱中干燥60min。得到Fe3O4-RGO 复合材料。
1.3 吸附Pb2+实验
用Pb(NO3)2配置含Pb(Ⅱ)溶液,浓度为10 mg·L-1。取10mL Cr(VI)溶液,加入Fe3O4-还原石墨烯复合材料(溶度为0.5g·L-1)。室温下搅拌24h,磁分离后检测上层清液中Pb(Ⅱ)的浓度。利用qe(mg·g-1)=(C0-Ce)V·m-1计算平衡时样品的吸附容量。
式中 C0和Ce分别代表溶液中Pb(Ⅱ)的初始浓度和平衡浓度,mg·L-1;V:溶液的体积,L;m:吸附剂的质量,mg。
1.3 样品表征
利用日本电子公司JEOL JEM-2100 透射电镜分析样品的形貌和尺寸。利用Bruker D8 型X 射线衍射仪测试样品的晶型。用LakeShore 7403 振动样品磁强计(VSM)测试样品的磁性。原子吸收光谱仪(PE Optima 2100DV ICP-AES)检测水溶液中铅离子浓度。
2 结果分析
2.1 Fe3O4-还原石墨烯复合材料XRD 分析
Fe3O4-还原石墨烯复合材料进行了XRD 分析,其XRD 见图1。
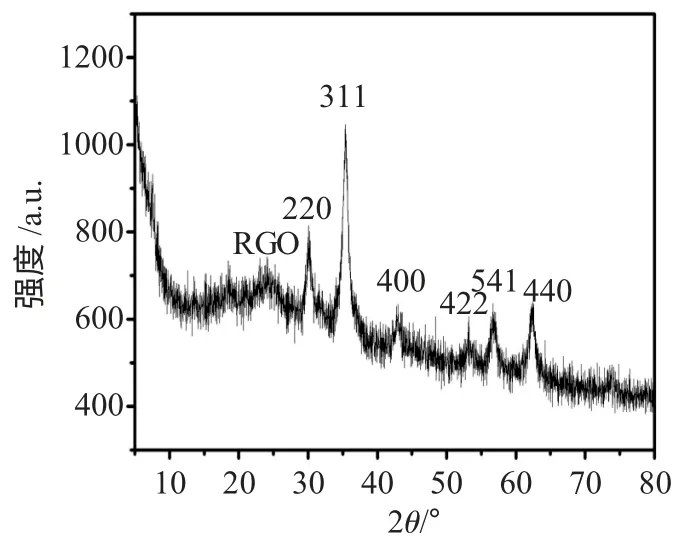
图1 Fe3O4-RGO 磁粉XRD 衍射图Fig.1 X-ray diffraction of Fe3O4-RGO magnetic particles
Fe3O4磁粉的XRD 衍射峰均与Fe3O4粉末XRD标准谱图(JCPDS,No.74-0748)一致。利于谢乐公式通过对311 晶面半峰宽进行计算得出,Fe3O4磁粉粒径大约是10nm。图1 中2θ 位于30.10,35.40,43.10,53.50,57.20,62.60 处的衍射峰,分别对应于Fe3O4晶体的(220),(311),(400),(422),(511)和(440)晶面,说明制备的产物确实为Fe3O4,且为反尖晶石型结构。该曲线的XRD 特征衍射峰明显,且没有杂质峰,说明该Fe3O4纯度很高。2θ 位于25 处有明显的衍射峰。与Fe3O4晶体的晶面无法对应,应该是石墨的衍射封,2θ 位于9 出没有明显的衍射封,证明通过还原是氧化石墨上面的各种集团已经全部还原。
2.2 Fe3O4-还原石墨烯复合材料TEM 分析
磁粉表面没有表面活性剂或电荷的修饰时,高活性的纳米颗粒之间易于互相吸引而发生团聚。即使通过长期搅拌或超声也无法将团聚的磁粉再重新分散开,因而必须进行表面修饰。否则无法得到分散性较好的Fe3O4磁粉。为了提高Fe3O4磁粉的稳定性和分散性,将Fe3O4均匀生长在了石墨烯表面。
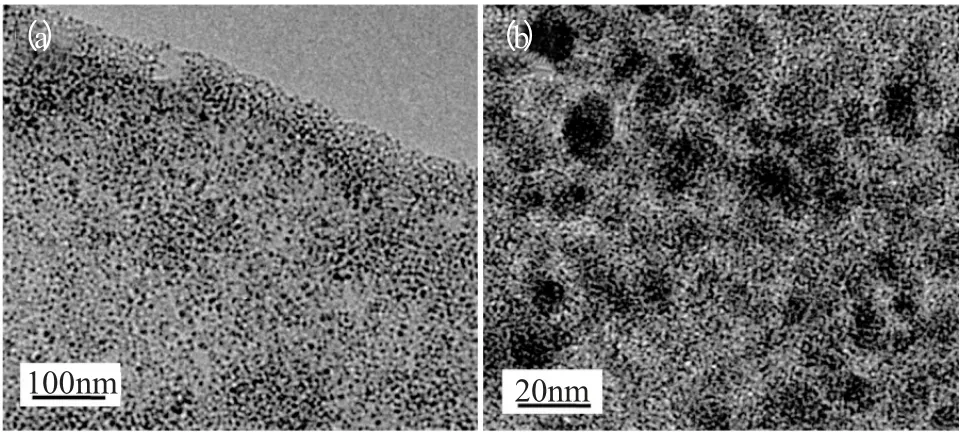
图2 Fe3O4-RGO 粒子的透射电镜图Fig.2 TEM images of Fe3O4-RGO magnetic particles
通过TEM分析,从图2a 可以看出,Fe3O4磁粉几乎全部生长在了石墨烯表面,而且分散很均匀。从图2b 中还可以看出,该磁粉的形状是类似球形的;由于使用的是共沉淀方法,因此,粒径分布非常广,在7~13nm 之间,平均粒径在10nm 左右,这与XRD 得到的平均粒径(10nm)吻合。
2.3 Fe3O4-还原石墨烯复合材料磁性分析
常用的磁分离技术中人们最多使用尖晶石型铁氧体材料。其中Fe3O4因为具有制备简单、廉价、有较强的磁性等特性而成为最常用的磁性材料。Fe3O4块体的是典型的亚铁磁性体,其比饱和磁化强度为94emu·g-1。但是随着粒径的减小,其磁性也产生变化。特别是粒径小于20nm 时的Fe3O4粒子的剩磁和矫顽力接近零,表现出超顺磁性,这也是Fe3O4纳米磁粉被广泛应用的主要原因之一。图3 为制备的Fe3O4-RGO 复合材料在温度为300K、磁场强度为20kOe 条件下测得的磁滞回线。
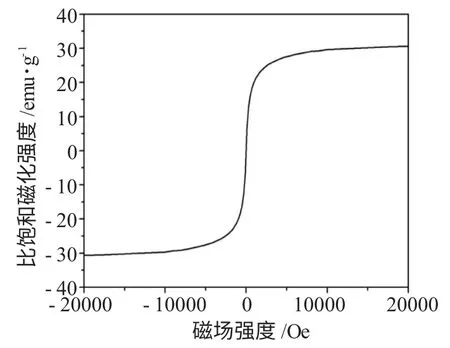
图3 Fe3O4-RGO 磁粉的磁化曲线Fig.3 Magnetic hysteresis curves of Fe3O4-RGO magnetic particles
从图3 可以看出,Fe3O4的磁粉比饱和磁化强强度比较大,20kOe 磁场条件下达到了31.5emu·g-1;Fe3O4磁粉的矫顽力和剩磁均为零,表现出很好的超顺磁性,因此长期在磁场条件下工作都不产生团聚等现象,有利于重复使用。
2.4 Fe3O4-还原石墨烯复合材料吸附Pb(II)离子的效果分析
为研究制备的Fe3O4-RGO 对Pb(II)离子的吸附效果,我们测试了不同接触时间对吸附性的影响和最大吸附量。为对吸附性能进行评价,采用未和石墨烯复合的纯Fe3O4做了比较试验。见图4。
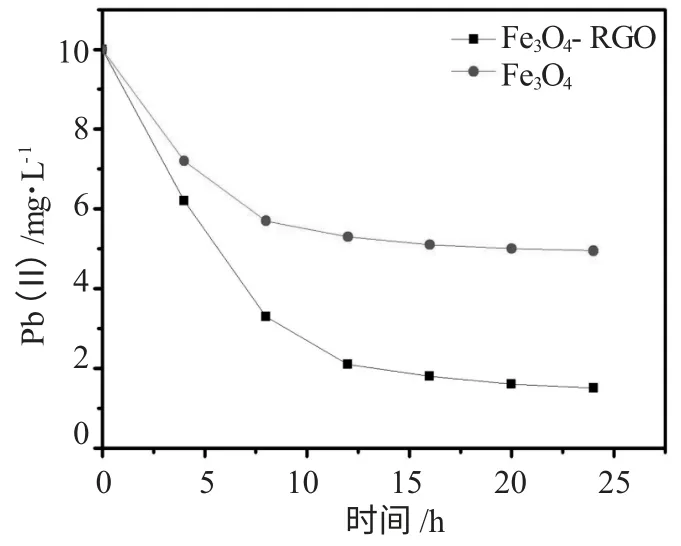
图4 Fe3O4 磁粉和Fe3O4-RGO 的Pb(II)吸附曲线Fig.4 Pb(II)adsorption curves of Fe3O4 magnetic particles and Fe3O4-RGO
图4 是相同条件下Fe3O4-RGO 和纯Fe3O4在水分散液中吸附铅离子的效果曲线图。测试了不同时间的吸附效果。从测试的24h 吸附结果中可以发现,Fe3O4-RGO 水溶液吸附效果最好,接近90%的Pb(II)从溶液中分离出来;纯Fe3O4水溶液吸附效果比较差,只有50%左右的Pb(II)从溶液中分离出来。这可能是因为纳米磁粉和RGO 复合后,磁粉得到了均匀的分,而且复合的RGO 也吸附了一定量的Pb(II)离子,因此吸附能力明显高于纯Fe3O4。
为了进一步了解Fe3O4-RGO 对Pb2+的吸附性能,对其的吸附效率进行了测试,为了更好的对Fe3O4-RGO 吸附性能进行评价,我们采用未和石墨烯复合的纯Fe3O4做了比较试验。结果见图5。
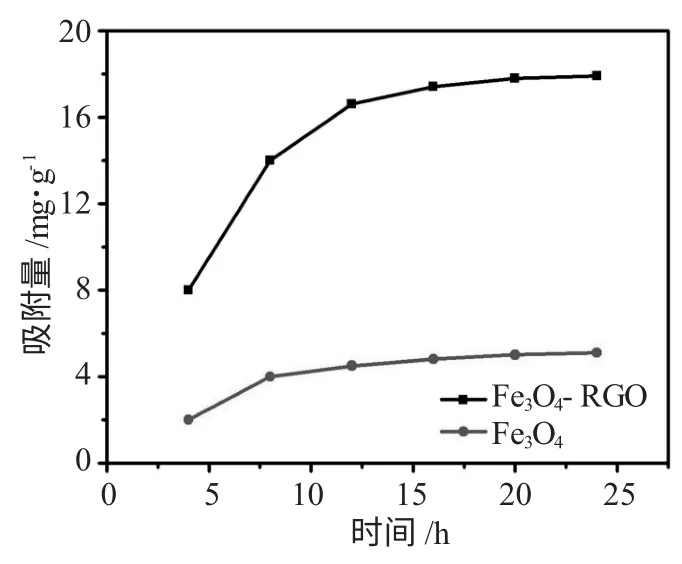
图5 Fe3O4 磁粉和Fe3O4-RGO 的Pb(II)吸附效率曲线Fig.5 Pb(II)adsorption isotherms in different contact time on Fe3O4 magnetic particles and Fe3O4-RGO
由图5 可知,两种材料的24h 候的吸附量有很大的差距。Fe3O4-RGO 水溶液吸附能力很强,吸附量达到了17.8mg·g-1;纯Fe3O4水溶液吸附能力比较差,吸附量为13.2mg·g-1,从溶液中分离出来Pb(II)量比较小。因此可以证明,Fe3O4和RGO 复合后大大提高了其吸附Pb(II)的能力。均匀分散在RGO表面的Fe3O4因为不会发生团聚而使接触Pb(II)的面积增大,而且RGO 也起到了吸附Pb(II)的作用。因此复合后的材料对Pb(II)吸附能力远远高于纯Fe3O4的吸附能力。
3 总结
用简单的共沉淀方法制备了粒径10nm 的超顺磁性Fe3O4纳米磁粉,并均匀的负载在氧化石墨烯表面。通过高温还原得到了Fe3O4-RGO 复合材料,通过测试吸附水中的Pb(II)粒子实验发现Fe3O4-RGO 复合材料有很强的吸附能力,比为未复合的Fe3O4效率高。吸附量达到了17.8 mg·g-1。此外,Fe3O4-RGO 复合材料比饱和磁化强强度在20kOe磁场条件下达到了31.5emu·g-1,并且矫顽力和剩磁均为零,表现出很好的超顺磁性,长期在磁场条件下工作都不产生团聚,有利于重复使用。
[1]Liu W.J,Tian K,Jiang H.,Zhang X.S,Ding H.S,Yu H.Q.Selectively Improving the Bio-Oil Quality by Catalytic Fast Pyrolysis of Heavy-Metal-Polluted Biomass:Take Copper(Cu)as an Example[J].Environ.Sci.Technol.,2012,46:7849-7856.
[2]Battistoni P,Cola E,Fatone F,Bolzonella D,Eusebi A.L,Micropollutants Removal and Operating Strategies in Ultrafiltration Membrane Systems for Municipal Wastewater Treatment:Preliminary Results[J].Ind.Eng.Chem.Res.,2007,46:6716-6723.
[3]Huang Z. H,Zheng X,Lv W,Wang M,Yang Q-H,Kang F. Adsorption of Lead(II)Ions from Aqueous Solution on Low-Temperature Exfoliated Graphene Nanosheets[J].Langmuir,2011,27:7558-7562.
[4]Gao,W.;Majumder,M.;Alemany,L. B.;Narayanan,T. N.;Ibarra,M. A.; Pradhan,B. K.; Ajayan,P. M. Engineered Graphite Oxide Materials for Application in Water Purification[J].ACS Appl.Mater.Interfaces 2011,(3):1821-1826.
[5]李冠杰,重金属污染条件下基层环境监管体制研究[D].博士学位论文:西北农林科技大学,西安,2012,19-20.
[6]Takafuji M,Ide S,Ihara H,Xu Z. H. Preparation of Poly(1-vinylimidazole)-Grafted Magnetic Nanoparticles and Their Application for Removal of Metal Ions[J].Chem.Mater.,2004,16:1977-1983.
[7]Hai B,Wu J,Chen X. F,Protasiewicz J. D,Scherson D. A,Metal-Ion Adsorption on Carboxyl-Bearing Self-Assembled Monolayers CovalentlyBound toMagnetic Nanoparticles[J].Langmuir,2005,21:3104-3105.
[8]Wu J,Sun J,Stefan L.C,Scherson D.A,Cadmium Ion Adsorption onCarboxyl-TerminatedIronOxideBeads[J].J.Phys.Chem.B,2004,108:12276-12279.
[9]Chandra V,Park J,Chun Y,Lee J.W,Hwang I-C,Kim K.S.Water-Dispersible Magnetite-Reduced Graphene Oxide Composites for Arsenic Removal[J].ACS Nano,2010,(4):3979-3986.
[10]Stankovicha S,Dikina D. A,Pinera R. D,Kohl-haasa K. A,Kleinhammesc A,Jiac Y. Y,Wuc Y,Nguyen S. T.Synthesis of graphene-based nanosheets via chemical reduction of exfoliated graphite oxide[J].Carbon,2007,45:1558-1565.

