血管紧张素Ⅱ协同LPS诱导巨噬细胞活化和凋亡的研究
李 妍,张宸豪,方 芳,王长文,陈 爽,李 强,赵良中,陈 为
(1.吉林医药学院检验学院,吉林 吉林132013;2.吉林医药学院公共卫生学院,吉林 吉林132013;3.吉林医药学院基础医学院,吉林 吉林132013)
血管紧张素Ⅱ(AngⅡ)是肾素-血管紧张素系统(renin-angiotensin system,RAS)中重要的效应因子,与AngⅡ1型受体(AngⅡtype 1,AT1)结合可促进血管平滑肌收缩,参与血压调节[1]。单核巨噬细胞也表达AT1,在AngⅡ诱导后,其Toll样受体4(Toll like receptor 4,TLR4)表达增加;而TLR4与脂多糖(lipopolysaccharide,LPS)结合可介导巨噬细胞活化信号转导[2]。理论而言,AngⅡ可促进LPS对巨噬细胞的活化,但活化的免疫细胞,往往通过活化诱导的细胞凋亡(Activation induced cell death/apoptosis,AICD)来减少自身的数量[3]。本研究以小鼠巨噬细胞RAW264.7为模型,来深入研究AngⅡ预处理对LPS诱导巨噬细胞活化和凋亡的影响。
1 材料与方法
1.1材料 小鼠巨噬细胞RAW264.7冻存于液氮中。AngⅡ和LPS为Sigma公司产品;JC-1线粒体膜电位(Mitochondrialmembrane potential,MMP)检测试剂盒(产品编号C2006)、ROS荧光探针双氯荧光黄乙酸乙酯(Dichlorofluorescin diacetate,DCFH-DA)和pH值检测探针5-羧基荧光素,二乙酰甲酯(2',7'-bis-(2-carboxyethyl)-5-(and-6)-carboxyfluorescein,acetoxymethylester,BCECFAM),购自上海碧云天生物技术研究所;1640培养液,购自Gibco公司;小牛血清,购自Hyclone公司;Annexin-V-GFP凋亡检测试剂盒,购自南京基凯生物技术有限公司;枣红蛋白(phycoerythrin,PE)标记的抗小鼠TLR4抗体,购自Biolengend公司。
1.2 细胞培养和处理 含10%小牛血清1640培养液、5%CO2、饱和湿度和37℃下培养细胞,每周传代2到3次。接种细胞于培养瓶,加入AngⅡ(0,40,80 μg/mL和160μg/mL)后,培养24 h;AngⅡ(0或80μg/mL)处理细胞8 h后,加入LPS(0和4μg/mL),继续培养16 h。
1.3 TLR4表达分析 取5×105个细胞,悬于100 μL PBS,加入1μg PE标记抗TLR4抗体或阴性对照抗体,4℃下避光反应30min。PBS洗2次后用400μL的PBS重悬细胞,流式细胞仪检测PE荧光强度来代表TLR4表达变化。
1.4 活性氧检测 取5×105个细胞,PBS洗涤2次,100μL PBS重悬细胞,加入DCFH-DA储存液,至其终浓度为5μmol/L,混匀后在37℃避光反应30 min,PBS洗2次,400μL PBS重悬细胞,流式细胞仪分析。
1.5 细胞凋亡分析 取5×105个细胞,用PBS洗涤2次,取195μL结合缓冲液重悬细胞,加入5 μL Annexin-V-GFP工作液,室温下避光反应30 min;结合缓冲液洗涤细胞2次,400μL结合缓冲液重悬细胞,流式细胞仪分析。
1.6 线粒体膜电位分析 取5×105个细胞,按说明书所述方法配制JC-1染色工作液和染色缓冲液(冰沐保存)。用500μL JC-1染色工作液重悬细胞,37℃避光反应30min;离心吸弃上清,染色缓冲液洗涤细胞2次;500μL染色缓冲液重悬细胞,用流式细胞仪FL1通道(525 nm)检测细胞所发射的荧光。
1.7 细胞内pH值分析 取5×105个细胞,重悬于200μL PBS,加入DCFH-DA储存液至终浓度为2 μmol/L,37℃避光反应30min;PBS洗涤细胞2次;500μL染色缓冲液重悬细胞,用流式细胞仪FL1通道(525 nm)检测细胞所发射的荧光。
2 结果
2.1 不同浓度AngⅡ对TLR4表达的影响 AngⅡ诱导24 h后,检测TLR4表达,结果表明,AngⅡ以浓度依赖的方式上调巨噬细胞TLR4表达(图1)。
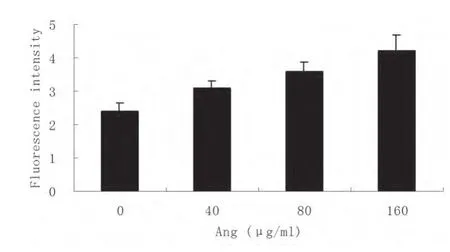
图1 AngⅡ对巨噬细胞TLR4表达的影响
2.2 AngⅡ和LPS对巨噬细胞凋亡的影响 AngⅡ和LPS作用后,Annexin-V-GFP染色后分析细胞凋亡,与LPS单独作用比,AngⅡ预处理组细胞凋亡百分率显著增加(图2)。
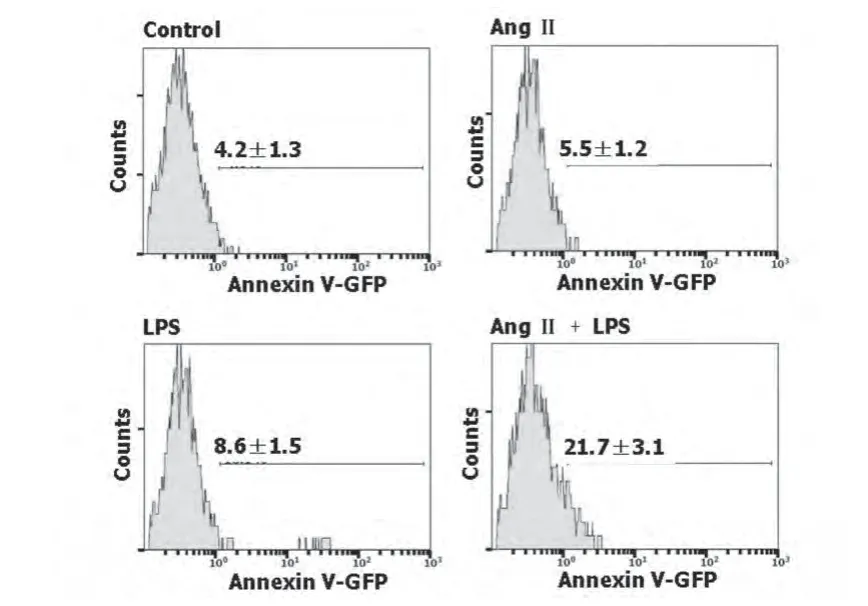
图2 AngⅡ和LPS对巨噬细胞凋亡的影响
JC-1是一种新型荧光探针,进入细胞后,其存在状态和发射荧光与线粒体功能紧密联系。线粒体功能正常时,JC-1主要聚集在线粒体基质,形成聚合物,发射红色荧光;而在MMP较低时,JC-1主要以单体形式存在,发射绿色荧光。与对照组比较,4μg/mL的LPS单独作用后JC-1单体的荧光略下降,反映LPS可活化巨噬细胞并对线粒体功能有一定增强效应;虽然AngⅡ单独作用对MMP影响较小,但与LPS协同作用可导致线粒体功能显著下降(表1)。
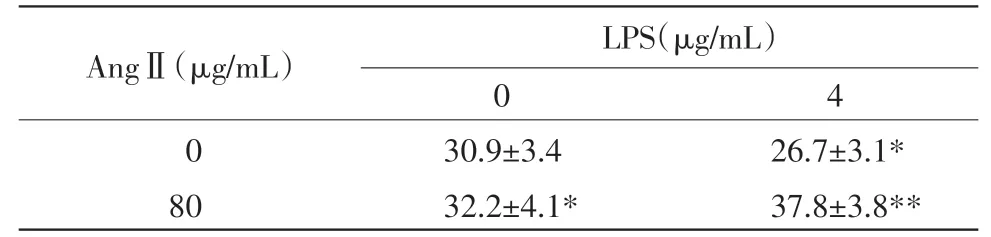
表1 AngⅡ和LPS对巨噬细胞MMP的影响
2.3 AngⅡ和LPS对巨噬细胞ROS的影响 荧光探针DCFH-DA进入细胞后被酯酶水解为DCFH,继而被氧自由基氧化而生成DCF,检测DCF发射荧光的强度值可代表细胞内ROS水平。与LPS单独作用比较,AngⅡ和LPS联合作用,细胞内ROS显著增加(表2)。
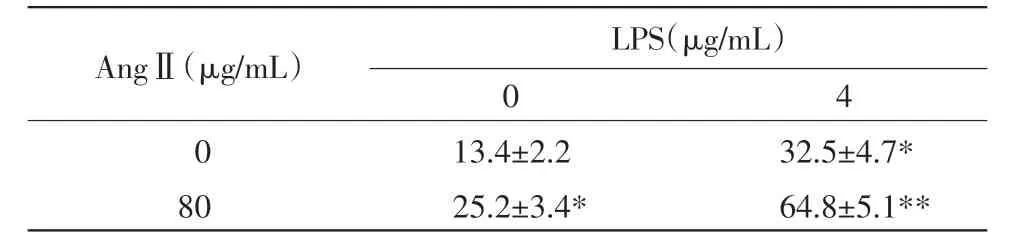
表2 AngⅡ和LPS对巨噬细胞ROS的影响
2.4 AngⅡ和LPS对巨噬细胞内pH值的影响 接近中性时,BECEF可在被激发后发射绿色荧光(530 nm),其荧光强度随pH值升高而增强,荧光强度减弱则指示pH值下降。分析结果表明,与对照组比较,LPS或AngⅡ均可导致巨噬细胞pH值略下降;与LPS单独作用组比,AngⅡ和LPS协同作用组,细胞内pH值显著降低(表3)。
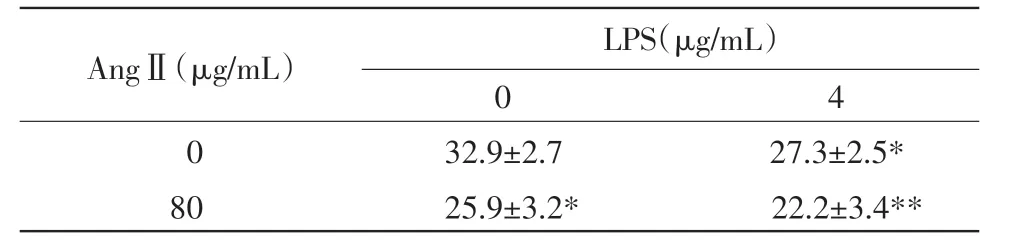
表3 AngⅡ和LPS对巨噬细胞pH值的影响
3 讨论
血管紧张素原在肾素和血管紧张素转化酶(Angiotensin-converting enzyme)的作用下被转换为AngⅡ,RAS通过AngⅡ与其受体AT1结合导致血管平滑肌收缩,调节血压平衡[1]。严重创伤、失血性休克、烧伤等急性应激情况下,AngⅡ主要体现其对机体的保护性作用。有学者报道,上述疾病合并感染,尤其感染革兰阴性菌后,内毒素对血管内皮的损伤作用严重;在创伤和烧伤等情况下,细菌感染还可导致肺损伤并危及生命[4-5]。体内和体外研究发现,AngⅡ和LPS可协同作用,参与血管内皮细胞和肺泡上皮细胞的损伤。有学者将上述机体急性应激情况下,内毒素致病性加重的现象称为“二次打击”[6]。LPS上调血管内皮细胞AT1表达,及AngⅡ促进肺泡上皮等TLR4表达可能是形成该现象的重要原因。
微炎症(Microinflammation)是指以循环系统中炎性蛋白、炎症性细胞因子轻度升高为特征的低强度、慢性炎症状态。单纯微炎症没有明显临床症状,但常伴随糖尿病、慢性肾病和长期血液透析患者存在。导致微炎症的机制尚未明确,但血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)可能发挥重要作用。巨噬细胞在抗感染和炎症进程中的角色复杂,一方面其活化可增强吞噬病原体效应,另一方面活化巨噬细胞通过释放炎症介质,参与组织损伤。T细胞可通过活化诱导的细胞凋亡(Activation induced cell death/apoptosis,AICD)来减少自身的数量,近年来有学者报道,活化的巨噬细胞也发生凋亡和坏死[3,7]。体内有吞噬功能的细胞(巨噬细胞和嗜中性粒细胞)被活化后,其细胞内溶酶体活性增强,而细胞内pH值下降。虽然溶酶体活性增强有利于杀伤病原体,但在细胞死亡后溶酶体酶的释放往往导致正常组织损伤[8]。
TLR4结合LPS后可活化p38MAPK和NFκB等炎症相关的信号。本研究表明,AngⅡ以浓度依赖方式上调小鼠巨噬细胞TLR4表达,而在AngⅡ与LPS协同诱导后,细胞内ROS含量显著增加,pH值下降幅度也较LPS单独作用组大,即AngⅡ对LPS活化巨噬细胞具有曾敏作用。同时发现,AngⅡ与LPS协同诱导后,细胞凋亡和导致线粒体功能损伤的效应也增强了。概括而言,血管紧张素Ⅱ可协同LPS诱导巨噬细胞活化,两者联合也增加了活化后巨噬细胞的凋亡。活化巨噬细胞释放炎性介质和死亡巨噬细胞释放溶酶体酶,但均参与炎症急性期的组织损伤,因此,AngⅡ与LPS协同可导致体内发生严重的炎症相关的组织损伤。近年来,慢性微炎症状态下,巨噬细胞参与组织器官纤维化、动脉硬化等的证据引起人们重视。本研究表明,AngⅡ对巨噬细胞感应LPS刺激具有“预致敏”的作用,提示在机体急性应激和慢性的微炎症状态下,均应适当拮抗AngⅡ的“预致敏”作用以减轻内毒素的致病性。
[1]刘铭,王志禄.肾素-血管紧张素-醛固酮系统及其受体与心血管疾病[J].中华心血管病杂志,2002,30(3):190-192.
[2]郭峰,陈旭,林王飞,等.血管紧张素Ⅱ1型受体在脂多糖诱导RAW264.7巨噬细胞促炎性细胞因子产生中的作用[J].中华损伤与修复杂志,2011,6(2):189-195.
[3] Roberts A I,Devadas S,Zhang X,et al.The role of activation-induced cell death in the differentiation of T-helper-cell subsets[J].Immunol Res.2003;28(3):285-293.
[4]郭发良,阎红霞,蔡伟飞,等.严重胸外伤并发成人呼吸窘迫综合征的早期预测、诊断与治疗[J].中国综合临床,2001,17(8):610-612.
[5]张伟,蒋耀光,谢志坚,等.严重胸部创伤复合内毒素感染对肺泡与肺间质巨噬细胞吞噬功能的影响[J].中国危重病急救医学,2003,15(7):408-410.
[6]于振香,赵珩,彭丽萍.人参二醇组皂苷对失血-内毒素二次打击大鼠肺脏氧化损伤的保护作用[J].吉林大学学报(医学版),2008,34(4):594-598.
[7] Schilling JD,Machkovech H M,He L,et al.TLR4 activation under lipotoxic conditions leads to synergistic macrophage cell death through a TRIF-dependent pathway[J].J Immunol.2013,190(3):1285-1296.
[8]Weber K,Schilling JD.Lysosomes integratemetabolic-inflammatory cross-talk in primary macrophage inflammasome activation[J].JBiol Chem,2014,289(13):9158-9171.

