表达ILTV gB和UL32基因的重组鸡痘病毒疫苗安全性及稳定性分析
徐美玉,赵 烨,朱发江,张圆圆,,赵红玲,秦秀慧,张国中
[1.中国农业大学动物医学院,北京 海淀100193;2.北京市畜牧总站,北京 朝阳100107;3.诗华诺康科技发展(北京)有限公司,北京 朝阳100016]
鸡传染性喉气管炎(ILT)是由传染性喉气管炎病毒(ILTV)引起鸡的一种急性上呼吸道传染病,为危害养禽业的重要疫病之一。疫苗接种是防制本病的最好方法。ILTV灭活疫苗制备和运输成本高,一般不用于实际生产。弱毒疫苗具有相对较好的免疫效果,但安全性较差,会伴随一系列副作用[1-2]。基因工程疫苗,尤其是重组病毒载体疫苗的安全性好、毒副作用小等优点使其成为ILTV的疫苗研究的一个热点。
表达ILTV gB和UL32基因的重组鸡痘病毒疫苗以鸡痘病毒作为载体,表达ILTV gB基因和UL32基因,经冷冻干燥制成。UL32蛋白是包装糖蛋白,而gB蛋白是病毒感染所必需的主要免疫糖蛋白。gB基因和UL32基因的保守性都很高,gB基因是ILTV的主要的保护性抗原[3-4]。鸡痘病毒作为较成熟的重组病毒疫苗载体,已成功用于多种病原保护性抗原的表达,并在接种机体后显示出良好的免疫原性。
为了评估表达ILTV gB和UL32基因的重组鸡痘病毒活疫苗Vectormune FP-LT的安全性与稳定性,我们通过一系列试验对影响疫苗病毒的安全性与稳定性的指标进行了评估,为该载体疫苗的生产应用奠定了理论基础。
1 材料与方法
1.1 疫苗、毒株和实验动物 表达鸡传染性喉气管炎病毒gB和UL32基因的重组鸡痘病毒活疫苗(FP-LT)由美国诗华-百妙动物保健公司生产(批号为420-046)。鸡痘强毒102株,购自中国兽医药品监察所;9~10日龄SPF鸡胚和6~8周龄SPF鸡,购自北京维通利华实验动物有限公司;ILTV抗体检测用试剂盒为BioChek产品,购自北京天之泰生物科技有限公司。
1.2 检测引物 根据已发表传染性喉气管炎病毒UL32基因序列及鸡痘病毒4b核心蛋白基因序列分别设计特异性引物,如表1所示。
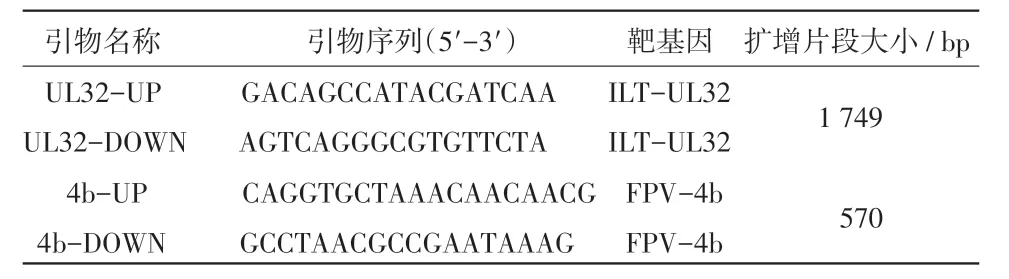
表1 本研究PCR检测用引物
1.3 鸡痘强毒102株EID50的测定 鸡痘强毒102株通过SPF鸡胚绒毛尿囊膜传代复壮,复壮病毒进行10-1~10-5稀释分别接种10日龄SPF鸡胚绒毛尿囊膜,每一稀释度接种5枚,接种后120 h观察并统计记录绒毛尿囊膜变化(水肿、出现明显痘斑)情况,根据Reed-Muench法计算毒株EID50。
1.4 疫苗株的传代 将6~8周龄SPF鸡通过右侧股腿部外侧涂抹毛囊接种疫苗,每只0.03mL。接种后5 d,随机选取2只接种部位痘肿皮肤,研磨后用含抗生素(青霉素、链霉素各1 000单位(μg/mL)的PBS制成10%乳剂,离心取上清0.03 mL,以同样方法接种第2代鸡,如此连续传至第5代。每代疫苗接种后,每日观察接种鸡的临床症状,直至接种后14 d。观察完毕,将第2、3、4代鸡做安乐死处理,对每代2只取样的传代鸡进行剖检观察。第1代疫苗接种后定期扑杀取接种部位皮肤、气管、肝脏、脾脏、腔上囊和脑,利用PCR方法检测重组病毒存在情况。取第5代重组病毒利用PCR检测ILTV UL32基因的变异情况。
1.5 攻毒试验 第5代鸡接种后14 d,对第1代、第5代接种鸡以及同居鸡通过左侧股腿部毛囊涂抹方式攻击鸡痘强毒102株,攻毒剂量为103EID50/只。同时设立空白对照鸡和攻毒对照鸡(与第5代同日龄),攻毒后每日观察记录攻击部位的反应,直至攻毒后21 d。
1.6 接种鸡排毒情况和饲养环境中病毒的存在情况检测 第1代鸡疫苗接种后定期采集试验组和对照组鸡的泄殖腔拭子,在7 d和14 d采集环境中的粪便以及笼具内表面擦拭物进行重组鸡痘病毒的分离,并采用PCR方法检测FPV-4b基因的存在情况。
2 结果
2.1 鸡痘强毒102株EID50的测定 将鸡痘强毒102株经绒毛尿囊膜途径接种SPF鸡胚进行复壮,并测定复壮病毒的EID50为10-3.32/0.15mL,结果如表2所示。
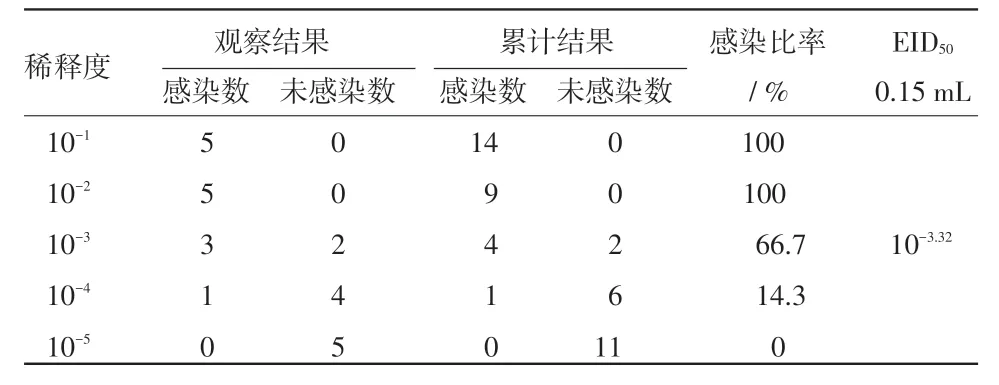
表2 鸡痘102株EID50测定结果
2.2 重组疫苗的安全性检测 试验鸡接种每代疫苗后,均观察到接种部位的正常疫苗反应(“痘发”),“痘发”从疫苗接种3 d出现,9 d开始逐渐恢复,至14 d完全恢复正常,此外未见其他临床症状。对每代鸡进行剖检观察,亦未见任何病理变化。各代接种鸡接种部位“痘发”表现类似,第1代鸡疫苗接种部位的观察记录结果如图1所示。
2.3 重组病毒的稳定性 FP-LT疫苗经SPF鸡连续传代,除疫苗接种部位皮肤的正常反应外,各组传代鸡均未见任何异常表现,第5代传代疫苗毒中ILTV UL32基因序列与原代相比未发生任何变异,表明疫苗具有良好的遗传稳定性。利用SPF鸡胚测定不同代次毒株的毒价,结果表明,各代次毒株毒价稳定,无毒力返强现象,结果如表3所示。
2.4 重组病毒在鸡体内的分布及存留时间 PCR检测结果表明,接种后疫苗毒主要分布在接种部位皮肤,至少在接种后14 d仍可从部分鸡接种部位皮肤检出,其他组织如肝脏、脑、气管等未有病毒检出,如表4所示。
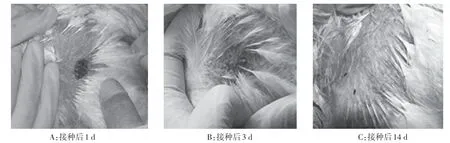
图1 第1代鸡接种部位皮肤表现

表3 重组鸡痘病毒FP-LT不同代次毒株毒价检测
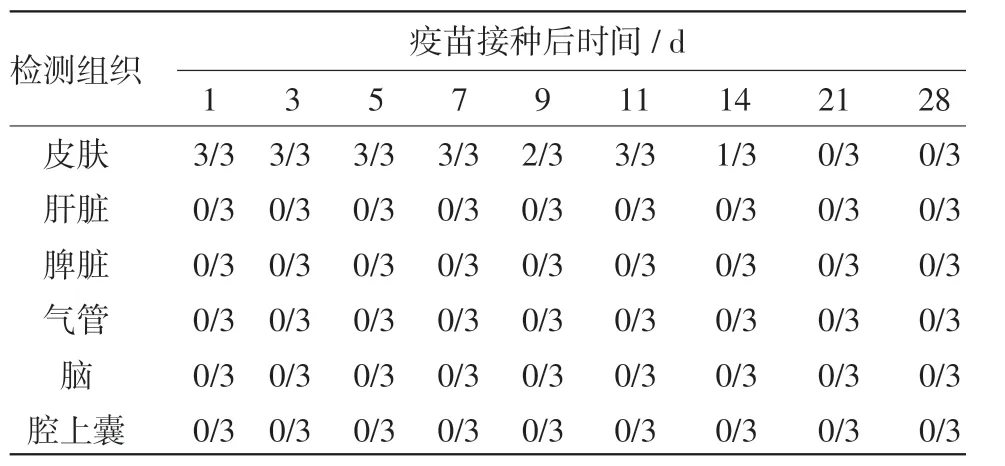
表4 重组病毒在鸡体内的分布情况及存留时间
2.5 重组疫苗的攻毒保护情况 临床观察及PCR检测结果表明,重组疫苗免疫鸡对鸡痘强毒102株攻击具有较好的保护力,保护率均在90%以上(表5),而同居鸡攻毒后没有任何保护力,同居鸡攻毒部位皮肤重组鸡痘病毒PCR检测结果如图2所示。

表5 重组疫苗对鸡痘的攻毒保护结果
2.6 免疫鸡排毒及重组病毒在环境中的存活时间PCR和病毒分离结果表明,疫苗接种后3~5 d部分鸡只存在短暂排毒现象,但环境监测表明,病毒在环境中存在时间极短,如表6所示。同居鸡攻毒试验、环境中重组病毒检测结果表明,重组病毒不具备水平传播能力。
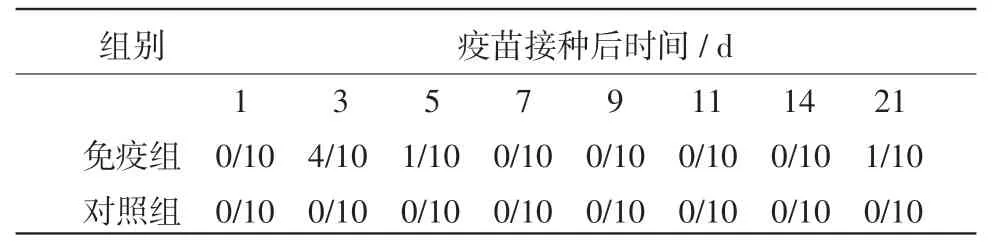
表6 重组疫苗免疫鸡排毒情况检测
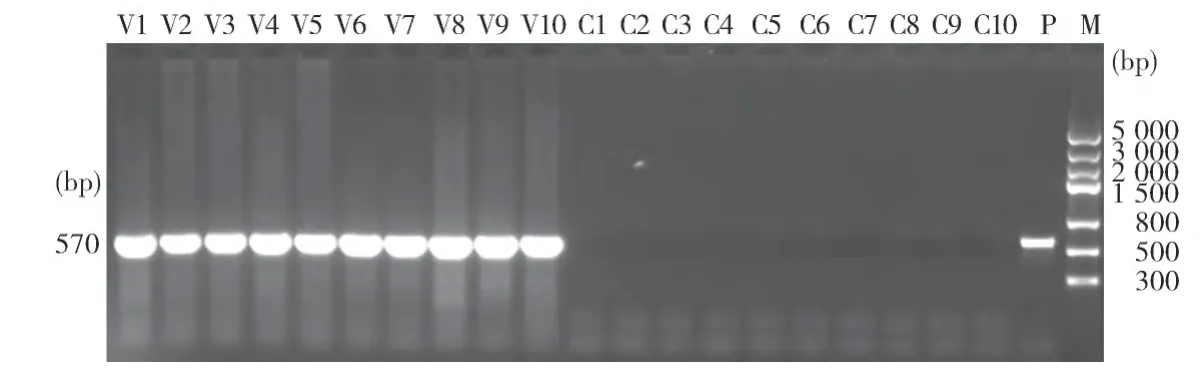
图2 对照鸡攻毒部位皮肤鸡痘病毒PCR检测结果
3 讨论
禽痘病毒表达系统是继痘苗病毒以后的又一种动物病毒表达系统。与痘苗病毒不同,禽痘病毒的宿主范围很窄,对人和其他哺乳动物仅产生一过性感染,接种副作用小。目前,研究者已经构建了表达多种禽类传染病病毒蛋白的重组禽痘病毒,其中以禽痘病毒作为载体表达NDV HN基因和F基因及H5亚型AIV的重组活载体疫苗已获得美国农业部的生产许可证[5]。重组痘病毒在ILTV疫苗研制方面也受到了人们的普遍关注。作为基因工程活载体疫苗研制中应用极为广泛的一种工具,鸡痘病毒具有如下优点:(1)能针对外源基因产生体液免疫应答和细胞毒T细胞免疫应答,一次接种可以产生长时间的免疫力;(2)因为重组疫苗只含有病原微生物特定的抗原成分,动物免疫后可以将自然感染动物与免疫动物区分开来;(3)鸡痘病毒很容易在鸡胚成纤维细胞和鸡胚皮肤细胞等一些禽源细胞系上增殖,生产成本低廉;(4)痘病毒对热稳定.易于保藏和运输,不需要佐剂,不需要纯化[6]。
本研究对表达ILTV gB和UL32基因的重组鸡痘病毒活疫苗的安全性和稳定性进行了评估。结果表明,重组鸡痘病毒疫苗经SPF鸡多次传代后外源基因序列无任何变异,各代次毒株毒价稳定,无毒力返强现象,表明该疫苗具有良好的遗传稳定性。对试验鸡进行攻毒,重组病毒免疫鸡能抵抗鸡痘强毒102株攻击,表明该疫苗具有较好的保护力。对接种鸡体内及环境中重组病毒检测结果显示,病毒在接种鸡体内各脏器及环境中存在时间极短,且同居鸡未被感染,表明重组病毒不具有水平传播能力,不会对环境造成污染,表明该疫苗具有良好的安全性。本研究对影响疫苗病毒的安全性与稳定性的指标进行了评估,为该载体疫苗在养禽生产中的应用奠定了基础。
[3]郑海洲,杨虹,柏桂宁,等.鸡传染性喉气管炎病毒基因的克隆及其在耻垢分枝杆菌中的表达[J].微生物学报,2004,44(6):830-833.
[4]张绍杰,倪健强,孟松树,等.传染性喉气管炎病毒王岗株糖蛋白基因在重组杆状病毒中的表达[J].中国预防兽医学报,2001,23(5):321-324.
[5]张绍杰,孟松树,仇华吉,等.鸡传染性喉气管炎病毒(ILTV)王岗株糖蛋白gB基因序列比较分析[J].中国兽医学报,2000,20(6):544-547.
[6]陈万平,程安春,江铭书,等.疱疹病毒UL32基因及其编码蛋白研究进展[C].中国畜牧兽医学会动物微生态学分会第四届第九次学术研讨会论文集(下册).
[7]Su B S,Shen PC,Hung L H,et al.Potentiation of cell-mediated immune responses against recombinant HN protein of Newcastle disease virus by recombinant chicken IL-18[J].Vet Immunol Immunopathol,2011,141(3-4):283-292.
[8]王云峰,智海东,王玫,等.表达传染性喉气管炎病毒gB基因重组鸡痘病毒疫苗免疫持续期试验[J].中国预防兽医学报,2004,26(2):131-135.

