不同时期应用益生菌对脓毒症患者肠道菌群及短链脂肪酸的影响
李素彦 徐鑫 杨运强 赵茜 李建国 郝清卿
不同时期应用益生菌对脓毒症患者肠道菌群及短链脂肪酸的影响
李素彦 徐鑫 杨运强 赵茜 李建国 郝清卿
目的 评价在脓毒症患者中早期应用益生菌治疗是否可更好改善肠道菌微生态环境。方法 选取就诊于河北省人民医院25例患者,确诊脓毒症后72 h接受益生菌治疗,给双歧三联活菌胶囊420 mg(长型双歧杆菌≥0.42×106CFU,嗜酸乳杆菌≥0.42×106CFU,粪肠球菌≥0.42×106CFU),口服或通过胃管饲入,3次/d,为较晚应用益生菌组(L组);另外,32例诊断后即(0 h)给双歧杆菌三联活菌胶囊,剂型,方法同上,为早期应用益生菌组(E组)。2组患者均留取诊断即时(0 h)、72 h、1周粪便标本,分析粪便中10种常见细菌的种类变化及细菌代谢产物有机酸的变化。结果 E组患者粪便中“有益菌”如双歧三联活菌,乳酸杆菌及总生物酸明显高于L组,差异有统计学意义(P<0.05)。病死率、住院时间低于对照组,差异有统计学意义(P<0.05)。结论 对脓毒症患者早期添加益生菌,可改善肠道微生态功能,提高生存率。
肠道;微生态;有机酸;脓毒症;益生菌;早期
21世纪初人类微生物基因组计划(Human Microbiome Project,HMP)的研究进展表明,人体是以人类细胞为核心与共生微生物共同构成的超有机体。肠道菌群参与调控机体免疫系统发育、物质代谢、维护肠道内稳态等多种生理过程,是肠黏膜屏障的重要组成部分[1]。在脓毒症、创伤、肝硬化、肠道感染等情况发生时,肠道菌群为损伤的重要靶器官,有益菌减少,致病菌数量明显增高。益生菌作为微生物改善肠道菌群平衡的补充剂已在临床得到广泛应用,取得较好的临床效果[2-4]。关于益生菌在脓毒症患者的应用时机,目前相关报道较少,本研究的目的为确定早期应用益生菌是否可更好改善肠道菌群及肠道微环境,及评价临床效果。本文选择2013年6月至2015年6月就诊于河北省人民医院急诊科的脓毒症患者为研究对象,共计57例。2013年6月至2014年6月符合条件患者25例,确诊脓毒症后72 h接受益生菌治疗,给双歧三联活菌胶囊420 mg(长型双歧杆菌≥0.42×106CFU,嗜酸乳杆菌≥0.42×106CFU,粪肠球菌≥0.42×106CFU),口服或通过胃管饲入,3次/d。为较晚应用益生菌组(L组);另外,2014年7月至2015年6月符合条件患者32例,诊断脓毒症后即(0 h)给双歧杆菌三联活菌胶囊,剂型,方法同上,为早期应用益生菌组(E组)。2组患者均留取诊断即时(0 h)、72 h、1周粪便标本,分析粪便中10种常见细菌的种类变化及细菌代谢产物有机酸的变化。为脓毒症患者益生菌的应用时机提供临床资料。
1 资料与方法
1.1 一般资料 2013年6月至2014年6月就诊于河北省人民医院急诊科脓毒症患者25例,男15例,女10例;年龄18~77岁,平均年龄(55±17)岁;根据美国胸科医师学会和急救医学会(ACCP/SCCM)(2013版)标准诊断脓毒症,72 h后给双歧杆菌三联活菌肠溶胶囊(晋城海斯制药有限公司),420 mg(长型双歧杆菌≥0.42×106CFU,嗜酸乳杆菌≥0.42×106CFU,粪肠球菌≥0.42×106CFU),3次/d,口服或胃管饲入,为较晚应用益生菌组(L组);2014年7月至2015年6月就诊于同医疗机构,同诊断标准的脓毒症患者32例,男17例,女15例;年龄19~79岁,平均年龄(55±16)岁;患者诊断后即(0 h)给双歧杆菌三联活菌囊,420 mg(长型双歧杆菌≥0.42×106CFU,嗜酸乳杆≥0.42×106CFU,粪肠球菌≥0.42×106CFU),口服或胃管饲入,3次/d。为早期应用益生菌组(E组)。2组患者均尽早应用肠内营养,在初诊感染时,给广谱抗生素,同时留取感染灶处标本行细菌培养,根据微生物培养结果,调整为针对性抗生素。2组患者均持续应用益生菌直至试验终点。本试验经过河北省人民医院伦理委员会审批,所有患者均签署知情同意书。
1.2 入选标准 (1)年龄18~80岁;(2)入住ICU时间大于1周。
1.3 排除标准 (1)4周内使用过抗生素及肠道微生物制剂;(2)肠道感染引起的脓毒症;(3)4周内有重大的或复杂的腹部手术史者;(4)妊娠及哺乳期女性;(5)重度肥胖患者(BMI>35 kg/m2)。
1.4 粪便标本的留取及肠道细菌培养 根据Lozupone等[5]报道,选取人类肠道菌群最常见菌培养类杆菌、双歧杆菌、梭状芽孢杆菌、韦荣球菌、乳酸杆菌、肠杆菌、肠球菌、葡萄球菌、假单胞菌进行分析。2组患者各时间点粪便后用无菌长棉拭子取出放置于厌氧试管中,试管为含有7%的H2和5%CO2,余气体为N2。培养之前,称重后放入冰柜中冷藏。细菌培养:改良后VL-G琼脂滚管(加入0.2%纤维二糖,0.2%麦芽糖)培养总厌氧菌并确定数量。根据菌体的形状、大小、染色、排列、芽孢等确定菌种,选择培养基,不同细菌选择性分离置于不同培养基中:卡那-万古霉素冻溶血琼脂(KVLB):80 μg/ml万古霉素及 100 μg/ml卡那霉素加入VL-G琼脂滚管中,培养类杆菌;CW琼脂(青岛日水生物科技有限公司)培养磷脂酶阳性梭菌;MPN琼脂培养双歧杆菌,COBA琼脂(北京朋利驰科技有限公司)培养肠球菌;加入实验室肉汁粉的LBS琼脂(上海远慕生物科技有限公司)培养乳酸杆菌;葡萄球菌选择性琼脂110号(上海谷研实业有限公司)培养葡萄球菌;DHL琼脂(上海谷研实业有限公司)培养肠杆菌;NAC琼脂(广东环凯微生物科技有限公司)培养假单孢菌。CW琼脂及LBS琼脂培养厌氧菌在37.0℃培养72 h。均值于恒温厌氧菌培养箱(Binder,德国),经过培养,培养试管中的菌落计数并称重,计算每克粪便(湿便)中细菌数。为方便计数,细菌菌落总数(CFU/g)换算为log10 CFU。应用此办法,细菌可检出最低数为1 000 CFU/g,已有多项研究采用上述技术行细菌培养并发表[6,7]。
1.5 有机酸浓度的检测 培养液中短链脂肪酸含量的分析采用文献中报道的方法[8],使用Agilent HPLC 1260进行分析。
1.6 统计学分析 应用SPSS 19.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者基本情况比较 所有接受益生菌患者均耐受治疗,未发生不良反应,2组性别比、年龄、APACHEⅡ评分、感染部位、抗生素使用、肠内营养种类及时机等一般资料方面比较,差异无统计学意义(P>0.05),具有可比性。见表1。
2.2 2组患者各时间点粪便菌群分析 总厌氧菌数量E组在72 h及1周时均高于L组,差异无统计学意义(P>0.05)。对人体有益的细菌,包括双歧杆菌、乳酸杆菌,在72 h、1周分析粪便标本L组明显低于E组。双歧杆菌:72 h(4.8±2.5,7.9±2.0),1周(5.6±0.19,9.4±1.00);乳酸菌:72 h(3.5±1.9,6.0±2.0),1周(3.8±0.19,7.8±2.1),差异有统计学意义(P<0.05)。肠道正常存在主要菌群类杆菌,在72 h、1周分析粪便标本,L组明显低于E组,差异有统计学意义(P<0.05)。致病菌葡萄球菌在72 h、1周分析粪便标本L组明显高于E组,72 h(6.0±1.5,3.2±2.0),1周(5.0±1.8,2.7±0.8),差异有统计学意义(P<0.05)。E组患者双歧杆菌、乳酸杆菌、类杆菌在72 h、1周明显高于0 h,差异有统计学意义(P<0.05)。E组患者葡萄球菌在72 h、1周明显低于0 h,差异有统计学意义(P <0.05)。见表2。
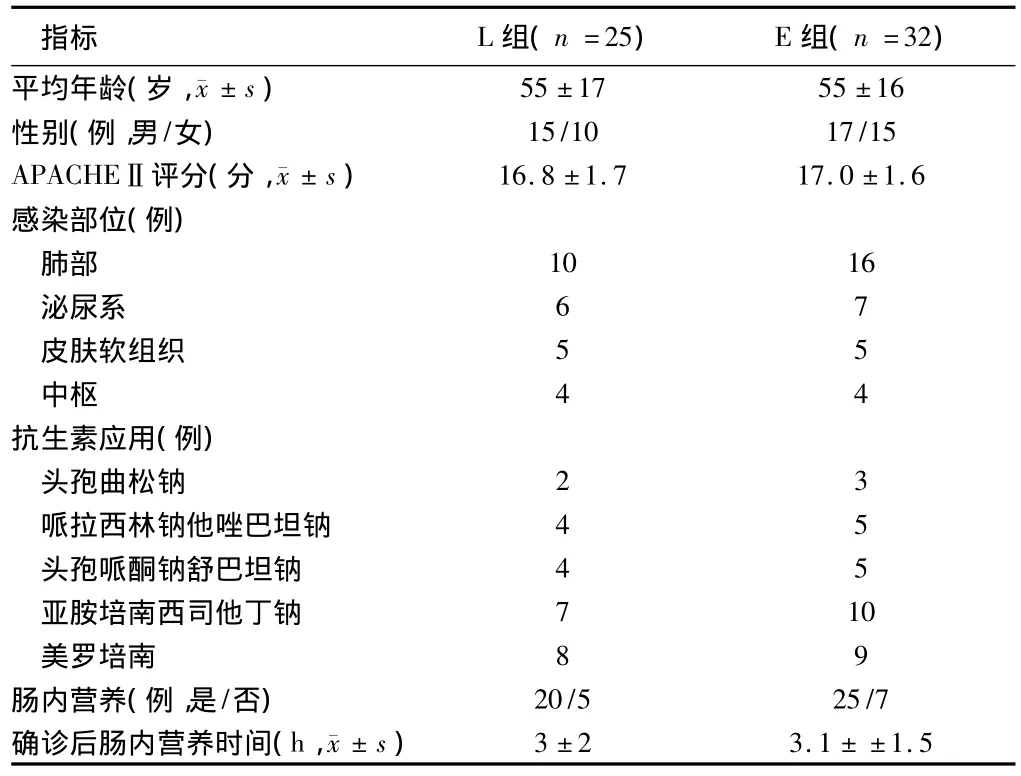
表1 2组患者基本情况比较
2.3 2组患者各时间点粪便有机酸含量分析 2组各时间点有机酸统计,总有机酸量E组在72 h及1周时均高于L组,差异有统计学意义(P<0.05)。对人体有益的短链脂肪酸,包括乙酸、丙酸、丁酸,在72 h、1周分析粪便标本,L组明显低于 E组。乙酸:72 h(33.2±19.2,55.9±21.0),1周(40.8±21.7,66.9±25.6);丙酸:72 h(4.9±7.6,13.6±9.8 P),1周(10.0±6.5,18.7±9.3);丁酸:72 h(1.2±0.7,11.5±0.5),1周(4.5±2.7,16.3±6.5)差异有统计学意义(P<0.05)。乙酸、丙酸、丁酸E组患者在72 h、1周明显高于0 h,差异有统计学意义(P <0.05)。见表3。
2.4 2组患者住院时间及病死率分析 E组住院时间、病死率低于L组,差异有统计学意义(P<0.05)。见表4。
3 讨论
正常成人的肠道菌群总重量约1~2 kg[9],是人体细胞总数的10倍,包含的基因数量是人类基因数量的150倍。由此数量庞大的肠道菌群和宿主形成一个“超级生物体”,相互作用,实现生态共享,影响着人体的生理代谢,并为宿主提供不具备的酶和生化代谢通路[9]。2004年Gordon主持的系列研究首次表明:肠道菌群作为一种“内化了的环境因子”,可以直接调控机体的脂肪合成与存储相关基因的表达,2007年,美国国立卫生研究院启动了“人类微生物组计划”(HMP)。2008年,欧盟启动了肠道元基因组第七框架项目(MetaHIT),开启了肠道菌群与创伤、脓毒症、糖尿病、肝性脑病等各种疾病的研究热潮[2-4,10]。
表2 2组患者粪便菌群分析log CFU/g,±s

表2 2组患者粪便菌群分析log CFU/g,±s
注:与L组比较,*P <0.05;与0 h比较,#P <0.05
菌群72 h L组(n=25) E组(n=32)0 h L组(n=25) E组(n=32)1周L组(n=25) E组(n=32)专性厌氧菌总数 8.1±2.3 8.2 ±2.3 8.3±1.3 10.0±0.8 8.30±2.0 10.2±1.2类杆菌 8.1±2.4 8.1±2.1 6.8±3.7 9.5±1.2* 7.0±3.5 10.10±0.4*双歧杆菌 4.6±2.1 4.5±2.0 4.8±2.5 7.9±2.0*# 5.6±0.19 9.4±1.0*#梭状芽孢杆菌 2.2±0.7 2.1±0.6 2.3±0.8 2.1±0.7 1.9±2.0 2.0±0.7韦荣球菌 2.8±0.6 2.9±0.7 3.1±0.4 3.4±0.5 3.7±0.8 3.9±0.4兼性厌氧菌总数 8.4±1.5 8.3±0.7 8.5±0.6 8.4±0.7 8.2±1.5 8.3±1.1乳酸杆菌 3.4±2.1 3.6±1.8 3.5±1.9 6.0±2.0*# 3.8±1.9 7.8±2.1*#肠杆菌 5.9±1.8 5.8±2.0 6.1±2.4 6.2±0.5 6.1±2.5 5.9±2.2肠球菌 5.4±2.1 5.5±1.9 5.4±1.4 6.7±2.2 6.0±2.1 7.0±2.3葡萄球菌 5.4±1.2 5.3±1.1 6.0±1.5 3.2±2.0*# 5.0±1.8 2.7±0.8*#假单胞菌 2.7±0.5 2.9±0.6 3.0±0.4 2.8±0.4 3.0±0.9 3.1±1.0
表3 2组患者粪便有机酸含量分析log CFU/g,±s
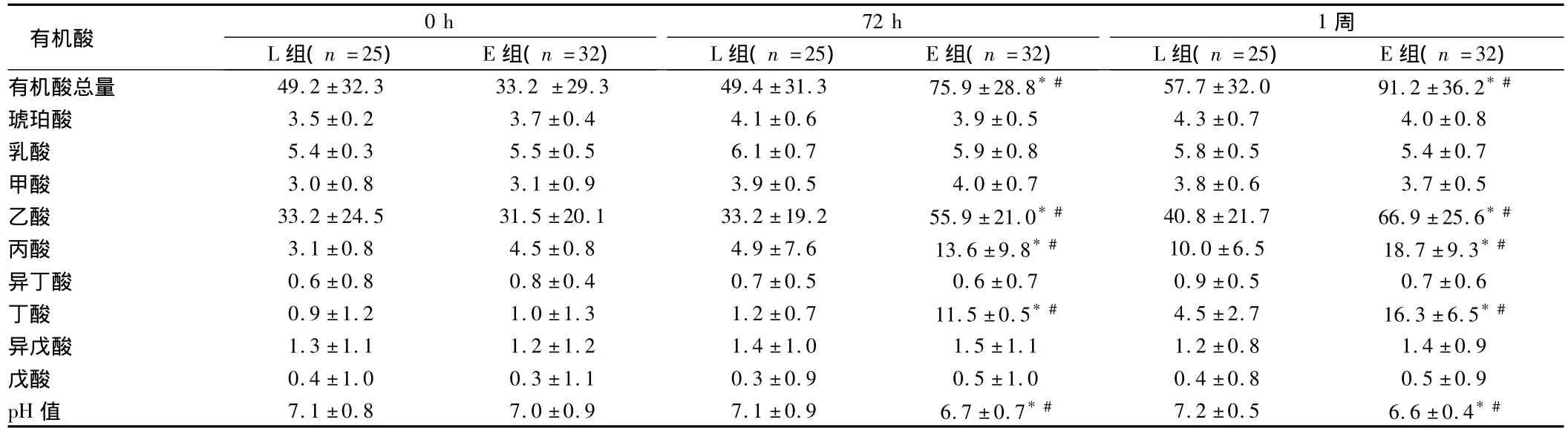
表3 2组患者粪便有机酸含量分析log CFU/g,±s
注:与L比较,*P <0.05;与0 h比较,#P <0.05
有机酸72 h L组(n=25) E组(n=32)0 h L组(n=25) E组(n=32)1周L组(n=25) E组(n=32)有机酸总量 49.2±32.3 33.2 ±29.3 49.4±31.3 75.9±28.8*# 57.7±32.0 91.2±36.2*#琥珀酸 3.5±0.2 3.7±0.4 4.1±0.6 3.9±0.5 4.3±0.7 4.0±0.8乳酸 5.4±0.3 5.5±0.5 6.1±0.7 5.9±0.8 5.8±0.5 5.4±0.7甲酸 3.0±0.8 3.1±0.9 3.9±0.5 4.0±0.7 3.8±0.6 3.7±0.5乙酸 33.2±24.5 31.5±20.1 33.2±19.2 55.9±21.0*# 40.8±21.7 66.9±25.6*#丙酸 3.1±0.8 4.5±0.8 4.9±7.6 13.6±9.8*# 10.0±6.5 18.7±9.3*#异丁酸 0.6±0.8 0.8±0.4 0.7±0.5 0.6±0.7 0.9±0.5 0.7±0.6丁酸 0.9±1.2 1.0±1.3 1.2±0.7 11.5±0.5*# 4.5±2.7 16.3±6.5*#异戊酸 1.3±1.1 1.2±1.2 1.4±1.0 1.5±1.1 1.2±0.8 1.4±0.9戊酸 0.4±1.0 0.3±1.1 0.3±0.9 0.5±1.0 0.4±0.8 0.5±0.9 pH值 7.1±0.8 7.0±0.9 7.1±0.9 6.7±0.7*# 7.2±0.5 6.6±0.4*#
表4 L组与E组患者住院时间及病死率分析±s

表4 L组与E组患者住院时间及病死率分析±s
注:与L组比较,*P <0.05
指标 L组(n=25) E组(n=32)住院时间(d) 19±10 11±5*病死率(%) 40.3±15.1 21.6±9.4*
现有研究表明,脓毒症、肝硬化、肝性脑病、哮喘、妇科卵巢切除等多种疾病可引起肠道菌群失调,同时肠道菌群失调可加重疾病的恶化。对肠道菌群进行干预对多种疾病中的治疗有重要的作用[2-4,10,11]。
脓毒症是由感染引起的全身炎性反应综合征。随着人口的老龄化、肿瘤发病率上升及侵入性医疗手段的增加,脓毒症的发病率不断上升,每年全球新增数百万脓毒症患者,其中超过1/4患者死亡。按照全球脓毒症联盟公布的数据显示[12],因脓毒症死亡的人数超过了前列腺癌、乳腺癌、艾滋病死亡人数的总和。过去十年,发达国家脓毒症发病率每年以8% ~13%的速度剧增;而在发展中国家,脓毒症病死率也居高不下。严重脓毒症和脓毒性休克是重症医学面临的重要临床问题[13]。
如何通过改善脓毒症患者的肠道微生态环境,提高脓毒症的生存率越来越受到ICU医生的重视[14],Shimizu等[6]报道应用益生菌的SIRS患者较未用益生菌患者肠道微环境更接近正常人。对益生菌的应用时机相关报道较少[15,16]。Evans-Pyles 等[17]研究证实30%皮肤被烧伤的小鼠,在烧伤5 min内即出现肠道黏膜屏障功能受损,肠道菌群异常,4 d达损害高峰,21 d肠道黏膜屏障及肠道菌群仍为异常状态。De-Souza等[18]研究发现脓毒症患者肠道功能在诊断时即出现异常。
现有脓毒症的治疗同样强调及时性,多项研究报道脓毒症休克如果在l h内得到正确的诊治,患者的存活率将达到80%以上;而在脓毒症休克6 h之后诊治,患者的生存率即会下降至 30%[19,20]。
因此,诊断脓毒症早期给益生菌,可能会对肠道菌群维持,进而对肠道黏膜屏障功能、免疫等及时干预,改善脓毒症预后。本研究中,早期添加益生菌,对人体有益的细菌,包括双歧杆菌、乳酸杆菌,在72 h、1周分析粪便标本E组明显高于L组。双歧杆菌、乳酸杆菌、类杆菌E组患者在72 h、1周明显高于0 h。致病菌葡萄球菌在72 h、1周分析粪便标本L组明显高于E组,E组患者葡萄球菌在72 h、1周明显低于0 h。上述结果验证了早期应用益生菌可改善脓毒症患者肠道菌群的构成,有利于维持肠道微生态稳定。
稳定的肠道微生态环境通过宿主和肠道细菌之间的持续相互作用,维持肠道免疫系统的平衡。Lathrop等[21]报道肠道微生物能调控宿主肠道中T细胞群的生成,而肠道微生物的失调则会导致机体免疫系统的异常。Kawamoto等[22]研究表明肠道微生态环境紊乱会导致全身免疫系统过度活跃。Org等[23]研究证明:肠内菌群不但对先天性免疫及肠道黏膜免疫有重要作用,同时可通过炎症及血管反应影响肠道的微循环,观察肠道无菌的小鼠,分泌IgA的细胞及CD4T细胞均显著下降,平衡的肠道菌群被外来生物破坏后可引起免疫系统应答,导致炎性反应,最终破坏黏膜屏障。Sartor[24]报道益生菌与肠黏膜上皮细胞紧密结合,提高黏膜防御屏障,组织致病菌的定植和入侵,提高抗炎细胞因子水平,与病原竞争性黏附于上皮细胞,促进上皮细胞分泌黏液,使其在黏膜和微生物之间形成保护层,防止栖生菌易位等。综上,肠道菌群可做为改善脓毒症预后的治疗靶点。本试验表明,脓毒症早期,在肠道生态系统尚未完全“崩坍”之前应用益生菌,可及时改善肠道菌群构成。这可能是早期添加益生菌(E组)相对较晚添加益生菌(L组)的患者住院时间短,生存率高的原因。
另外,本研究中同时发现短链脂肪酸(SCFAs),包括乙酸、丙酸、丁酸,在72 h、1周分析粪便标本,L组明显低于E组,差异有统计学意义(P<0.05),乙酸、丙酸、丁酸E组患者在72 h、1周明显高于0 h,差异有统计学意义(P<0.05)。上述结果提示早期应用乳酸菌的患者,粪便中短链脂肪酸含量增加。Backhed等[25]证实肠道内微生物群落的基因多样性为宿主提供了其不具备的酶和生化代谢通路,编码大量的糖苷水解酶,将多糖转化为单糖和代谢终产物短链脂肪酸。短链脂肪酸(short chain fatty acids,SCFAs)是指碳原子小于6个的有机脂肪酸,主要由不消化的碳水化合物在结肠内经厌氧菌酵解而成,主要包括乙酸、丙酸和丁酸,约占SCFAs总量的90% ~95%。短链脂肪酸,尤其是丁酸,有利于维持肠道内环境的稳定和平衡,有利于肠上皮细胞的生长和代谢,抑制病原菌的生长以及维持肠道免疫系统的平衡[26,27]。Canfora 等[28]研究发现丁酸还可以通过阻止NF-κB激活达到抗炎作用,丁酸被认为是抗生素的潜在替代物。乙酸是肠道内多数细菌酵解的主要代谢产物,是新生儿肠道中最先出现的SCFAs。一项体外检测生理浓度SCFAs对新生鼠肠黏膜屏障作用的研究显示,生理浓度的乙酸在维持正常肠黏膜屏障功能比丁酸更为有效。丙酸经结肠吸收后主要由肝脏代谢,参与糖异生作用,抑制胆固醇合成[25]。综上,早期应用益生菌,益生菌的代谢产物如丁酸等较晚期应用增多,可进一步促进肠道上皮细胞的生长代谢、抑制病原菌生长、维持肠道免疫平衡,抗感染等,这可能是早期添加益生菌(E组)相对较晚添加益生菌(L组)的患者住院时间短,生存率高的另一个原因。
本研究样本量较少,研究对象为粪便中菌群,对肠道黏膜菌群未做研究,有一定的局限性;另外,随着分子生物学的发展以及分子生物学技术在微生态领域的应用,16S rDNA测序、宏基因组测定等为微生态学的研究提供了更有力的工具,国外已经开展这方面的研究,国内起步较晚,未来可采用上述技术对本研究进行进一步验证。
1 Zhang N,He QS.Commensal Microbiome Promotes Resistance to Local and Systemic Infections.Chin Med J(Engl),2015,128:250-256.
2 Qin N,Yang F,Li A,et al.Alterations of the human gut microbiome in liver cirrhosis.Nature,2014,513:59-64.
3 Dhiman RK.Gut microbiota and hepatic encephalopathy.Metab Brain Dis,2013,28:321-326.
4 Scarpellini E,Ianiro G,Attili F,et al.The human gut microbiota and virome:Potential therapeutic implications.Dig Liver Dis,2015,18:414-417.
5 Lozupone CA,Stombaugh JI,Gordon JI,et al.Diversity,stability and resilience of the human gut microbiota.Nature,2012,489:220-230.
6 Shimizu K,Ogura H,Goto M,et al.Synbiotics decrease the incidence of septic complications in patients with severe SIRS:a preliminary report.Dig Dis Sci,2009,54:1071-1078.
7 Petts DN.Colistin-oxolinic acid-blood agar:a new selective medium for streptococci.J Clin Microbiol,1984,19:4-7.
8 Salazar N,Ruas-Madiedo P,Kolida S,et al.Exopolysaccharides produced by Bifidobacterium longum IPLA E44 and Bifidobacterium animalis subsp.lactis IPLA R1 modify the composition and metabolic activity of human faecal microbiota in pH-controlled batch cultures.Int J Food Microbiol,2009,135:260-267.
9 Mittal R,Coopersmith CM.Redefining the gut as the motor of critical illness.Trends Mol Med,2014,20:214-223.
10 van Nood E,Vrieze A,Nieumdorp M,et al.Duodenal infusion of donor feces for recurrent Clostridium difficile.N Engl J Med,2013,368:407-415.
11 Iskander KN,Osuchowski MF,Stearnskurosawa DJ,et al.Sepsis:multiple abnormalities,heterogeneous responses,and evolving understanding.Physiol Rev,2013,93:1247-1288.
12 Linde-Zwirble WT,Angus DC.Severe sepsis epidemiology:sampling,selection,and society.Crit Care,2004,8:222-226.
13 Tang BM,Eslick GD,Craig JC,et al.Accuracy of procalcitonin for sepsis diagnosis in critically ill patients:systematic review and meta-analysis.Lancet,2007,7:210-217.
14 Shimizu K.Altered gut flora are associated with septic complications and death in critically ill patients with systemic inflammatory response syndrome.Dig Dis Sci,2011,56:1171-1177.
15 Shimizu K.Probiotic/synbiotic therapy for treating critically ill patients from a gut microbiota perspective.Dig Dis Sci,2013,58:23-32.
16 Khailova,L.Probiotic administration reduces mortality and improves intestinal epithelial homeostasis in experimental sepsis.Anesthesiology,2013,119:166-177.
17 Eaves-Pyles T,Alexander J.Rapid and prolonged impairment of gut barrier function after thermal injury in mice.Shock,1998,9:95-100.
18 De-Souza D,Greene L.Intestinal permeability and systemic infections in critically ill patients:effect of glutamine.Crit Care Med,2005,33:1175-1178.
19 Iskander KN,Osuchowski MF,Stearns-Kurosawa DJ,et al.Sepsis:multiple abnormalities,heterogeneous responses,and evolving understanding.Physiol Rev,2013,93:1247-1288.
20 蔡国龙,严静,邱海波.中国严重脓毒症/脓毒性休克治疗指南(2014):规范与实践.中华内科杂志,2015,6:484-485.
21 Lathrop SK,Bloom SM,Rao SM,et al.Peripheral education of the immune system by colonic commensal microbiota.Nature,2011,478:250-254.
22 Kawamoto S,Tran TH,Maruya M,et al.The inhibitory receptorPD-1 regulates IgA selection and bacterial composition in the gut.Science,2012,336:485-489.
23 Org E,Parks BW,Joo JW,et al.Genetic and environmental control of host-gut microbiota interactions.Genome Res,2015,10:41-47.
24 Sartor RB.Therapeutic manipulation of the enteric microtlora in innammatory bowel diseases:antibiotics,probioties troenterology,2004,126:1620-1633.
25 Backhed F,Ding H,Wang T,et al.The gut microbiota as an environmental factor that regulates fat storage.Proc Natl Acad Sci U S A,2004,101:15718-15723.
26 庞超,汪玉珍.肠道菌群与微生态制剂.河北医药,2015,37:108-110.
27 XU Ke,WEI Ping.The research progress of probiotics mechanism.Chin J Microecol,2009,21:90-92.
28 Canfora EE,Jocken JW,Blaak EE.Nat Rev Endocrinol.Short-chain fatty acids in control of body weight and insulin sensitivity.Nature Reviews Endocrinology,2015,128:156-120.
R 631.2
A
1002-7386(2015)23-3567-05
10.3969/j.issn.1002-7386.2015.23.015
050051 石家庄市,河北省人民医院急诊科(李素彦、徐鑫、赵茜、李建国),心脏内科(郝清卿);河北省博野县医院老年病科(杨运强)
2015-06-30)

