尿素酶在眼组织中的表达及泪膜尿素减少与干眼症的关系分析
马丽秀 韩福胜 李月光 屈超 刘桂莲
尿素酶在眼组织中的表达及泪膜尿素减少与干眼症的关系分析
马丽秀 韩福胜 李月光 屈超 刘桂莲
目的 探讨尿素酶在泪腺和眼表组织表达,尿素是组成泪膜重要组成成分。方法 选取2011年3月至2013年3月20例干眼症患者,58例正常患者。通过RT-PCR和免疫组化染色测定泪腺和眼表组织尿素酶(精氨酸酶-1,2和鲱精胺酶)表达。共收集38例眼泪、房水、血清样本。结果 精氨酸酶-1,2和鲱精胺酶在所有眼组织表达,除精氨酸酶-1在角膜无表达。眼泪尿素浓度与房水和血清尿素浓度无相关性(r=0.13,P=0.58;r=0.45,P=0.05),房水尿素浓度与血清尿素浓度具有明显相关性(r=0.7,P=0.0001)。干眼症眼泪尿素浓度明显低于正常对照组(P<0.0001)。结论 眼泪中尿素酶能够独自生成尿素,使尿素浓度维持泪膜结果具有重要作用。
干眼症;尿素酶;免疫组化;PCR
任何疾病和损伤累及眼泪分泌功能均能使泪膜不稳定最终导致干眼症。干眼症发病是从轻微眼睛不适到严重视力障碍和角膜溃疡渐进的过程。从流行病学显示,干眼症是一种常见病,尤其好发于老年人群,45岁以上患者发病率在20%[1]。虽然干眼症可能因眼泪房水不足引起(房水不足干眼症),但最有可能是眼泪过度分泌有关(蒸发性干眼症)[2]。眼板腺功能障碍即弥漫性异常,被认为是干眼症最常见病因,也可能是无临床表现眼睑感染,目前对干眼症治疗方法较多,如人工眼泪,微脂肪喷雾剂,这些治疗方法主要阻止角膜和结膜脱水和减轻患者临床表现。慢性肾衰和糖尿病可能与干眼症治病条件有关,常伴有血清尿素的变化[3]。尿素在眼泪中作用,到目前为止研究较少。在眼泪中,尿素有助于泪膜脂质双重结构形成。本文通过测定正常人和干眼症患者眼泪、血清和房水中尿素浓度,进一步评估尿素在干眼症患者中作用。
1 资料与方法
1.1 一般资料 连续性收集我院2011年3月至2014年3月干眼症患者20例,正常健康体检者58例。根据中国眼科协会指导方针对所有患者进行一般眼科学检查。后询问患者病史和填写调查表。采用裂隙灯检查眼前半段包括平行于睑缘的结膜皱褶,眼透镜识别、眼角泡沫覆盖物形态学检查、荧光染色观察破裂膜时间、眼泪分泌试验。对照组为无干眼症症状、没有使用人工眼泪、没有滴用润滑剂和润湿剂,除白内障和屈光不正,无其他疾病。干眼症组通过眼科医师确诊为中度干眼症患者(非干燥综合征),且病史≥6个月及临床表现如烧灼痛、刺痛、视力模糊等≥3个月,另一方面,患有代谢性疾病和自身免疫性疾病(干燥综合征)排除研究。眼泪分泌试验采用细管收集眼泪,后离心,样本储存4℃,直到进行下一步检查。见表1。
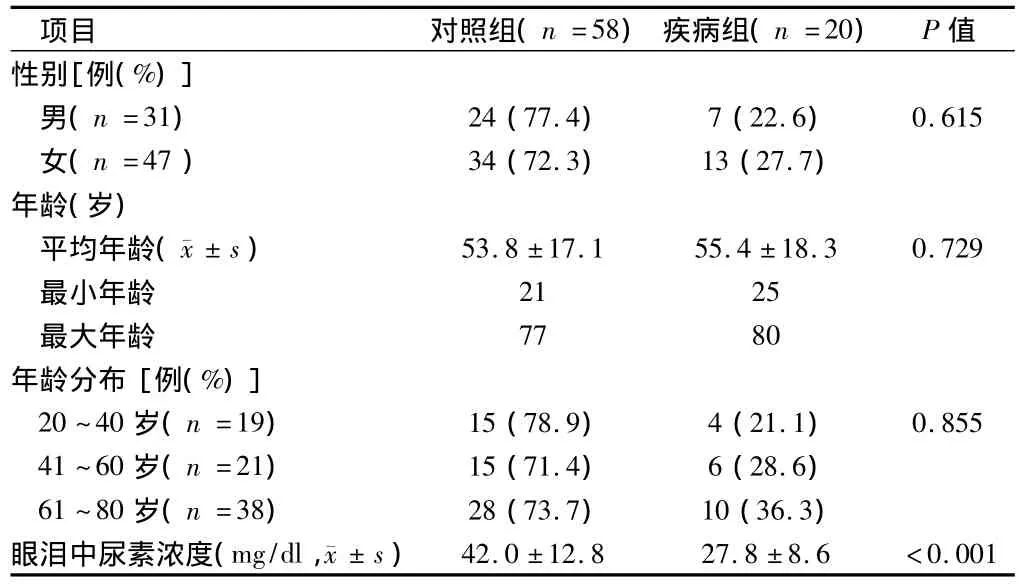
表1 2组患者一般资料
1.2 方法
1.2.1 采集眼泪、血和房水标本:38例患者进一步收集眼泪、血和房水标本,其中男19例,女19例;平均年龄74岁,除年龄相关白内障无其他眼疾病。使用27 g套管连接到一个注射器,由眼外科医生穿刺获得0.5~1.0 ml前方房水,在术前20~26 h收集同一个患者眼泪和血标本。
1.2.2 RNA制备和反转录DNA合成:使用传统RTPCR技术,从8例活检组织样本泪腺、结膜和角膜在液态氮低温下在玛瑙研钵中呈细粉末状,然后将5 ml RNA均匀地溶解在均质器中。不能溶解物质进行离心移除(12 000 g,5 min,4℃)。RNeasy-Kit盒分离出总RNA(北京美科美生物技术开发有限公司),异丙醇纯化RNA,酒精反复沉淀。通过RNase释放DNase I除去污染DNA(20 min,25℃北京美科美生物技术开发有限公司)。DNase酶在65℃加热15 min变性,RNA(500 ng)用于催化反应。应用50 ng/μl寡核苷酸15引发剂和(北京美科美生物技术开发有限公司)0.8 μl RNase H-逆转录酶(北京美科美生物技术开发有限公司)在37℃下60 min产生cDNA。
1.2.3 多聚酶链式反应(PCR):采用传统PCR,所用患者 1 μl cDNA 应用 13.7 μl H2O、1 μl 50 mmol/L MgCl2、0.5 μl dNTP、2 μl 10 × PCR 缓冲液、0.3 μl(5 U)Taq DNA聚合酶(北京美科美生物技术开发有限公司)及以下下每种引发剂各0.5 μl(100 pmol):人类精氨酸酶类型Ⅰ(ARG1):NM-000045.2(正义:CTT AAA GAA CAAGAG TGT GAT,反义:TTC TTC CTA GTA GATAGCTGA;退火温度58℃,产物550 bp),人类精氨酸酶类型Ⅱ(ARG2):NM-00117.2(正义:GACACT GCC CAG ACC TTT GT,反义:CGT TCC ATGACC TTC TGG AT;退火温度64℃,产物304 bp),人类精胺脲水解酶 (鲱精胺酶)(AGMAT):NM-024758.4(正义:CAG CTG GGC TGTATT CCT CTG,反义:TAT CTG TAG GGA TCC AAGGTC G:退火温度59℃,产物258 bp)进行孵化。
1.2.4 免疫组织化学和尿素浓度测定:应用免疫组化分析,甲醛固定泪腺上睑结膜和角膜组织、石蜡包埋。将石蜡标本制成4 μm厚切片,常规二甲苯脱蜡。应用多克隆兔反-精氨酸酶Ⅰ(1∶100,北京美科美生物技术开发有限公司)和反-精氨酸酶Ⅱ(1∶100,北京美科美生物技术开发有限公司),反-鲱精胺酶IgG(1∶100,Santa Cruz Biotechnology,USA)进行免疫组化染色。切片用胰岛素预先处理5 min,切片浸入1∶5三羟甲基氨基甲烷缓冲盐水溶液中,用山羊血清孵育,以阻断非特异性结合物。初级抗体室温下孵育整夜,次级抗体反-兔IgG(1∶300,北京美科美生物技术开发有限公司)孵育孵育至少4 h。过氧化物酶标记的抗生蛋白链菌素-生物素和二氨基联苯至少目测5 min。后用血补体复染,切片包埋。2个阴性对照组切片:一个仅用次级抗体孵育,另一个用初级抗体孵育。显微镜观察载玻片。应用商业有效尿素/铵试剂盒(北京美科美生物技术开发有限公司),根据操作说明检查眼泪、学、和房水尿素浓度。简单操作方法是尿素被尿素酶水解呈NH3和CO2。通过谷氨酸脱氢酶和烟酰胺腺嘌呤二核苷酸氧化使NH3和2-酮戊二酸生成L-谷氨酸。用吸收(光)谱法在340 nm测定烟酰胺腺嘌呤二核苷酸氧化作用(北京美科美生物技术开发有限公司)。
1.3 统计学分析 应用SPSS 17.0统计软件,计量资料以±s表示,采用t检验,计数资料采用χ2检验,应用Pearson相关分析眼泪、血和房水尿素浓度的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 眼组织中尿素酶mRNA表达 测定尿素酶直接涉及到尿素生成。通过RT-PCR分析泪腺、结膜、角膜细胞和人类角膜上皮细胞,发现精氨酸酶Ⅰ在泪腺和结膜表达,在角膜细胞和和人类角膜上皮细胞无表达。精氨酸酶-Ⅱ中mRNA和鲱精胺酶在泪腺、结膜、角膜细胞和和人类角膜上皮细胞都有表达。见图1。
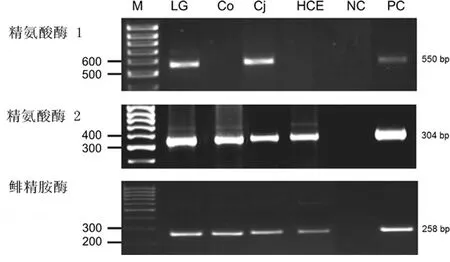
图1 尿素酶在眼组织中表达。通过RT-PCR分析尿素在泪腺(LG)、结膜(Co)、角膜细胞(Cj)和人类角膜上皮细胞(HCE)表达;NC、PC分别代表阴性和阳性表达
2.2 眼组织中精氨酸酶-Ⅰ、Ⅱ和鲱精胺酶蛋白表达应用免疫组化评估尿素酶在眼组织表达水平,精氨酸酶-1催化水解L-精氨酸生成L-鸟氨酸和尿素,尿素在人类腺泡细胞。结膜上皮细胞表达,但在角膜细胞无表达(角膜上皮、角膜细胞、内皮细胞)。精氨酸酶-Ⅰ在人类上皮细胞无表达,然而精氨酸酶和鲱精胺酶蛋白在所有眼组织表达。精氨酸酶-2在泪腺腺泡细胞、结膜上皮细胞表达(杯状细胞无表达),而精氨酸酶-Ⅱ在角膜细胞和内皮细胞无表达。精氨酸酶-2蛋白在人类上皮细胞细胞质呈阳性表达。尿素酶在所有泪腺腺泡细胞无表达,仅有少量腺腺泡细胞发现尿素酶。鲱精胺酶蛋白在泪腺管上皮细胞中表达,在泪腺腺泡细胞无表达。在所有样本检查,鲱精胺酶在泪管上皮细胞质内表达,仅在上皮细胞表达。角膜细胞和内皮细胞表达阴性。鲱精胺酶在人类角膜上皮细胞表达阳性。精氨酸酶Ⅱ和鲱精胺酶在泪腺、结膜和角膜表达,而精氨酸酶-Ⅰ仅在泪腺和结膜表达,且免疫组化结果和 PCR结果一样。另外,精氨酸酶-脱羧酶mRNA在所有样本表达。见图2~4。

图2 免疫组化显示精氨酸酶-Ⅰ在泪腺和结膜表达;A精氨酸酶-Ⅰ在少泪腺腺泡细胞表达,B精氨酸酶-Ⅰ在结膜上皮细胞表达,C精氨酸酶-Ⅰ在角膜上皮细胞和基质呈阴性表达,D精氨酸酶-Ⅰ不存在角膜及在人类角膜上皮细胞呈阴性表达

图3 免疫组化显示精氨酸酶-Ⅰ在泪腺、角膜和结膜表达;A精氨酸酶-Ⅱ在腺腺泡质表达,B精氨酸酶-Ⅱ在结膜上皮细胞表达,C精氨酸酶-Ⅱ在角膜上皮细胞和基质呈阴性表达,D精氨酸酶-Ⅱ角膜表达及在人类角膜上皮细胞呈阳性表达

图4 免疫组化显示鲱精胺酶在泪腺导管、角膜和结膜表达;A鲱精胺酶在腺腺泡细胞无表达,B鲱精胺酶在泪腺导管细胞表达,C鲱精胺酶在结膜上皮细胞表达,D角膜上皮细胞和基质表达,E鲱精胺酶在角膜内皮细胞表达,F鲱精胺酶在人类角膜上皮细胞呈阳性表达
2.3 白内障手术患者尿素在眼泪、房水和血清中的浓度相关性分析 尿素在泪膜、房水和血清平均分别为(60.0 ± 25.9)mg/dl、(41.7 ± 19.9)mg/dl、(49.1 ±25.9)mg/dl。眼泪和房水尿素浓度无相关性(r=0.13,P=0.58),眼泪和血清中尿素无相关性(r=0.45,P=0.05)。但房水和血清中尿素具有明显相关性(r=0.7,P=0.0001)。
2.4 尿素在干眼症患者眼泪中减少情况 检测干眼症患者和对照组眼泪中尿素浓度比较,干眼症患者眼泪尿素浓度(27.8±8.6)mg/dl明显低于健康对照组(42.0±12.8)mg/dl(P <0.01)。
3 讨论
尿素是蛋白质和氨基酸降解最终产物,从而半胱氨酸和L-精氨酸有重要作用。L-亮氨酸通过两种途径代谢为尿素,一为精氨酸通过精氨酸酶代谢为尿素和L-亮氨酸,另一为精氨酸脱羧酶代谢为胍基丁胺,然后通过鲱精胺酶转化为四甲烯二胺和尿素[4]。精氨酸酶有两组亚型:精氨酸酶-1和精氨酸酶-2,两者催化同一化学反应。组织中缺乏其他鸟氨酸循环酶时精氨酸酶2表达[5]。相关文献报道,尿素是鸟氨酸循环氮化合物产物,90%有肾脏排泄,其他有汗液或小肠排泄。尿素不仅是代谢废物,而且能够提供结合水的亲水部分,确保细胞膜脂质双层结构。尿素本身没有表面活性,然而通过表面结合蛋白影响分子表面[6]。尿素不足可能引起各种皮肤疾病。在细胞角化中,尿素是通过特殊氨基酸和部分精氨酸降解。某中角化状态下,伴有精氨酸不足时,这样使尿素浓度明显减少,皮肤保留水分功能降低。已有研究发现尿素浓度与干皮肤有关,其尿素浓度低于正常人大约50%[7]。
许多疾病能够增加尿素浓度如慢性肾功能衰竭和代谢性疾病常,它们与干眼症疾病相关[8]。虽然在1930年知道尿素是泪膜组成成份,但没有进一步研究尿素生理和病理功能,很少报道眼表尿素复合物是来自 L-精氨酸两种不同酶途径生成的[9]。Iyer等[10]确认人类鲱精胺酶,研究发现在不同人种和鼠类人类和鲱精胺酶mRNA和蛋白表达不同。本试验检测人类泪腺和眼表组织鲱精胺酶表达,同时显示mRNA和蛋白表达水平。Farkas等[11]第一次在人眼泪检测到精氨酸酶-1,2,但没有报道这些酶在眼组织细胞中表达作用。本研究显示泪腺腺泡细胞和结膜上皮细胞表达精氨酸酶-1,2。精氨酸酶-2也在角膜上皮表达。研究报道,精氨酸酶-1,2在鼠类角膜组织表达,但没有叙述炎症变化过程[12]。
这三种酶生成的尿素在伤口愈合、细胞生长代谢过程也起重要作用[13]。在前文尚未讨论尿素在泪膜的作用。本研究检测尿素在泪膜、房水、血清浓度,发现房水尿素浓度与血清尿素浓度具有相关性,然而泪膜与血清或房水尿素浓度无相关性。这表明泪膜尿素分泌独立于血清尿素浓度。可能眼泪和血液之间具有屏障,阻滞尿素通过,另外眼泪、房水和血液尿素浓度相似或他们之间相互作用。
肾功能不全疾病常伴有血液中尿素积累,可能导致屏障破坏,也可能代谢性疾病增加尿素转运体表达,为了加速尿素毒物从人体排除。积累尿素可能从血液通过泪膜[14]。是否减少干眼症泪膜中尿素含量,对泪膜稳定性非常重要。然而在泪膜中尿素与皮肤中尿素功能相似。尿素可能形成泪膜和其他组织的脂质层,然而泪膜脂质层主要由睑板腺组成,明显不同于皮肤脂质层,睑板腺主要脂质类型是由脂肪酸、脂肪醇、长链脂肪酸、酒精、胆固醇和其他少量脂类组成,尚不清楚磷脂是否睑板腺组成成分[15]。然而,尿素在泪膜脂质层形成具有重要作用,尿素能使组织细胞间脂质具有亲水性,形成膜状结果。减少尿素浓度可能导致泪膜脂质层分裂,表面张力减小,泪膜开始蜕变,导致干眼斑。增加尿素浓度如代谢性疾病或肾功能不全患者,可能导致表面活性减少[16]。通过结合表面活性蛋白如存在于泪膜活性蛋白B和C尿素能够通过构型变化特点改变表面活性蛋白结构[17]。结果可能减少表面张力和泪膜开始破裂,导致干眼症。
在代谢性疾病中,尿素弥漫性增加可能是通过改变尿素转运体表达催化作用,引起尿素在眼泪中浓度增加,导致泪膜不稳定。另一方面,如果无代谢性疾病,泪腺功能中缺乏尿素复合物可能导致眼泪尿素浓度减低,泪膜不稳定。所以尿素稳态对于泪膜物理化学性质非常重要,必要平衡稳定。眼泪尿素浓度是诊断干眼症重要指标,同时加上其他诊断方法(眼泪分泌时间、泪膜破裂时间)更好确定干眼症诊断。然而考虑到代谢性疾病能够影响血清尿素浓度,评估在眼泪中增加尿素是治疗干眼症较为适合的方法。
1 Schaumberg DA,Sullivan DA.Prevalence of dry eye syndrome among US women.Am J Ophthalmol,2003,136:318-326.
2 Moss SE,Klein R,Klein BE.Prevalence of and risk factors for dry eye syndrome.Arch Ophthalmol,2000,118:1264-1268.
3 Akinci A,Cakar N,Kara N,et al.Ocular findings in children with chronic renal failure.Cornea,2009,28:5-6.
4 Mistry SK,Burwell TJ,Chambers RM,et al.Cloning of humanagmatinase.An alternate path for polyamine synthesis induced in liver by hepatitis B virus.Am J Physiol Gastrointest Liver Physiol,2002,282:G375-G381.
5 Di Costanzo L,Moulin M,Haertlein M,et al.Expression,purification,assay,and crystal structure of perdeuterated human arginase I.Archives of biochemistry and biophysics,2007,465:82-89.
6 Jessberger B.Therapy of the symptoms of“dry skin”.Z Hautkr,1988,63:12-15.
7 Wellner K,Fiedler G,Wohlrab W.Untersuchungen zum Harnstoffgehalt der Hornschicht bei Neurodermitis.Z Hautk,1992,67:648-650.
8 Umathe SN,Kochar NI,Jain NS,et al.Gastrointestinal dysfunction in diabetic rats relates with a decline in tissue Larginine content and consequent low levels of nitric oxide.Nitric Oxide,2009,20:129-133.
9 Ridley F.The intraocular pressure and drainage of the aqueous humour.Brit J Exp Path,1930,11:217-240.
10 Iyer RK,Kim HK,Tsoa RW,et al.Cloning and characterization of human agmatinase.Mol Genet Metab,2002,75:209-218.
11 Farkas A,Vámos R,Bajor T,et al.Utilization of lacrimal urea assay in the monitoring of hemodialysis:conditions,limitations and lacrimal arginase characterization.Exp Eye Res,2003,76:183-192.
12 Mistry SK,Zheng M,Rouse BT,et al.Induction of arginases I and II in cornea during herpes simplex virus infection.Virus Res,2001,73:177-182.
13 Zhang W,Baban B,Rojas M,et al.Arginase activity mediates retinal inflammation in endotoxininduced uveitis.Am J Pathol,2009,175:891-902.
14 Klein JD,Blount MA,Sands JM.Molecular mechanisms ofurea transport in health and disease.Pflugers Arch,2013,464:561-572.
15 Butovich I.The Meibomian puzzle:combining pieces together.Prog Retin Eye Res,2009,28:483-498.
16 Caballero-Herrera A,Nordstrand K,Berndt KD,et al.Effect of urea on peptide conformation in water:molecular dynamics and experimental characterization.Biophys J,2005,89:842-857.
17 Bruer L,Brgermann J,Johl M,et al.Detection and localization of the hydrophobic surfactant proteins B and C in human tear fluid and the human lacrimal system.Curr Eye Res,2007,32:931-938.
Expression of urease in ocular tissues and the correlation between the reduction of lacrimal film urea and xerophthalmia
MA Lixiu* ,HAN Fusheng,LI Yueguang,et al.*Department of Ophtalmology,Dachang Muslim PopulationAutonomous County,Hebei,Dachang 065300,China
Objective To investigate the expression of urea enzymes in lacrimal gland and ocular surface tissues,and urea is important component of lacrimal film.Methods Twenty patients with xerophthalmia from March 2011 to March 2013 were enrolled as observation group,and 58 healthy subjects were served as control group.The urease levels including arginase 1,2 and agmatinase in lacrimal gland and ocular surface tissues were detected by RT-PCR and immunohistochemistry.A total of 38 specimens were collected including tear fluid,aqueous humour and serum.Results The enzymes including arginase 1,2 and agmatinase were expressed in all the ocular tissues,except for arginase 1 without expression in cornea.The concentration of urea in tear fluid was not correlated to that in aqueous humour and serum(r=0.13,P >0.05;r=0.45,P=0.05),however,the concentration of urea in aqueous humour was closely related with that in serum(r=0.7,P=0.01).The concentration of urea in observation group was significantly lower than that in control group(P<0.01).Conclusion The urease in tear fluid can produce urea independently,which plays an important role in maintaining lacrimal film at a certain concentration of urea.
xerophthalmia;urease;immunohistochemistry;PCR
R 77
A
1002-7386(2015)23-3531-04
10.3969/j.issn.1002-7386.2015.23.003
065300 河北省大厂回族自治县人民医院眼科(马丽秀),骨科(韩福胜),耳鼻喉科(李月光),口腔科(屈超),中医科(刘桂莲)
韩福胜,065300 河北省大厂回族自治县人民医院;E-mail:1150648151@qq.com
2015-06-10)

