产气荚膜梭菌α-β2-ε 毒素融合蛋白在大肠杆菌中的表达及免疫原性研究
宫旭颖,葛俊伟,乔薪瑗,唐丽杰,姜艳平,崔 文,李一经
(东北农业大学 动物医学学院,黑龙江 哈尔滨 150030)
产气荚膜梭菌(Clostridium perfringens),又称魏氏梭菌(C.welchii),是一种重要的人兽共患病的病原体,广泛存在于自然界中,可以引起各种动物坏死性肠炎、肠毒血症以及人畜创伤性气性坏疽和人类食物中毒等[1]。该菌的致病因子是其所产生的外毒素,根据所产生的毒素类型,可分为A、B、C、D、E 5 个菌型[2],目前,已发现的外毒素至少有13种,其中α、β、ε 和ι 是主要的外毒素[3-4]。
α 毒素(Alpha toxin,cpa)是各型产气荚膜梭菌产生的共同毒力因子;β2 毒素(Beta2 toxin,cpb2)由B 型和C 型菌产生,并且是主要的毒力因子之一;ε 毒素是D 型菌产生的主要毒素[5]。本研究以原核表达系统将产气荚膜梭菌这3 种毒素基因进行融合表达,通过对小鼠免疫试验证明表达的融合蛋白具备良好的免疫原性,并且对A 型和B 型产气荚膜梭菌毒素攻击均具有理想的保护效果,可以作为产气荚膜梭菌基因工程亚单位苗的候选蛋白。
1 材料和方法
1.1 菌株、质粒及实验动物 A 型和B 型产气荚膜梭菌强毒株购自中国兽医药品监察所;pMD18-T载体购自TaKaRa 公司;大肠杆菌BL21(DE3)、重组质粒pET-30b-α-β2、pET-32a-ε、表达载体pProHTa等均由本实验室构建或保存;清洁级6 周龄~8 周龄BALB/c 小鼠购自长春实验动物研究中心。
1.2 主要试剂 限制性核酸内切酶、Taq DNA 聚合酶、DNA Marker8000、dNTP、T4 DNA 连接酶、Protein Marker(116.0~18.4 ku)、HRP 标记的羊抗兔IgG(IgG-HRP)均购自TaKaRa 公司;兔源α 毒素多克隆抗体由本实验室制备。
1.3 引物设计及合成 根据pET-30b-α-β2 重组质粒的测序结果,设计合成一对扩增α-β2 基因引物P1/P2,序列为:5'-GGATCCTGATACAGATAATAA TTTC-3'(Bam H Ⅰ)/5'-GTCGAC CACATATGGACCTG GAC CTGCACCATACCCTTC-3'(SalⅠ),斜体部分为Linker。其中α 和β2 毒素基因已经分别引入点突变以去除其毒性[6]。并根据pET-32a-ε 重组质粒测序结果,设计合成一对引物扩增ε 基因的P3/P4 引物,序列为:5'-GTCGACAAGGAAATATCTAATAC-3'(SalⅠ)/5'-TCTAGA CACATATGGACCTGGACC TTTT ATTCCTG-3'(XbaⅠ),斜体部分为Linker。第106 位的组氨酸突变为脯氨酸[7]。
1.4 α-β2和ε 基因的扩增及重组表达质粒的构建分别以pET-30b-α-β2 和pET-32a-ε 为模板,P1/P2 和P3/P4 为引物,进行PCR 扩增。反应条件:95 ℃5 min;94 ℃1 min、56 ℃40 s、72 ℃100 s,共25个循环;72 ℃10 min。PCR 产物经纯化回收,经限制性内切酶消化,分别克隆于表达载体pProHTa 中构建融合表达3 种毒素基因的重组表达质粒pPro-α-β2-ε,并转化于BL21(DE3)受体菌中。
1.5 α-β2-ε 融合蛋白的诱导表达及鉴定 将重组菌接种于含100 μg/mL 氨苄抗性的LB 液体培养基中,37 ℃培养至OD600nm约为0.6~0.8 时,加入IPTG 至终浓度为1 mmol/L,37 ℃摇床220 r/min 诱导4 h 后,经SDS-PAGE 检测融合蛋白。并转印于NC 膜,以产气荚膜梭菌α 毒素多克隆抗体为一抗,羊抗鼠IgG-HRP 为二抗,DAB 显色,进行western blot 鉴定。
1.6 包涵体粗提物的制备 经IPTG 诱导的pPro-α-β2-ε/BL-21(DE3)培养物离心收集菌体,重悬于50 mmol/L Tris·HCl 22 mmol/L EDTA 中,加入溶菌酶至终浓度100 μg/mL,再加入0.5 mL 1 % Triton X-100,于30 ℃温育15 min。再经超声波裂解10 min后,12 000 r/min 离心15 min,收集沉淀物。
1.7 免疫保护试验
1.7.1 产气荚膜梭菌毒素绝对致死量(LD100)的测定取过夜培养的上清液,浓缩过滤除菌,以灭菌生理盐水10 倍稀释,以40 μL、50 μL、60 μL、70 μL、80 μL 剂量分别腹腔注射小鼠5 只,观察小鼠死亡情况,以确定A 型和B 型产气荚膜梭菌的小鼠LD100。
1.7.2 免疫保护试验 将重组菌株表达蛋白包涵体粗提物100 μL,加等量的不完全弗氏佐剂乳化后腹腔免疫小鼠30 只,每只0.2 mL,14 d 后以完全弗氏佐剂乳化的相同剂量蛋白进行加强免疫,第二次免疫后14 d 每组小鼠分别腹腔接种1 LD100、2 LD100不同致死剂量的A 型产气荚膜梭菌和B 型产气荚膜梭菌培养上清液。同时设立生理盐水对照组。
1.7.3 体外中和试验 参考文献[8]的方法,取A型及B 型产气荚膜梭菌培养上清液用于中和试验,取二免14 d 采集的抗α-β2-ε 的免疫鼠血清,测定血清效价,60 ℃作用30 min,分别将2 LD100毒素与血清(分别按1∶5、1∶10、1∶15、1∶20、1∶25、1∶30稀释为200 μL)进行混合,37 ℃作用1 h 后,取100 μL分别腹腔注射5 只BALB/c 小鼠,无菌生理盐水及阴性血清作为对照。观察24 h 以上,记录各组小鼠死亡及存活情况。
2 结果
2.1 目的基因的扩增及重组表达质粒的构建 分别以pET-30b-α-β2 和pET-32a-ε 为模板,通过PCR 进行扩增,结果显示,α-β2 毒素基因片段大小约1600 bp,ε 毒素基因片段大小约900 bp,均与预期相符(图1)。利用3 种目的基因构建重组表达质粒pPro-αβ2-ε,Bam HⅠ和XhoⅠ酶切鉴定结果显示,目的片段约2 500 bp,与测序结果(2 541 bp)一致,表明该重组表达质粒构建正确。

图1 α-β2 及ε 基因PCR 产物Fig.1 PCR product of α-β2 gene and ε gene
2.2 目的蛋白表达的检测及鉴定 重组菌诱导表达后菌体经超声波处理,SDS-PAGE 分析表明,α-β2-ε 融合蛋白在大肠杆菌中以包涵体形式表达,其约90 ku,利用Image Lab 软件计算,α-β2-ε 融合蛋白的表达量占菌体总蛋白含量的18.4 %(图2A)。以产气荚膜梭菌α 毒素多克隆抗体对重组蛋白进行western blot 鉴定,结果显示,在约90 ku 处出现明显目的条带,表明重组蛋白可以被α 毒素多克隆抗体所识别(图2B)。
2.3 免疫保护试验结果 经测定,产气荚膜梭菌毒素A 型和B 型LD100分别为70 μL 和80 μL 培养上清液,以1 LD100、2 LD100不同剂量攻毒结果表明,免疫组在抵抗A 型产气荚膜梭菌培养上清液1 LD100剂量攻毒时,保护率为100 %(5/5),2 LD100攻毒保护率为60 %(3/5),而生理盐水对照组5 只小鼠全部死亡;B 型产气荚膜梭菌培养上清液1 LD100攻毒组保护率为100%(5/5),2 LD100攻毒组保护率为80%(4/5),而生理盐水对照组5 只小鼠全部死亡(表1)。

图2 表达重组蛋白的SDS-PAGE(A)和western blot(B)分析结果Fig.2 The expression of the recombinant protein analyzed and identified by SDS-PAGE(A)and western blot(B)
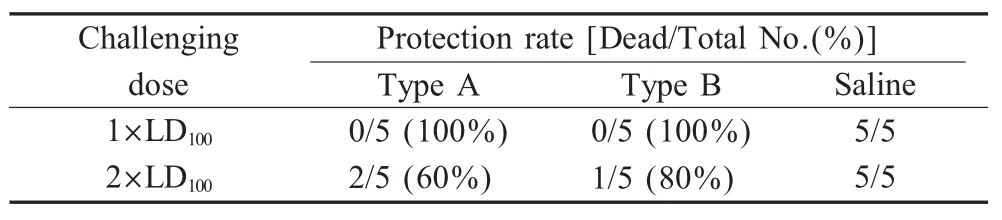
表1 融合蛋白对免疫鼠的A 型和B 型产气荚膜梭菌的攻毒保护试验Table 1 Protection of the mice immunized with the fusion protein against A and B type C.perfringens challenging
2.4 体外中和试验结果 经二次免疫制备的抗α-β2-ε 鼠血清经测定效价为218,按不同稀释度与2 LD100毒素进行混合腹腔接种小鼠。结果显示,特异性鼠血清稀释度为1∶5、1∶10、1∶15、1∶20 时,毒素中和效率为100 %,稀释度为1∶25 时对α 毒素中和效率为60%,对β2 及ε 毒素中和效率均为80%;稀释度为1∶30 时,对α 毒素中和效率为40 %,对β2 及ε 毒素中和效率为60 %(表2)。表明抗α-β2-ε鼠血清可以有效中和A 型及B 型产气荚膜梭菌所产生的毒素。

表2 免疫血清对毒素体外中和试验Table 2 Neutralization titers of serum from immunized mice against culture filtrate of C.perfringens type A and type B
3 讨论
目前,针对防治产气荚膜梭菌疾病主要致力于构建多价基因工程亚单位疫苗的研究。由于该菌感染导致的猝死症具有发病急、死亡快等特点,因此疫苗免疫作为该病的有效防控方法已经受到日益广泛的关注。曾瑾等构建了产气荚膜梭菌β2-β1 毒素融合基因[9];许崇波等构建了α-β1 融合基因[10]和α-β1-β2 融合基因[11],表达的融合蛋白免疫小鼠后,可抵抗1 MLD 的C 型产气荚膜梭菌(C59-44)毒素的攻击。Reza Pilehchian 等构建的β-ε 融合基因[12];Zeng 等构建了α-β1-β2 融合蛋白[8],均使实验动物获得有效的免疫保护作用。目前研究表明,以包涵体形式存在的重组菌株表达产物不具有毒素本身活性,却具有良好的免疫原性,可以有效刺激实验动物机体产生良好的免疫保护作用[13]。
本实验室已经克隆了α、β2、ε 毒素基因,并构建了α-β2 融合基因[14-15],而且α-β2 融合蛋白具有良好的免疫保护效果。在此基础上,本研究构建的α-β2-ε 融合基因,增加了新的毒力基因,针对产气荚膜梭菌的几种主要毒素,研制安全无毒性,并且具备良好免疫原性的重组基因工程亚单位疫苗。动物实验结果表明,免疫小鼠可以抵抗2 LD100的A型和2 LD100B 型产气荚膜梭菌毒素的攻击。而且,经二次免疫后特异性鼠血清效价高达218,其稀释度为1∶20 时,对A、B 型产气荚膜梭菌毒素的中和效率可达100 %。因此,体内和体外中和试验结果表明,本研究中重组大肠杆菌表达的α-β2-ε 融合蛋白,具有良好的免疫原性,可以作为基因工程疫苗的有效组分,为研制A 型和B 型产气荚膜梭菌基因工程亚单位疫苗候选菌株提供物质基础。
[1]Rood J I,Cole S T.Molecular genetics and pathogenesis of Clostridium perfringens[J].Microbiol Rev,1991,55(4):621-648.
[2]王娅,王淑兰.产气荚膜梭菌双圈溶血现象之培养及其毒素分析[J].微生物学免疫学进展,2007,35(4):22-23.
[3]李璐,赵宝华.产气荚膜梭菌主要致死性毒素的研究进展[J].畜牧与饲料科学,2011,32(4):94-97.
[4]Laetitia P,Maryse G,Michel R P,et al.Clostridium perfringens:toxinotype and genotype[J].Trends Microbiol,1999,7(3):104-110.
[5]Mariano E,Fernandez M,Osvaldo Z.Clostridium perfringens epsilon toxin is cytotoxic for human renal tubular epithelial cells[J].Hum Exp Toxicol,2011,30(4):275-282.
[6]王玉炯,许崇波,蒋玉文,等.产气荚膜梭菌β2 毒素基因的克隆及定点突变[J].中国生物制品学杂志,2004,17(6):348-350.
[7]Oyston P C,Payne D W,Havard H L,et al.Production of a non-toxic site-directed mutant of Clostridium perfringens epsilontoxin which induces protective immunity in mice[J].Microbiology,1998,144:333-341.
[8]Zeng Jin,Denga Guang-cun,Wang Jing,et al.Potential protective immunogenicity of recombinant Clostridium perfringens α-β1-β2 fusion toxin in mice,sows and cows[J].Vaccine,2011,29(33):5459-5466.
[9]曾瑾,王玉炯,谢琴,等.产气荚膜梭菌β2-β1 毒素融合基因重组菌株免疫原性研究[J].黑龙江畜牧兽医,2008,12;62-63.
[10]许崇波,许崇利,刘庆平,等.C 型产气荚膜梭菌α、β1毒素基因的融合[J].中国生物工程杂志,2005,25(5):71-74.
[11]许崇波,陈向东,许崇利,等.C 型产气荚膜梭菌α、β1、β2 毒素基因融合及免疫原性研究[J].浙江大学学报,2008,34(4):379-384.
[12]Reza P L,Mehdi S,Khosrow A.Expression of Clostridium perfringens epsilon-beta fusion toxin gene in E.coli and its immunologic studies in mouse[J].Vaccine,2013,31(32):3295-3299.
[13]Harlow E,Lane D.Antibodies;a Laboratory Manual[M].New York:Gold Spring Laboratory Press,1989.
[14]李晓静,夏春丽,李一经.产气荚膜梭菌α 毒素在干酪乳杆菌中的诱导表达及其小鼠口服免疫力[J].微生物学报,2009,49(8):1115-1120.
[15]王超.产气荚膜梭菌ε 毒素突变基因的表达及其抗体中和效价测定[J].中国预防兽医学报,2013,35(6):500-503.

