猪流行性腹泻病毒重组N蛋白间接ELISA检测方法的建立
姜艳平,姜新鹏,孙刘妹,赵广宇,崔 文,唐丽杰,乔薪瑗,李一经*
(1.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030;2.东北农业大学 园艺学院,黑龙江 哈尔滨 150030)
猪流行性腹泻病(Porcine epidemic diahorrea,PED)的病原为PED 病毒(PEDV),该病是以发病猪呕吐、腹泻和严重脱水为主要临床症状的猪肠道传染病[1-2]。2010 年后PED 在我国流行范围明显扩大,病原致病性也有增强趋势,是当前仔猪腹泻死亡的重要病因之一[3],2013 年该病在美国大范围暴发,并迅速蔓延至加拿大、墨西哥等国家[4]。导致猪腹泻疾病的病因有多方面,其临床鉴别非常困难,因此亟待建立一种能够快速检测PEDV 的临床检测方法。PEDV 为冠状病毒科冠状病毒属成员,其基因组编码4 个主要的结构蛋白(S、M、E、N)[5],其中核衣壳N 蛋白在冠状病毒中高度保守,在PEDV 的结构蛋白中所占比例最大,在猪感染PEDV 的早期,可以检测到抗N 蛋白的高水平抗体。PEDV 重组蛋白N作为诊断抗原在检测病毒感染及评价疫苗免疫效果中具有很高的应用价值[6]。因此,本研究以可溶性表达的重组N 蛋白作为检测抗原,建立检测PEDV血清抗体的间接ELISA 方法,为临床检测PEDV 感染及流行病学调查奠定基础。
1 材料和方法
1.1 重组菌、血清及临床样品 表达PEDV 重组N蛋白的重组大肠杆菌pProHTa-N/BL21(DE3)Lys 由本研究室构建;PEDV 人工感染猪血清、PEDV 康复猪血清、猪传染性胃肠炎病毒(TGEV)感染猪血清、猪轮状病毒(PRV)感染猪血清及健康猪血清均由本实验室制备保存。130 份临床血清及粪便样品由本实验室收集。
1.2 主要试剂 His Bind Purification Kits 购自Invitrogen 公司;HRP 标记山羊抗鼠IgG(IgG-HRP)及山羊抗猪IgG-HRP 购自北京中杉金桥生物技术有限公司;邻苯二胺(OPD)购自Sigma 公司。
1.3 重组蛋白的表达及纯化 根据文献[6]的方法利用重组大肠杆菌pProHTa-N/BL21(DE3)Lys 进行PEDV 的N 蛋白表达,参照蛋白纯化试剂盒说明书方法进行重组蛋白的纯化。并利用PEDV 阳性血清及山羊抗兔IgG-HRP 进行western blot 分析该纯化蛋白的免疫学活性[7]。
1.4 间接ELISA方法的建立
1.4.1 间接ELISA 反应条件的优化 以37 ℃1 h、37 ℃2 h 和4 ℃过夜共3 种不同的条件包被纯化的N 蛋白,确定最佳包被条件;采用方阵滴定法确定最佳蛋白包被浓度和最适血清稀释度;以不同浓度的脱脂奶粉封闭,确定最佳封闭液浓度及封闭时间;确定血清和酶标二抗最佳工作时间,确定底物最佳作用时间。判定标准为:阳性血清与阴性血清OD490nm的P/N 值最大的孔所对应的反应条件为ELISA 方法的最佳反应条件。其他步骤按常规ELISA 程序进行[7]。
1.4.2 间接ELISA 判定标准确定 按上述建立的间接ELISA 方法,对本实验室保存的36 份血清(已知PEDV 阴性)进行检测。每份样品重复3 孔,测定OD490nm值。按照统计学分析法,计算检测样品的平均值和标准差(SD),得出阳性临界值当检测样品OD490nm值时可在99.9 %的可信度上判定为阳性。
1.4.3 特异性试验 在相同条件下对PRV,TGEV的阳性血清进行检测,同时设PEDV 阴、阳性血清对照和空白对照。
1.4.4 敏感性试验 将PEDV 标准阳性血清从1∶100开始倍比稀释至1∶12 800,其余条件按最佳反应条件进行试验。
1.4.5 间接ELISA 重复性试验 批内重复试验:随机抽取6 份血清样品,使用同批次的酶标板,用间接ELISA 方法进行3 次检测。批间重复性试验:用3 块不同批次的酶标板同时检测6 份不同的血清样品,按优化的间接ELISA 方法进行检测。计算批内和批间变异系数,以检验其重复性
1.5 重组N蛋白与全病毒检测血清的效果比较分别以纯化重组N 蛋白和细胞培养的PEDV 为抗原,4 ℃包被过夜,检测已知的PEDV 阴、阳性血清。
1.6 临床血清样品的检测 根据本研究所建立的ELISA 检测方法,检测黑龙江省、吉林省5 个地区共130 份送检猪血清样品。同时利用RT-PCR 方法[8-9]检测相应猪粪便样品,计算符合率。
2 结果
2.1 重组蛋白制备及纯化 37 ℃条件下诱导重组菌pPRoHTa-N/BL21,其表达产物经SDS-PAGE 分析,表达的蛋白约为50 ku。纯化N 蛋白,并进行western blot 鉴定(图1)。采用紫外分光度计测蛋白浓度,测定蛋白浓度为0.254 mg/mL。
2.2 间接ELISA的建立及反应条件的确定 按照常规ELISA 方法建立检测抗PEDV 血清抗体的间接ELISA,并对各组分的浓度及反应条件采用方阵滴定法进行优化,结果如表1 所示。
2.3 间接ELISA判定标准 采取未感染PEDV 的猪血清36 份,经间接ELISA 方法进行检测,计算最终平均OD490nm值为0.087,标准差(SD)为0.03,按照公式:阴阳性临界值临界值为0.177。即当样品的OD490nm值≥0.177 为阳性,OD490nm值<0.177 为阴性(图3)。
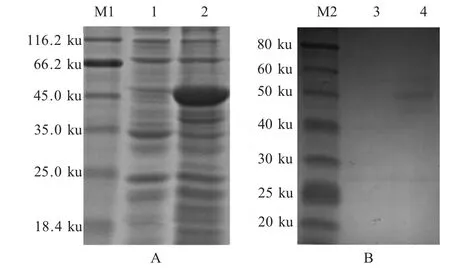
图1 重组蛋白表达的SDS-PAGE(A)、western blot(B)鉴定结果Fig.1 SDS-PAGE(A)and western blot(B)analysis of the recombinant protein

表1 间接ELISA 检测方法的反应条件优化结果Table 1 The optimized conditions of indirect ELISA
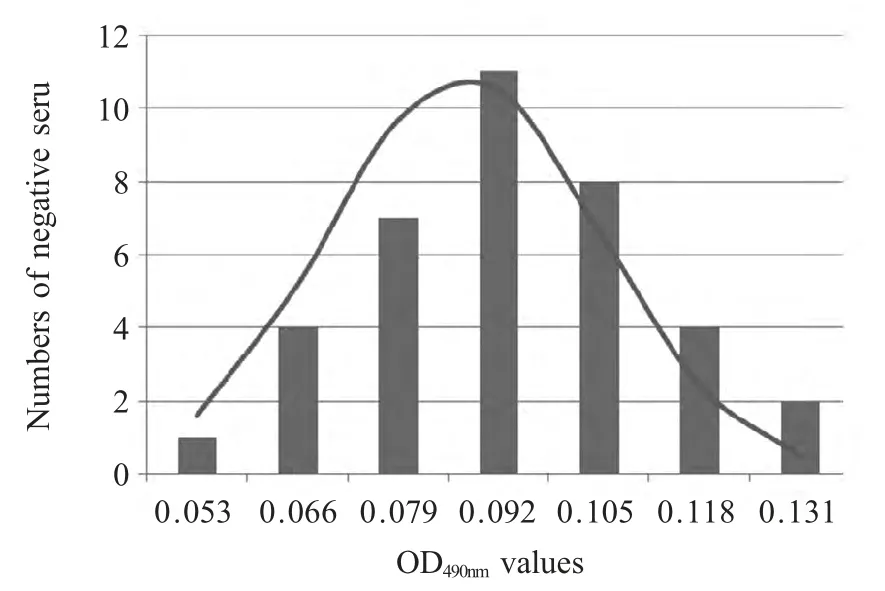
图3 阴性样品结果正态分布图Fig.3 Negative samples normal distribution diagram
2.4 特异性试验 利用建立的间接ELISA 方法对TGEV 阳性猪血清、PRV 阳性猪血清、正常健康猪血清进行检测,其OD490nm值均小于0.177,结果为阴性,表明该方法具有较好的特异性。
2.5 敏感性试验 将PEDV 阴性血清、阳性血清分别倍比稀释,采用建立的间接ELISA 方法进行敏感性检测,结果显示血清稀释度在1∶6 400 倍时为阳性,1∶12 800 倍时为阴性(OD490nm值<0.177),表明该方法具有较好的敏感性(图4)。
2.6 重复性试验 采用建立的间接ELISA 对6 份已知PEDV 阴阳性血清进行重复性试验,结果显示,批内和批间重复变异系数均小于10 %(表2)。结果表明,建立的间接ELISA 检测方法具有良好的重复性。
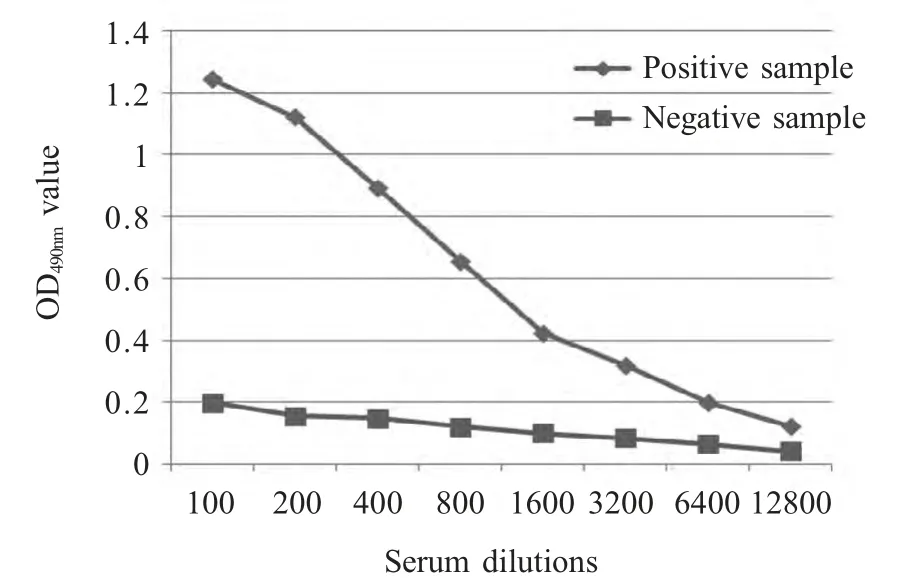
图4 间接ELISA 敏感性试验Fig.4 Sensitivity assay of the indirect ELISA
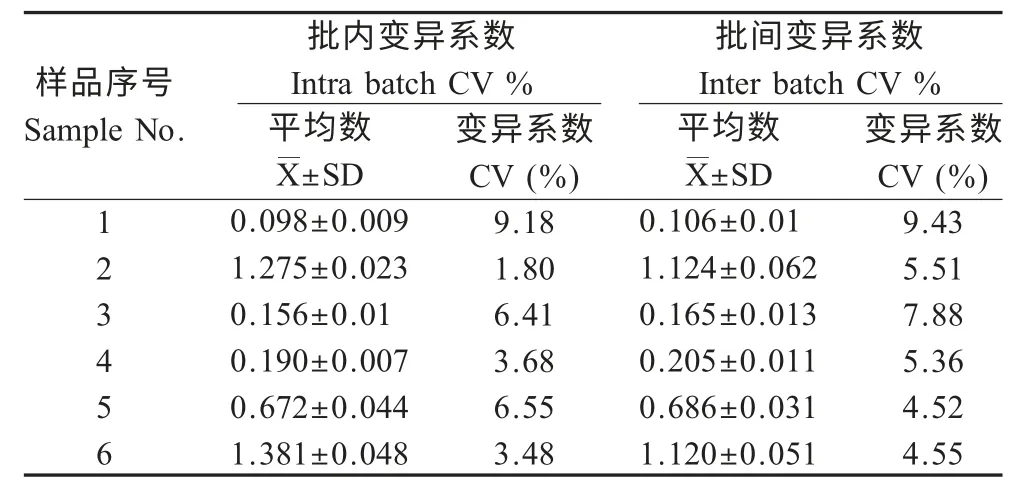
表2 间接ELISA 重复性试验Table 2 Repeatability assay for indirect ELISA
2.7 重组N蛋白与全病毒检测血清的效果比较在以细胞培养的PEDV 全病毒和重组N 蛋白为抗原,采用间接ELISA 检测已知阳性血清效果的比较试验中(表3),以PEDV 全病毒为抗原检测阳性血清的OD490nm为2.231,以重组N 蛋白为抗原检测阳性血清的OD490nm为1.264,但以重组N 蛋白为抗原的P/N 值达到10.1。结果显示,重组N 蛋白对检测PEDV 血清具有较高的敏感性。

表3 间接ELISA 比较重组N 蛋白与全病毒检测血清结果Table 3 The comparation of recombinant N protein and PEDV in indirect ELISA
2.8 临床样品的检测 采用建立的间接ELISA 检测PEDV 抗体的方法,检测了130 份临床血清样品,其中78 份为PEDV 抗体阳性,而RT-PCR 检测结果显示73 份样品为阳性结果。两种方法符合率为96.15 %。表明本实验建立的间接ELISA 方法可用于临床检测。
3 讨论
目前,我国尚无商品化PEDV 抗体检测试剂盒可供临床使用。本研究采用重组N 蛋白为包被抗原,建立检测血清抗体的间接ELISA 法,可以用于该病毒抗体检测和流行病学研究。
PEDV 感染谱窄,病毒适应细胞难,病毒繁殖滴度低,不利于大量制备诊断抗原,并且用细胞毒作为检测抗原,其中细胞成分会产生非特异性干扰,对抗体检测的特异性会产生影响[7]。N 蛋白是PEDV 的主要结构蛋白之一,在病毒RNA 合成过程中发挥重要作用,它能与细胞膜和磷脂结合,促进病毒组装和RNA 复制体的形成[10]。研究表明,冠状病毒N 蛋白是高度保守的,具有良好的免疫原性和反应原性,并且动物在感染的早期,体内就能产生抗N 蛋白的高水平抗体,在IBV、TGEV、SARSCOV 等冠状病毒研究中,均以重组N 蛋白建立了诊断方法[11]。
基于以上,本研究利用能够在大肠杆菌中稳定表达的可溶性重组N 蛋白作为检测抗原,建立间接ELISA 检测抗体的诊断方法,检测病猪血清中抗PEDV N 蛋白的抗体。本研究对ELISA 反应条件进行优化,以可溶表达的N 蛋白作为检测抗原,建立了PEDV 间接ELISA 抗体检测方法。实验结果表明该方法具有较好的敏感性、特异性和重复性;并且以N 蛋白为包被抗原检测PEDV 抗体的敏感性优于全病毒;该ELISA 方法检测了130 份临床样品,检测结果显示78 份血清中有PEDV 抗体,相应猪粪便样品检出阳性者为73 份,两者符合率为96.15 %。表明PEDV 融合蛋白N 作为诊断抗原在检测病毒感染及评价疫苗免疫效果中有较高的应用价值。
[1]倪艳秀,林继煌,何孔旺,等.猪流行性腹泻研究概况[J].畜牧与兽医,2001,33(1):38-40.
[2]李龙.仔猪流行性腹泻的最新流行情况[J].养猪,2011(5):87-88.
[3]任晓峰,贾文龙.猪流行性腹泻病毒S1 蛋白截短表达及多抗制备[J].东北农业大学学报,2013,44(9):46-50.
[4]Oka T,Saif L J,Marthaler D,et al.Cell culture isolation and sequence analysis of genetically diverse US porcine epidemic diarrhea virus strains including a novel strain with a large deletion in the spike gene[J].Vet Microbiol.2014,73(3-4):258-269.
[5]Bridgen,A,Duarte,M,Tobler K,et al.Sequence determination of the nucleocapsid protein gene of the porcine epidemic diarrhoea virus confirms that this virus is a coronavirus related to human coronavirus 229e and porcine transmissible gastroenteritis virus[J].J Gen Virol,1993,74(9):1795-1804.
[6]姜艳平,葛俊伟,汪淼,等.猪流行性腹泻病毒重组核蛋白作为检测抗原的初步应用[J].中国预防兽医学报,2008,30(8):587-591.
[7]J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯.分子克隆实验指南[M].金冬雁,黎孟枫,等.北京:科学出版社,1993.
[8]吴洋,杜彩虹,张博,等.猪腹泻相关病毒多重RT-PCR 检测方法的建立[J].中国预防兽医学报,2014,36(5):376-378.
[9]Sozzi E,Luppi A,Lelli D,et al.Comparison of enzyme-linked immunosorbent assay and RT-PCR for the detection of porcine epidemic diarrhoea virus[J].Res Vet Sci,2010,88(1):166-168.
[10]Knuchel M,Ackermann M,Muler H K,et al.An ELISA for detectionof antibodies against porcine epidemic diarrhea virus(PEDV)based on the specific solubility of the viral surface glycoprotein[J].Vet Microbiol,1992,32:117-134.
[11]Hou Xi-lin,Yu Li-yun,Lin Jian-zhu.Development and evaluation of enzyme-linked immunosorbent assay based on recombinant nucleocapsid protein for deteetion of porcine epidemic diarrhea(PEDV)antibodies[J].Vet Microbiol,2007,123(1-3):86-92.

