传染性法氏囊病病毒感染对鸡细胞模式识别受体及抗病毒基因转录的影响
欧阳伟,王永山,王晓丽,夏兴霞,潘群兴,毕振威,诸玉梅,董晨红,张海彬
(1.江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室/国家兽用生物制品工程技术研究中心,江苏 南京 210014;2.南京农业大学 动物医学学院,江苏 南京 210095;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(IBDV)引起的以侵害幼禽淋巴组织,特别是中枢免疫器官-法氏囊为主要特征的传染病。该病不仅引起患病动物死亡,而且还导致机体免疫抑制,使机体的免疫防御能力降低和对多种疫苗免疫接种失败。IBDV 在我国流行广泛并发生变异,出现了自然重配超强病毒株,现有的疫苗不能提供完全的免疫保护,给目前以疫苗免疫为主的IBD 防控措施提出了严峻的挑战[1-2]。因此,寻求IBD 防制新途径已成为鸡传染病防控中亟待解决的问题。
病原微生物感染宿主后,宿主细胞通过自身的模式识别受体(PRRs)识别病毒的病原相关分子模式(PAMPs),激活宿主的天然免疫应答,诱导产生I型干扰素、炎性细胞因子和趋化因子等免疫活性介质,同时也诱导树突状细胞的成熟,起始获得性免疫反应[3-5]。已发现的PRRs 被分为Toll 样受体(TLR)、RIG-I 样受体(RLR)、NOD 样受体(NLR)和C 型凝集素受体(CLR)等几种类型。
TLRs 家族由多个成员组成,在鸡细胞中已发现10 个TLRs 家族成员:TLR1La、TLR1Lb、TLR2a、TLR2b、TLR3、TLR4、TLR5、TLR7、TLR15 和TLR21[6-7]。在病毒感染时,TLR3 识别病毒双链RNA(dsRNA),TLR7、TLR8 识别病毒单链RNA(ssRNA),TLR2、TLR4 识别病毒蛋白(VP)[8]。TLRs在体内广泛表达,主要分布在细胞膜表面或吞噬泡膜上,这种分布特点使它们只能识别细胞外或经过吞噬进入细胞的PAMPs。
RLRs 家族有3 个成员:RIG-I、MDA5 和LGP2,同属于RNA 解旋酶家族[9-10]。RIG-I 和MDA5 是识别细胞内病毒核酸,激活干扰素系统的两个关键的PRRs。鸡源细胞缺乏RIG-I,其功能由MDA5 补偿[7-8,11]。LGP2 通 过ATP 酶结构域促进RIG-I 和MDA5 对病毒RNA 的识别,是RLR 介导抗病毒信号通路的调节因子[12]。TLRs 和RLRs 在细胞中的定位不同,在一定程度上形成互补作用,帮助宿主细胞更有效的抵御病毒的入侵。
天然抗病毒基因IPS-1(Interferon-β promoter stimulator 1)、IRF3(Interferon regulatory factor-3)、PKR(Double-stranded RNA-dependent protein kinase)、OAS(2',5'-oligoadenylate synthetase)以及Mx(Myxovirus resistance gene)在天然免疫应答信号转导中起着关键作用,IBDV 感染可以上调这些基因的表达[13-14]。
本实验以IBDV 为模式病毒,分析IBDV 感染对鸡细胞PRRs 识别及天然免疫抗病毒基因转录和信号转导作用的影响,为进一步研究鸡细胞PRRs介导的抗病毒天然免疫的分子调控机制奠定基础。
1 材料和方法
1.1 病毒株、细胞及主要试剂 IBDV 弱毒(B87株)鸡B 淋巴细胞传代细胞(DT40)适应株、IBDV 强毒(QL/12 株)和DT40 细胞均为本实验室保存;RNAiso Plus 购自TaKaRa 公司;5×All-In-One RT MasterMix(with AccuRT GenomicDNA Removal Kit)和EvaGreen 2×qPCR MasterMix 购自Abm 公司;T7 RiboMAX Express RNAi System 体外转录试剂盒购自Promega 公司;Lipofectamine RNAiMAX 购自Invitrogen 公司。
1.2 IBDV感染对DT40细胞PRRs及天然免疫抗病毒基因表达的差异分析 在病毒感染前一天预铺DT40 细胞于6 孔板,第2 d,每孔接种103TCID50的IBDV B87 株,在IBDV 感染后2 h、4 h、12 h 和24 h 4 个时间点分别收集细胞培养物,同时设立正常的DT40 细胞做对照。提取RNA,反转录合成cDNA,荧光定量(qRT-PCR)PCR 检测PRRs(TLR2、TLR3、TLR4、TLR7、MDA5 和LGP2)及天然免疫抗病毒基因(IPS-1、IRF3、PKR、OAS、Mx)的表达变化。
1.3 IBDV感染对鸡法氏囊组织细胞PRRs及天然免疫抗病毒基因表达的差异分析 将40 只4 周龄SPF 鸡随机分成2 组(QL/12 组25 只、空白对照组15 只);QL/12 组采用粘膜感染途径(眼、鼻、泄殖腔)人工感染IBDV,0.2 mL/只(病毒含量103EID50),隔离饲养。各组在IBDV 感染后2 h、4 h、12 h 和24 h 各取3 只鸡的法氏囊混合作为一个样品,qRT-PCR 检测PRRs(chMDA5、chTLR3 和chLGP2)及天然免疫抗病毒基因(IPS-1、IRF3、PKR、OAS、Mx)的表达变化。
1.4 chMDA5、chTLR3和chLGP2基因敲除对细胞天然免疫抗病毒基因表达的差异分析
1.4.1 siRNA 的分子设计 应用siRNA 在线设计软件(http://rnaidesigner.lifetechnologies.com/rnaiexpress/),针对chMDA5、chTLR3 和chLGP2 基因保守区分别设计了2 个siRNA(在siRNA 正义链序列的5' 端和反义链的3' 端分别加上T7 RNA 聚合酶启动子序列,使两者能够成为互补双链),在GenBank 中进行Blast 确认特异性;试验同时设计siRNA 阴性对照siRNACON。DNA 寡核苷酸由北京鼎国昌盛生物技术有限责任公司合成(靶向chMDA5、chTLR3 和chLGP2 基因siRNA 的序列信息如读者需要,作者可以提供)。
1.4.2 靶向chMDA5、chTLR3 和chLGP2 基因siRNA的转录合成 将合成的单链DNA 序列配对退火,分别得到正义和反义siRNA 转录模板。反应体系为:正义DNA 模板(100 pmol/μL)10 μL,反义DNA 模板(100 pmol/μL)10 μL,5×Oligo Annealing Buffer 20 μL,Nuclease-Free Water 60 μL,95 ℃5 min,室温退火30 min,制备双链DNA 模板。siRNA 的转录合成按T7 RiboMAX Express RNAi System 体外转录试剂盒说明书进行。
1.4.3 chMDA5、chTLR3 和chLGP2 基因敲除对细胞天然免疫抗病毒基因表达的差异分析 在转染前24 h,预铺DT40 细胞于24 孔板(每孔1×105个细胞),37 ℃5 % CO2培养。转染时,按照siRNALipofectamine RNAiMAX 试剂盒说明书进行。5 h后,弃去siRNA-Lipofectamine RNAiMAX 混合物,接种103TCID50的IBDV(B87 株),在感染后24 h 收集细胞培养物,qRT-PCR 检测天然免疫抗病毒基因(IPS-1、IRF3、PKR、OAS、Mx)的表达变化。
1.5 反转录和qRT-PCR 根据PRRs(TLR2、TLR3、TLR4、TLR7、MDA5 和LGP2)及天然免疫抗病毒基因(IPS-1、IRF3、PKR、OAS、Mx)和鸡β-actin 基因(作为内参对照)序列设计引物(引物序列信息如读者需要,作者可以提供),引物由北京鼎国昌盛生物技术有限责任公司合成。采用TRIzol 法提取法氏囊组织的总RNA,按照5×All-In-One RT MasterMix(with AccuRT GenomicDNA Removal Kit)使用说明进行反转录合成cDNA。以SYBR Green Ⅰ嵌合荧光法进行qPCR 扩增,进行相对定量分析。
2 结果
2.1 IBDV感染对DT40细胞PRRs及天然免疫抗病毒基因表达的差异分析 qRT-PCR 分析结果显示:chMDA5、chTLR3、chLGP2 在IBDV 感染后24 h 显著升高,分别升高324、22 和61 倍,而在其它3 个时间点差异变化不明显(图1A、B 和C);TLR4 和TLR7 在IBDV 感染后的4 个时间点未检测到(数据未提供)。IPS-1 在IBDV 感染后的4 个时间点差异变化均不明显(图1D);IRF3 和PKR 在IBDV感染后24 h 分别升高29 倍和16 倍,而在其它3 个时间点差异变化不明显(图1E、1F);OAS 在IBDV感染后2 h、4 h、12 h 和24 h 4 个时间点分别升高11、7、504 和225 000(图1G);Mx 在IBDV 感染后2 h、12 h 和24 h 的3 个时间点分别升高6、57 和18 700 倍,而在IBDV 感染后4 h 则降低了70 %(图1H)。
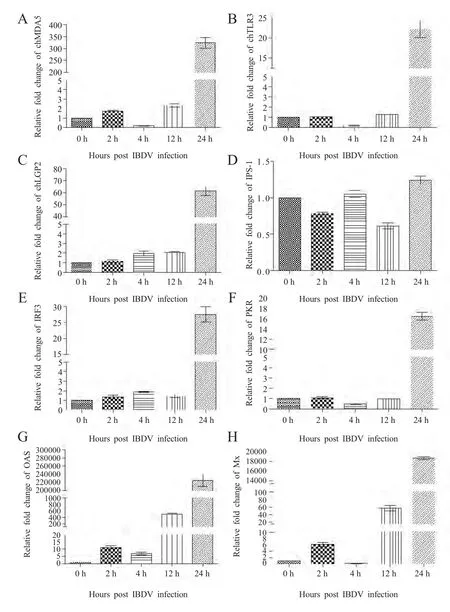
图1 qRT-PCR 检测DT40 细胞PRRs 及天然免疫抗病毒基因的表达变化Fig.1 Detection of PRRs and innate antiviral gene expressions in DT40 cells infected with IBDV by qRT-PCR
2.2 IBDV感染对鸡法氏囊组织细胞PRRs及天然免疫抗病毒基因表达的差异分析 qRT-PCR 分析结果显示:chMDA5、chTLR3 在IBDV 强毒感染SPF鸡后的4 个时间点均被显著抑制,而chLGP2 在IBDV强毒感染后的2 h、4 h、12 h 和24 h 分别升高1.1、1.3、1.8 和4.3 倍(图2A、B 和C);TLR4 和TLR7在IBDV 强毒感染后的4 个时间点未检测到(数据未提供)。IPS-1 在IBDV 强毒感染后的4 个时间点差异变化均不显著(图2D);IRF3 在IBDV 强毒感染后的2 h、4 h、12 h 和24 h 分别升高2.6、2.7、1.9和3.1 倍(图2E);PKR 在IBDV 强毒感染后的2 h、4 h、12 h 和24 h 分别升高2.3、2.4、1.3 和1.5 倍(图2F);OAS 在IBDV 强毒感染后的2 h、4 h、12 h和24 h 分别升高5.4、7.9、10 和49 倍(图2G);Mx在IBDV 强毒感染后的2 h、4 h、12 h 和24 h 分别升高15、9、7 和2 倍(图2H)。
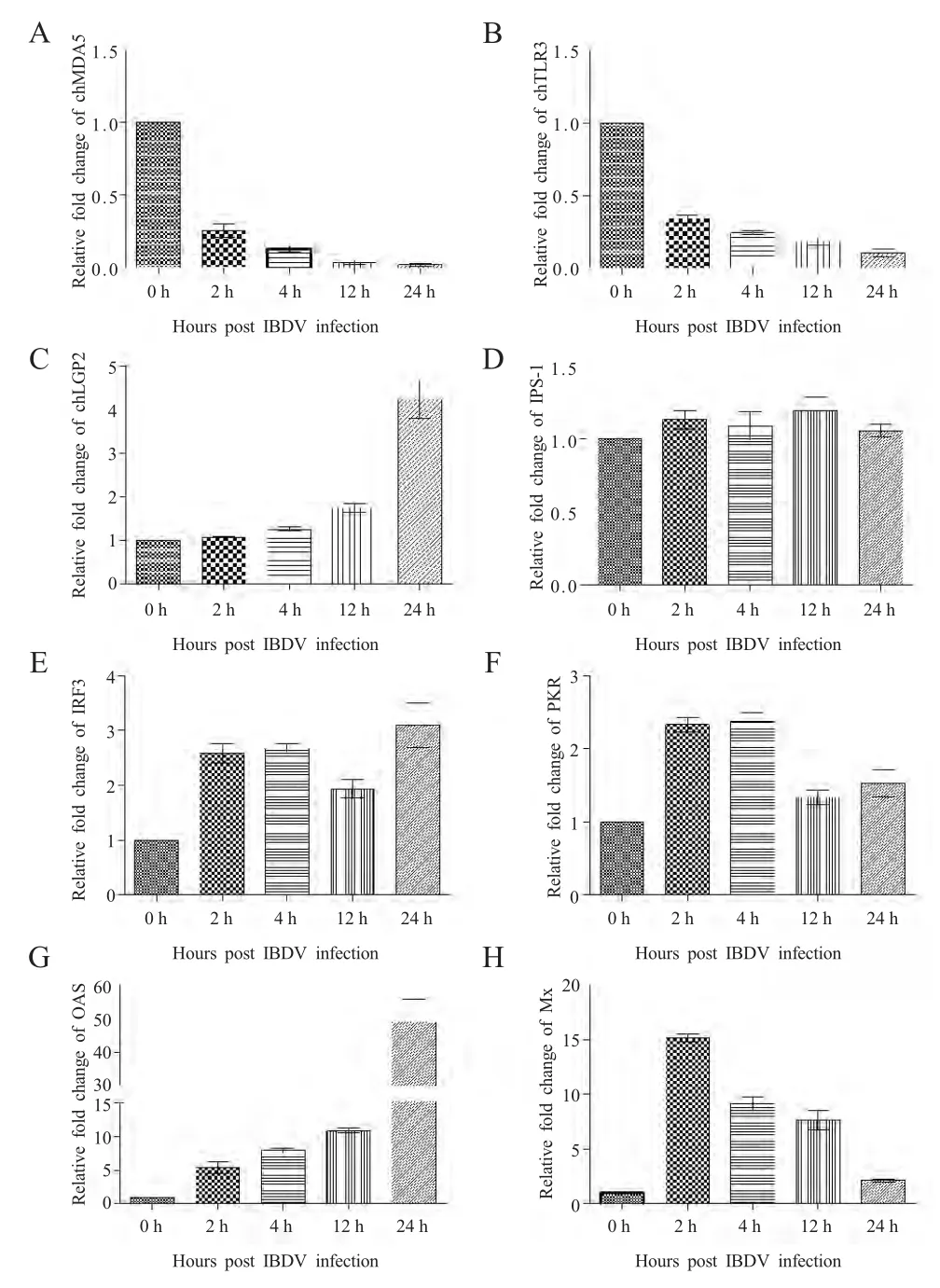
图2 qRT-PCR 检测法氏囊组织细胞PRRs 及天然免疫和抗病毒相关基因的表达变化Fig.2 Detection of PRRs and innate antiviral gene expressions in bursa of chickens infected with IBDV by qRT-PCR
2.3 chMDA5、chTLR3和chLGP2基因敲除对细胞天然免疫抗病毒基因表达的差异分析 chMDA5被敲除后,qRT-PCR 分析结果显示:IPS-1 的表达量下降了69 %,IRF3 的表达量下降了43 %,PKR 的表达量下降了48 %,OAS 的表达量下降了14 %,Mx 的表达量下降了20 %(图3A)。
chTLR3 被敲除后,qRT-PCR 分析结果显示:IPS-1 的表达量下降了58 %,IRF3 的表达量下降了52 %,PKR 的表达量下降了40 %,OAS 的表达量下降了54 %,Mx 的表达量下降了48 %(图3B)。
chLGP2 被敲除后,qRT-PCR 分析结果显示:IPS-1、IRF3、PKR、OAS、Mx 的表达变化,结果显示:IPS-1 的表达量下降了63 %,IRF3 的表达量下降了60 %,PKR 的表达量下降了50 %,OAS 的表达量下降了48%,Mx 的表达量下降了38%(图3C)。

图3 qRT-PCR 检测DT40 细胞中天然免疫抗病毒基因的表达变化Fig.3 Detection of innate antiviral gene expressions in si-chMDA5-,si-chTLR3-,or si-chLGP2-transfected-DT40 cells infected with IBDV by qRT-PCR
3 讨论
迄今,对鸡细胞PRRs 识别病毒PAMPs 启动天然免疫应答的信号转导通路只是大致的阐述[7],尚缺乏对其精确的分子调控机制方面的研究。为了全面分析IBDV 感染时,细胞天然抗病毒免疫应答的分子识别与作用机制,本研究采用了体内外两种感染模式,体外试验选用IBDV 感染DT40 细胞的方法,研究发现,在IBDV 感染靶细胞之后,chMDA5、chTLR3 和chLGP2 的表达水平显著升高,而其它几个模式识别受体表达差异不显著,提示这3个PRRs 在细胞识别IBDV 的感染中起着更关键的作用。对细胞中几个重要的天然免疫抗病毒基因分析,发现IPS-1 在IBDV 感染前后其表达水平比较稳定,差异变化不显著;而IRF3、PKR、OAS 和Mx 4 个抗病毒基因的表达水平在IBDV 感染后显著上升,表明IBDV 感染激活了靶细胞的抗病毒活性。
为进一步分析IBDV 体内感染对鸡体靶细胞PRRs 表达的影响是否与体外感染一致,体内实验采用IBDV 感染SPF 鸡方法,取靶器官法氏囊组织经qRT-PCR 检测,发现chMDA5 和chTLR3 的表达水平被显著抑制,这与IBDV 的体外感染检测结果不同;chLGP2 的表达水平显著升高,这与IBDV 的体外感染检测结果相同。表明在鸡体内识别IBDV 感染时,chLGP2 起着更关键的作用。对几个重要的天然免疫抗病毒基因检测发现,体内与体外的感染有相似之处,IPS-1 在IBDV 感染SPF 鸡前后其表达水平比较稳定,而IRF3、PKR、OAS 和Mx 的表达量均显著升高;但Mx 基因在IBDV 体内外感染前后的表达量差异尤为显著,在IBDV 感染细胞和SPF鸡的2 h 后,其表达量分别上升6 倍和15 倍,而在24 h 后,Mx 的表达水平比感染前分别高18 700 倍和2 倍。由此推测IBDV 在体内与体外感染时存在着不同的抗病毒免疫识别和信号转导分子机制。
为验证chMDA5、chTLR3 和chLGP2 在监测IBDV 感染中的作用。利用siRNA 分别敲除chMDA5、chTLR3 或chLGP2 时,发现天然免疫抗病毒相关基因(IPS-1、IRF3、PKR、OAS 和Mx)均表达下调,表明这3 个PRRs 在靶细胞抗IBDV 感染中发挥了重要的免疫识别与启动作用。Lee 等在研究中也发现,在敲除chMDA5 的DF-1 细胞中,IBDV 复制水平显著升高,这表明chMDA5 被敲除后,细胞监测识别病毒的能力减弱,从而导致细胞产生天然免疫抗病毒相关基因减少,其抗病毒能力被减弱,病毒复制增强[15]。
IBDV 体外感染细胞后,能够显著激活chMDA5、chTLR3 和chLGP2 的表达,但用IBDV 体内感染SPF 鸡后,却显著抑制了chMDA5 和chTLR3的表达,只能激活chLGP2 的表达,那么在鸡体识别IBDV 的感染中又是什么起到类似chMDA5 和chTLR3 的作用呢?是否是chLGP2 呢?这些均有待进一步研究。本研究结果是在用IBDV 弱毒和强毒分别感染细胞和SPF 鸡的实验条件下得出的结论,有必要进一步用IBDV 弱毒和强毒分别独立地进行体内外试验,以全面系统地解析IBDV 抑制鸡体天然抗病毒免疫的分子基础,深入研究鸡体天然抗病毒免疫的识别、启动与效应发生机制,这对抗病毒新型高效药物及疫苗的研发具有重要的科学价值。
[1]Mardassi H,Khabouchi N,Ghram A,et al.A very virulent genotype of infectious bursal disease virus predominantly associated with recurrent infectious bursal disease outbreaks in Tunisian vaccinated flocks[J].Avian Dis,2004,48(4):829-840.
[2]朱向东,王永山,欧阳伟,等.传染性法氏囊病病毒自然重配株全基因组序列分析[J].中国兽医学报,2014,34(2):219-226.
[3]Akira S,Uematsu S,Takeuchi O.Pathogen recognition and innate immunity[J].Cell,2006,124(4):783-801.
[4]Thompson A J,Locarnini S A.Toll-like receptors,RIG-I-like RNA helicases and the antiviral innate immune response[J].Immunol Cell Biol,2007,85(6):435-445.
[5]Kawai T,Akira S.Antiviral signaling through pattern recognition receptors[J].J Biochem,2007,141(2):137-145.
[6]Karpala A J,Lowenthal J W,Bean A G.Identifying innate immune pathways of the chicken may lead to new antiviral therapies[J].Vet Immunol Immunopathol,2012,148(1-2):100-109.
[7]Chen Shun,Cheng An-chun,Wang Ming-shu.Innate sensing of viruses by pattern recognition receptors in birds[J].Vet Res,2013,44:82-87.
[8]Lester S N,Li K.Toll-like receptors in antiviral innate immunity[J].J Mol Biol,2014,426(6):1246-1264.
[9]Kenny E F,O'Neill L A.Signalling adaptors used by Toll-like receptors:an update[J].Cytokine,2008,43(3):342-349.
[10]Matsumiya T,Stafforini D M.Function and regulation of retinoic acid-inducible gene-I[J].Crit Rev Immunol,2010,30(6):489-513.
[11]Karpala A J,Stewart C,McKay J,et al.Characterization of chicken Mda5 activity:regulation of IFN-{beta}in the absence of RIG-I functionality[J].J Immunol,2011,186(9):5397-5405.
[12]Satoh T,Kato H,Kumagai Y,et al.LGP2 is a positive regulator of RIG-I-and MDA5-mediated antiviral responses[J].Proc Natl Acad Sci U S A,2010,107(4):1512-1517.
[13]Li Yan-pei,Handberg K J,Juul-Madsen H R,et al.Transcriptional profiles of chicken embryo cell cultures following infection with infectious bursal disease virus[J].Arch Virol,2007,152(3):463-478.
[14]Wong R T Y,Hon C C,Zeng Fan-ya,et al.Screening of differentially expressed transcripts in infectious bursal disease virusinduced apoptotic chicken embryonic fibroblasts by using cDNA microarrays[J].J Gen Virol,2007,88(6):1785-1796.
[15]Lee C C,Wu C C,Lin T L.Chicken melanoma differentiation-associated gene 5(MDA5)recognizes infectious bursal disease virus infection and triggers MDA5-related innate immunity[J].Arch Virol,2014:1-16.

