支气管败血波氏杆菌Δhfq突变株构建及生物学特性分析
翟 莹,郭东春,王林柏,刘家森,田 进,刘春国,刘大飞,姜 骞,曲连东*
(1.东北农业大学 动物医学学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/自然疫源性人兽共患病创新团队,黑龙江 哈尔滨 150001)
支气管败血波氏杆菌(Bordetella bronchiseptica,Bb)可以引起猪的肺炎和萎缩性鼻炎,是猪呼吸道疾病的重要致病因子之一。Bb 的感染能够导致其它多种病原的继发感染,从而增加猪群呼吸道疾病的发病率和严重程度[1-2]。
Hfq 蛋白(Host factor for RNA phage Qβ replicase)是一个高度保守的RNA 结合蛋白,具有RNA 伴侣分子的活性,能够与富含A/U 的RNA 序列紧密结合[3]。已有研究表明,Hfq 是细菌中重要的转录调控因子,通过结合RNA 影响其稳定性或者是通过辅助sRNA 与mRNA 结合调节靶基因的表达[4],进而在包括致病在内的多个过程中发挥整体调控作用。Hfq 参与调节细菌的多种生命活动,影响细菌的毒力和对细胞侵袭力。在许多革兰氏阴性致病菌中,流产布氏杆菌[5]、脑膜炎奈瑟菌[6]及鼠伤寒沙门氏菌[7]等hfq 基因缺失后,细菌对小鼠的毒力作用明显减弱。此外,hfq 基因的缺失也可导致细菌对细胞的侵袭力降低,并在压力条件下生存能力发生改变。
本研究利用同源重组技术将卡那霉素抗性(Kan®)基因表达盒替换Bb 的hfq 基因构建Δhfq 突变株,并对突变株的生物学特性和对小鼠的致病性进行研究,为进一步研究Bb 致病机制奠定了基础。
1 材料和方法
1.1 菌株、质粒、细胞及实验动物 Bb122 株、自杀质粒pBC-SK、大肠杆菌DH5α 感受态细胞均由中国农业科学院哈尔滨兽医研究所自然疫源性人兽共患病研究室保存。清洁级BALB/c 小鼠、猪肺泡巨噬细胞3D4/2 由中国农科院哈尔滨兽医研究所提供。
1.2 主要试剂 Ex Taq DNA 聚合酶、T4 DNA 连接酶、限制性内切酶等均购自TaKaRa 公司;质粒小量提取试剂盒和DNA 凝胶回收试剂盒均购自AXYGEN 公司;胰蛋白胨大豆肉汤琼脂培养基(TSA)和胰蛋白胨大豆肉汤培养基(TSB)培养基购自BD 公司;常规细菌生化管购自杭州天和微生物试剂有限公司。
1.3 引物设计与合成 根据GenBank 中Bb3170 株hfq 基因序列(BX470250)设计扩增引物(表1),并由上海生工生物工程技术服务有限公司合成。
1.4 同源重组质粒pBC-hfq-Tn903的构建 采用常规煮沸法提取Bb122 株基因组DNA,并以其为模板。以Bb122 株基因组为模板,利用引物hfqF1/hfqR1 及hfqF2/hfqR2 分别扩增hfq 基因侧翼序列的DNA 片段。PCR 反应条件:94 ℃5 min;94 ℃30 s、53 ℃40 s、72 ℃90 s,32 个循环;72℃10 min。hfq 基因上游PCR 产物经SalⅠ/Bam HⅠ双酶切后克隆于pBC-SK 质粒,构建重组质粒pBC-hfqF1。hfq基因下游PCR 产物经Bam HⅠ/SacⅠ双酶切后克隆于pBC-hfqF1,构建重组质粒pBC-hfq。利用Bam HⅠ酶切质粒pBC-Tn903 将Kan®表达盒后克隆于pBChfq,构建重组质粒pBC-hfq-Tn903,并测序鉴定。
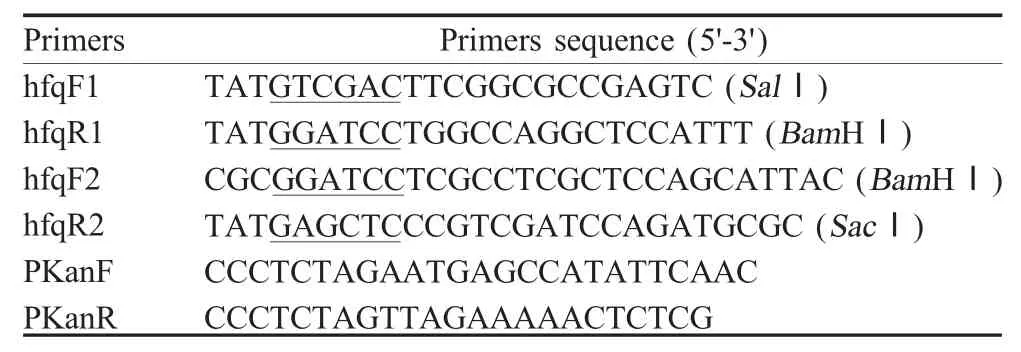
表1 本研究中所用引物Table 1 Primers in this study
1.5 Bb hfq基因突变株(BbΔhfq)的筛选及鉴定 按常规10 %甘油法进行电转化制备Bb122 株感受态细胞。将pBC-hfq-Tn903 加入到制备的Bb 电转化感受态细胞中,使用2.2 KV/cm,200 Ω 的条件进行电击,37 ℃复苏2 h~4 h 后涂布于50 mg/L Kan®的TSA 培养基上,筛选抗性菌株。将其接种到同时含有Cm 和Kan 抗性的培养基上,筛选获得BbΔhfq突变株,并采用pKanF/pKanR 引物对Kan®基因进行PCR 鉴定。
1.6 BbΔhfq突变株的生物学特性鉴定 BbΔhfq 突变株的生化试验按照细菌生化管说明书进行。亲本株和突变株在TSB 培养基中连续传代20 代,每隔5代进行Kan®基因检测,验证其遗传稳定性。亲本株和突变株在37 ℃培养过夜后,按照1∶100 的比例加入到新鲜的TSB 培养基中,37 ℃和42 ℃培养,每1 h 取样,测OD600nm值,绘制细菌体外生长曲线。
1.7 BbΔhfq突变株抗逆性试验 分别挑取亲本株和突变株单菌落,37 ℃培养过夜后,按照体积比1∶100 加入到无抗性TSA 培养基中,37 ℃,200 r/min振荡培养4 h~5 h,至OD600nm值达到0.5~0.6。各取1 mL 菌液分别在紫外线照射(UV)、50 ℃、H2O2(终浓度是200 mM)条件下处理10 min;分别对未处理和处理组进行细菌计数,重复3 次。
1.8 BbΔhfq突变株粘附与侵袭特性试验 粘附试验:在12 孔细胞培养板中3D4/2 细胞用无菌PBS洗涤3 次,将含10 %胎牛血清无双抗的的DMEM稀释的亲本株和突变株分别按照106cfu/孔接种细胞,于5 % CO2、37 ℃培养2.5 h。弃DMEM 培养基,用PBS 洗涤5 次。加100 μL 细胞消化液消化至细胞脱下,加入500 μL 2%TritonX-100 和400 μL无双抗的含胎牛血清10 %的DMEM 培养基,室温作用5 min 后进行细菌计数,每个样品3 个重复。
侵袭试验:将细菌接种到细胞粘附2.5 h 之后,PBS 洗涤,每孔加入含100 μg/mL 庆大霉素和氯霉素的10 %胎牛血清DMEM 培养基1 mL,5 % CO2、37 ℃培养2 h。其余操作与粘附试验相同。
1.9 BbΔhfq突变株致病性试验 将8 周龄~10 周龄的清洁级BALB/c 小鼠分为3 组,其中亲本株组和突变株组各5 只,对照组5 只。亲本株与突变株分别并按照2.0×109cfu/只剂量进行腹腔接种;对照组注射等体积的灭菌PBS。接种后每天记录小鼠的死亡数,并进行细菌分离鉴定,至接种后7 d 为止,剖检存活小鼠,观察组织病变,作细菌分离鉴定并计算肝脏的载菌量。
2 结果
2.1 重组质粒pBC-hfq-Tn903酶切鉴定结果 以提取的亲本株Bb122 株基因组为模板,通过特异性引物扩增亲本株hfq 基因的上下游相邻的两段DNA片段作为同源臂,大小分别约为700 bp 和500 bp,与预期片段大小一致。将其分别克隆于自杀质粒pBC-SK 中,构建含有Kan®表达盒的重组质粒pBC-hfq-Tn903。分别经酶切鉴定,结果与预期相符(图1)。
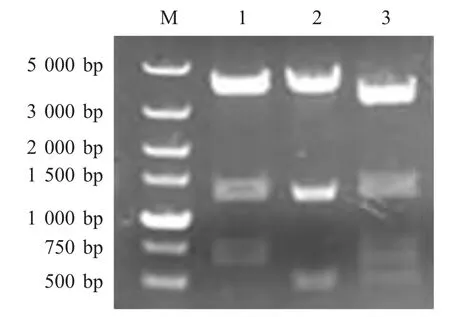
图1 pBC-hfq-Tn903 酶切鉴定结果Fig.1 Identification of pBC-hfq-Tn903 by digestions with restricted endonucleases
2.2 BbΔhfq突变株制备及PCR 鉴定结果 将pBC-hfq-Tn903 电转化于Bb122 株中,在Kan®平板上筛选Kan®菌落,分别在Kan®和CmS的TSA 平板上鉴定,筛选具有Kan®而CmS的菌株为同源重组菌株,即为构建的BbΔhfq 突变株。分别提取Bb122株和Δhfq 突变株的基因组DNA,利用PKanF/PKanR扩增Kan®基因,电泳检测表明:Δhfq 突变株的扩增片段约为750 bp,而Bb122 株的扩增结果为阴性,与预期相符(图2)。同时对BbΔhfq 突变株进行测序验证表明Kan®基因已替换hfq 基因,重组于Bb122 菌株基因组中。
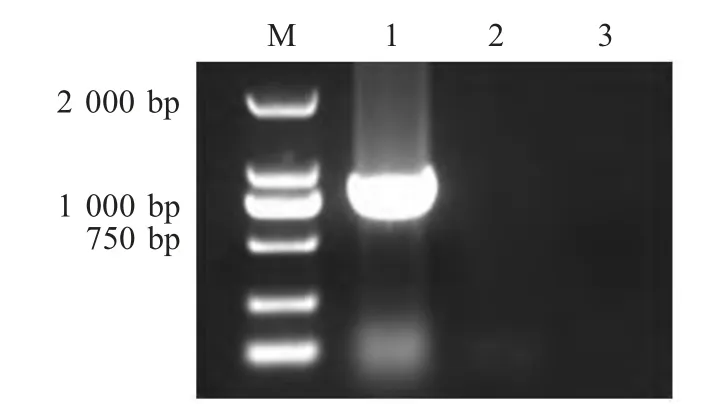
图2 Δhfq 突变株的PCR 鉴定Fig.2 Identification of Δhfq mutant by PCR
2.3 BbΔhfq突变株的生化鉴定结果 Bb122 株和Δhfq 突变株的生化结果表明:Bb122 株和Δhfq 突变株均不能发酵葡萄糖、山梨醇、甘露醇、蔗糖、果糖、半乳糖、麦芽糖和乳糖;硝酸盐还原试验、枸橼酸盐利用试验阳性;靛基质试验、吲哚试验和H2S 试验为阴性;M.R.试验和V.P.试验为阴性;不能液化明胶;尿素试验阳性。Bb122 株和Δhfq 突变株的生化特性未发生改变。
2.4 BbΔhfq突变株遗传稳定性检测结果 将Δhfq突变株在TSB 培养基中连续传代培养20 代,每隔5代收集菌体提取基因组,以引物PKanF/PKanR 扩增Kan®基因,突变株均能扩增出约750 bp 的Kan 基因片段,表明突变株具有良好的遗传稳定性。
2.5 BbΔhfq突变株体外生长特性检测结果 将Bb122 株与Δhfq 突变株接种于TSB 培养基,检测其生长特性,结果表明:在37 ℃培养时,Δhfq 突变株在1 h~6 h 生长速度基本和Bb122 株一致;在42 ℃培养时,Δhfq 突变株在1 h~6 h 生长速度快于亲本菌株Bb122 株;37 ℃比42 ℃更适合BbΔhfq的生长(图3)。
2.6 BbΔhfq突变株抗逆特性结果分析 Δhfq 突变株与Bb122 株在UV 照射条件下的存活率分别为34 %和82 %,差异显著(p<0.05);Δhfq 突变株和Bb122 株在高温50 ℃条件下的存活率分别为24 %和63 %,差异显著(p<0.05);在H2O2条件下,Δhfq突变株和亲本菌株Bb122 株的存活率均为零(图4)。结果表明:在UV 照射和50 ℃条件下,亲本株Bb122 株耐受能力强于Δhfq 突变株。
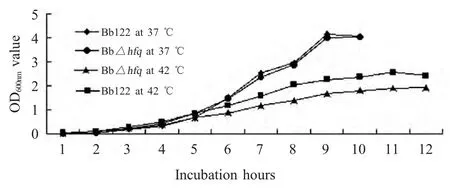
图3 Bb122 株和Δhfq 突变株的生长曲线Fig.3 Growth curve of Bb122 and Δhfq mutant
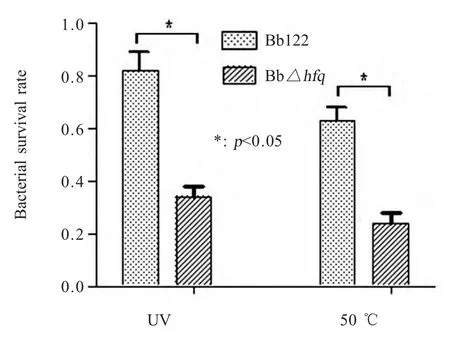
图4 Δhfq 突变株和亲本株Bb122 的抗逆性Fig.4 Stress tolerance of Δhfq mutant and Bb122 strain
2.7 BbΔhfq突变株的粘附和侵袭试验结果 Δhfq突变菌和亲本株Bb122 株对3D4/2 细胞的粘附分别为9.30±0.91×104cfu/孔和1.01±0.13×105cfu/孔,粘附效率分别为31 %和34 %;两者无明显差异。Δhfq 突变株和Bb122 株对3D4/2 细胞的侵袭分别为3.57±0.49×104cfu/孔和4.67±0.47×104cfu/孔,侵袭效率分别为12 %和16 %;两者无明显差异。根据试验结果分析表明,Bb122 株与Δhfq 突变株之间的粘附菌数与侵袭菌数差异不显著(图5)。
2.8 Δhfq对小鼠的致病性结果 将亲本株与突变株分别腹腔接种小鼠,以2×109cfu/只接种时,亲本株接种小鼠全部死亡,而突变株接种小鼠则全部存活。对照组也全部存活。结果表明:Δhfq 突变株与亲本株Bb122 株相比,毒力明显降低(表2)。按照2.0×109cfu 进行接种时,亲本株的肝脏载菌量为9.5×106cfu/g,突变株的肝脏载菌量为2.6×106cfu/g。

图5 Δhfq 突变株的粘附试验结果Fig.5 Adhesion and invasion of Δhfq mutant

表2 BbΔhfq 突变株对小鼠的致病性结果Table 2 Comparative virulence of Bb122 and Δhfq mutant strain as determined by intraperitoneal injection in mice
3 讨论
目前,商品化的Bb 疫苗主要为灭活苗,但其使用效果并不理想[8],这可能与Bb 灭活苗不能引起有效局部粘膜免疫和产生足够的保护性抗体IgA 有关。Bb 基因工程疫苗和亚单位苗以及活载体疫苗能够刺激机体产生良好的体液免疫和粘膜免疫[9-10]。
本研究在构建BbΔhfq 突变株中,主要采用正向筛选同源重组技术,将抗性基因插入到hfq 基因的上下游两个同源臂之间,通过同源重组,将抗性基因替换靶基因,在含有抗生素的培养基中进行筛选,但这种方法得到的突变株会在细菌染色体中留下筛选标记,所以从生物安全的角度考虑,不适合用来构建疫苗候选突变株。已有采用枯草芽胞杆菌的sacB 基因的负向筛选同源重组构建的多杀性巴氏杆菌ΔaroA 突变株的报道[11]。
本研究构建的Δhfq 突变株具有良好的遗传稳定性和生长特性;在对CD4/2 细胞的粘附和侵袭试验中,Δhfq 突变株的粘附和侵袭能力比Bb122 株下降,但两者无明显差异;对小鼠的致病性试验中,将亲本株与突变株分别腹腔接种小鼠,以2×109cfu/只的剂量接种时,亲本株接种小鼠全部死亡,而突变株接种小鼠则全部存活,表明Hfq 蛋白与该菌的致病性有关。本研究为进一步研究Hfq 蛋白的功能及其在Bb 致病机制中的作用奠定了基础。
[1]Borckmeier S.The Role of Bordetella bronchiseptica in diseases of swine:Atrophic rhinitis and beyond[J].Pig Progress,2003,6:20-21.
[2]Register K B.Bordetella bronchiseptica:underestimated threat?[J].Pig Progress,2000,l:10-11.
[3]宋兰,周先礼,岳俊杰,等.细菌sRNA 伴侣蛋白Hfq 的研究进展[J].军事医学科学院院刊,2009,02:186-189.
[4]Brennan R G,Link T M.Hfq structure,function and ligand binding[J].Curr Opin Microbiol,2007,10(2):125-133.
[5]Robertson G T,Roop R M.The Brucella abortus host factor 1(HF-1)protein contributes to stress resistance during stationary phase and is a major determinant of virulence in mice[J].Mol Microbiol,1999,34(4):690-700.
[6]Fantappie L,Metruccio M M,Seib K L,et al.The RNA chaperone Hfq is involved in stress response and virulence in Neisseria meningitis and is a pleiotropic regulator of protein expression[J].Infect Immunity,2009,77(5):1842-1853.
[7]Sittka A,Pfeiffer V,Tedin K,et al.The RNA chaperone Hfq is essential for the virulence of Salmonella typhimurium[J].Mol Microbiol,2007,63(1):193-217.
[8]Giles C J,Smith I M,Baskerville A J,et al.Clinical,bacteriological and epidemiological observations on infectious atrophic rhinitis of pigs in southern England[J].Vet Rec,1980,106:25.
[9]Stevenson A,Roberts M.Use of Bordetella bronchiseptica and Bordetella pertussis as alive vaccines and vectors for heterologous antigens[J].FEMS Immunol Med Microbiol,2003,37:121-128.
[10]Stevenson A,Roberts M.Use of rationally attenuated Bordetella bronchiseptica as alive mucosal vaccine and vector for heterologous antigens[J].Vaccine,2002,20:2325-2335.
[11]郭东春,卢艳,刘家森,等.多杀性巴氏杆菌aroA 基因缺失突变株的构建及鉴定[J].微生物学报,2012,52(4):526-531.

