马链球菌马亚种FNEB蛋白的截短表达及其免疫保护性研究
徐全圆,石 明,杨夷平,李 娜,刘建华,加尔肯,冉多良
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
马链球菌属于β 溶血性C 群链球菌,包括3 个亚种[1-2]:马链球菌马亚种(Streptococcus equi subsp.equi)、马链球菌兽疫亚种(Streptococcus equi subsp.zooepidemicus)、马链球菌类马亚种(Streptococcus equi subsp.ruminatorum)。马链球菌马亚种是马腺疫的致病菌,是以引起动物发热、上呼吸道黏膜发炎、颌下淋巴结肿胀化脓为特征的急性接触性传染病[3],属于三类动物疫病[4]。马链球菌马亚种感染宿主主要由其细胞壁上的一些表面蛋白与宿主细胞相结合,目前已发现,马链球菌马亚种的表面蛋白有类M 蛋白[5-6]、IgG 结合蛋白,有助于菌体逃避机体的吞噬;纤粘蛋白(Fibronectin,FN)结合蛋白能够与机体内的纤粘蛋白相结合[6],有助于病原菌在机体内的侵袭及扩散。马链球菌马亚种FN 结合蛋白有3种:FNEB、FNE 和SFS[7],其中FNE 和SFS 为分泌型蛋白[8-9],FNEB 为细胞表面锚定型蛋白[10]。
目前国内报道的对于马链球菌马亚种疫苗的研究还在灭活疫苗的研究阶段,国外也处在亚单位疫苗的研制阶段,Jean-Francois 等通过克隆表达类M蛋白免疫动物并获得较好的保护效果[5]。本研究克隆了马链球菌马亚种新疆株FNEB 基因并进行测序分析及原核表达,为重组FNEB 蛋白亚单位疫苗的研制奠定基础。
1 材料和方法
1.1 主要实验材料 马链球菌马亚种新疆分离株、pET-30a 载体、新疆伊犁地区发生马链球菌马亚种的马阳性血清均由新疆农业大学动物医学学院传染病实验室保存;T4 DNA 连接酶、LA Taq DNA 聚合酶、限制性内切酶均购自TaKaRa 公司;DNA Marker、细菌基因组DNA 抽提试剂盒、质粒小提及胶回收试剂盒均购自生工生物工程(上海)有限公司;弗氏佐剂购自Sigma 公司;受体菌DH5α、BL21(DE3)、蛋白纯化ProteinIso Ni-NTA Resin 以及蛋白Marker 均购自北京全式金生物技术有限公司;羊抗鼠IgG-HRP 购自中杉金桥生物技术有限公司;兔抗马IgG-HRP 购自BETHYL 公司。
1.2 实验动物 健康昆明小鼠40 只(每只体质量约20 g)购自新疆医科大学实验动物中心。
1.3 引物的设计和合成 参考GenBank 中登录的FNEB 基因序列(AY898649)设计一对扩增FNEB 基因的引物FNEB-L-1/FNEB-L-2,序列为:5'-GCGG GATCCATGGAGAGACTAATGAGAACA-3'(Bam HⅠ)/5'-GCGCTCGAGGTCTTCTTGATAAGGTCTAAA-3'(XhoⅠ),预计扩增片段为1 425 bp,引物由上海生工生物工程技术服务有限公司合成。
1.4 FNEB基因的扩增 按细菌基因组DNA 抽提试剂盒的说明书方法提取细菌DNA。以其为模板进行PCR 扩增,反应程序为:95 ℃5 min;95 ℃30 s、62 ℃30 s、72 ℃90 s,共30 个循环;72 ℃10 min。
1.5 FNEB基因的克隆、测序及生物信息学分析以DNA 胶回收试剂盒回收PCR 产物,回收产物克隆于pMD19-T 载体中,由上海生工生物工程技术服务有限公司测序。利用Blast 和DNAStar 软件将测序的结果与已报道的其它的马链球菌马亚种的FNEB 基因比较同源性;ExPASy 分析预测FNEB 蛋白的跨膜区、信号肽及结构域;DNAStar 软件分析其疏水性、抗原性。根据预测截取FNEB 抗原性较好的部分并设计引物FNEB-1/FNEB-2,序列为:5'-GCGGGATCCATGGGTTATCCAAACAAAAGT-3'/5'-GCGCTCGAGCTATTTTGCCTCATGTGTTTT-3',预计扩增片段为936 bp。
1.6 FNEB截短基因重组原核表达质粒的构建PCR 扩增FNEB 截短基因,经Bam HⅠ和XhoⅠ双酶切后克隆于pET-30a 中构建重组表达质粒pETFNEB,并转化于E.coli BL21(DE3)感受态菌株中,由上海生工生物工程技术服务有限公司测序。
1.7 FNEB重组蛋白的表达、纯化及鉴定 将重组菌于LB 培养基中培养至OD600nm值为0.6~0.8 时,加入终浓度为0.5 mmol/L 的IPTG,37 ℃诱导4 h收集菌液,经SDS-PAGE 检测后,按ProteinIso Ni-NTA Resin 蛋白纯化说明进行纯化。重组蛋白电转移至硝酸纤维素膜上,经5 %脱脂乳封闭;以抗马链球菌马亚种的阳性血清为一抗(1∶500),以兔抗马IgG-HRP(1∶5 000)为二抗;通过DAB 显色,对表达的重组蛋白进行western blot 鉴定。
1.8 动物免疫攻毒试验 将40 只健康昆明鼠随机分成两组,每组20 只。免疫组小鼠经肌肉注射0.1 mL(250 μg/mL)重组截短FNEB 蛋白,对照组小鼠注射等体积的PBS。所有组首免均以弗氏完全佐剂乳化,15 d 后以弗氏不完全佐剂乳化进行第二次免疫,30 d后以弗氏不完全佐剂乳化加强免疫。第45 d 对所有组进行5LD50(5×109cfu)马链球菌马亚种活菌腹腔接种攻毒,72 h 内观察并记录每组小鼠的死亡情况。
1.9 免疫小鼠血清抗体水平的检测 尾静脉分别采集小鼠免疫前和免疫后不同时间的血液并分离血清,以FNEB 截短蛋白为包被抗原,通过间接ELISA 检测小鼠血清中抗体的效价。
2 结果
2.1 FNEB基因的扩增及生物信息学分析 以马链球菌马亚种基因组DNA 为模板,用特异性引物进行PCR 扩增,结果显示目的片段约1 400 bp 和900 bp,与预期结果一致(1 425 bp 和936 bp)(图1)。
经Blast 和DNAStar 软件比对分析其与GenBank登录的马链球菌马亚种4047(YP002747216)核苷酸序列相似性为99 %,其中存在5 个核苷酸的差异,而导致其推导氨基酸序列中4 个氨基酸位点的差异,即Glu115Lys、Ser286Gly、Pro419Leu 和Lys474Glu。通过ExPASy 和DNAStar 预测分析表明FNEB 蛋白的主要抗原区及疏水区均在其中后部分区域,蛋白表达时去除其疏水区的信号肽部分,截取其抗原性较好的结构域区及与FN 结合区。
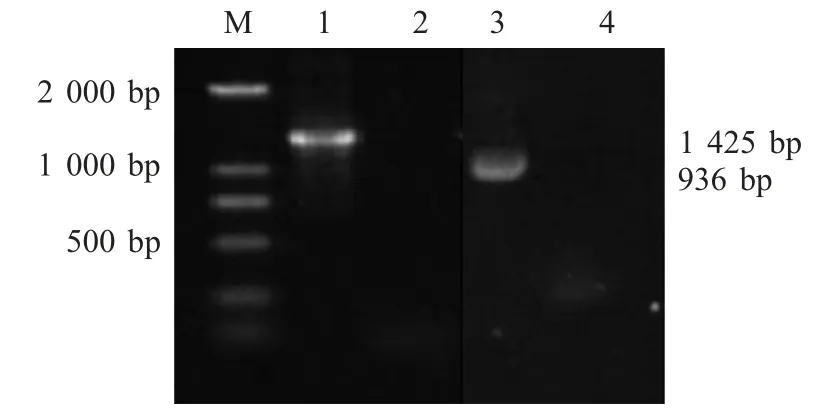
图1 FNEB 及其截短基因的PCR 扩增Fig.1 PCR products of FNEB and truncated FNEB
2.2 p ET-FNEB原核表达载体的鉴定结果 pETFNEB 经PCR 和双酶切鉴定,PCR 扩增结果显示约在900 bp 处有清晰目的片段,双酶切结果显示在5 400 bp 和900 bp 均有清晰片段(图略),与预期结果一致,表明重组表达载体构建正确。
2.3 FNEB重组蛋白的表达及鉴定 将重组菌经IPTG 诱导进行重组蛋白的表达。表达的重组蛋白经SDS-PAGE 检测,结果显示目的蛋白大小约为60 ku;利用抗马链球菌马亚种的阳性血清进行western blot鉴定,结果显示在60 ku 处有特异性条带(图2),表明该蛋白能够被抗马链球菌马亚种的阳性血清识别,具有良好的反应原性。
2.4 动物免疫试验结果 将重组蛋白免疫小鼠,并于三免后15 d 对所有组小鼠以5 LD50(5×109cfu)马腺疫链球菌活菌进行腹腔攻毒,72 h 内观察并记录每组小鼠的死亡情况,结果显示,对照组小鼠死亡19 只,免疫组小鼠攻毒12 h 内出现3 只死亡,其它小鼠表现焦躁亢奋,食欲减退,之后有4 只死亡,其余的症状均逐渐好转。表明FNEB 截短蛋白免疫小鼠后具有保护力,保护率为65 %(表1)。
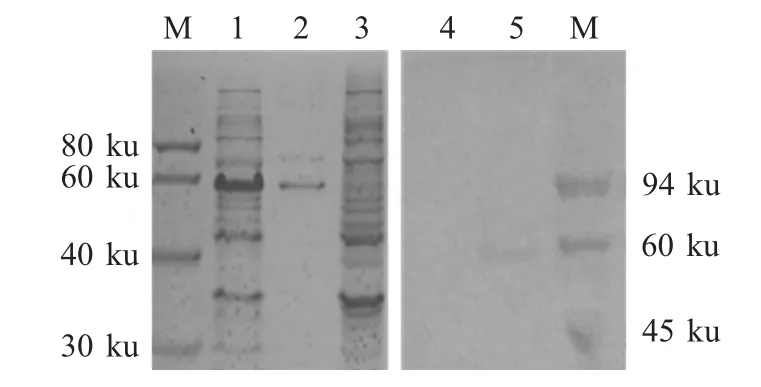
图2 重组蛋白FNEB 的诱导表达、纯化及western blot 鉴定Fig.2 Expression,purification and western blot analysis of the recombinant FNEB

表1 小鼠免疫保护结果Table 1 Immunoprotection of the mice against the Streptococcus
2.5 免疫小鼠血清抗体水平的检测结果 将3 次采集的血清按1∶200 进行2 倍倍比稀释,以羊抗鼠IgG-HRP 为二抗进行间接ELISA 检测(图3),以阴性血清OD450nm平均值加3 倍标准差作为阳性判定标准。结果表明:免疫前各组抗体水平相近;在免疫后28 d 就能够产生较高水平的特异性抗体;加强免疫后(40 d)抗体水平达到较高值。
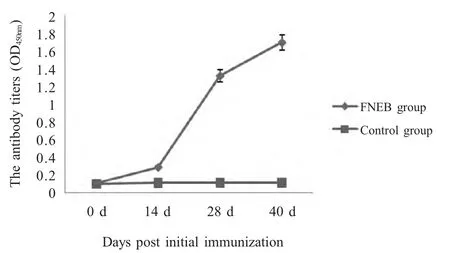
图3 免疫小鼠血清的抗体水平变化Fig.3 The specific antibody level of mice induced by the recombinant protein
3 讨论
FN 是一种高分子糖蛋白,具有多种的生物学功能,并且广泛存在于动物组织和组织液中[11]。据研究表明与FN 相结合的FN 结合蛋白存在于一些A、C 和G 群链球菌和金黄色葡萄球菌中,耿建新通过克隆表达马链球菌兽疫亚种FN 结合蛋白功能片段并免疫实验动物,以强毒株攻击,免疫组具有一定的保护性[12]。FNEB 蛋白为马链球菌马亚种的重要的一种表面蛋白,具有信号肽,C 端具有锚定区及跨膜区,Jonas 等通过体外表达获得FNEB 蛋白并以其免疫动物后利用ELISA 检测其免疫血清的抗体效价,结果表明FNEB 蛋白具有良好的免疫原性[7]。从新疆分离株克隆出的FNEB 蛋白基因推导的氨基酸序列具有典型性表面蛋白的典型特征,具有一个信号肽,C-末端含有细胞壁锚定的基序LPxTG 和跨膜结构,后面为一小段带正电荷的残基,位于C-末端含有FN 结合蛋白的重复区域,位于N-末端则有一个不重复的结构域。通过同源性比较显示新疆分离株与马链球菌马亚种4047 菌株为同一亚种,表明分离得到的为马链球菌马亚种。
目前,国外一直在研究马链球菌马亚种的亚单位疫苗的有效的抗原,并且得到马链球菌马亚种的SeM 蛋白,其具有较好的免疫原性,其它的一些表面毒力蛋白免疫原性的研究也在进行中。本研究通过对马链球菌马亚种的FNEB 基因的克隆及原核表达,制备了FNEB 基因编码的蛋白,并免疫小鼠攻毒后小鼠的保护率为65 %,表明该蛋白具有一定的免疫原性。为该病的防治及重组FNEB 蛋白亚单位疫苗的研制提供实验依据。
[1]范红结,陆承平.马链球菌兽疫亚种毒力因子[J].中国人兽共患病学报,2006,22(3):279-281.
[2]Hulting G,Flock M,Frykberg L,et al.Two novel IgG endopeptidases of Streptococcus equi[J].FEMS Microbiol Lett,2009,298(1):44-50.
[4]Atkin K E,Brentnall A S,Harris G,et al.The streptococcal binding site in the gelatin-binding domain of fibronectin is consistent with a non-linear arrangement of modules[J].J Biol Chem,2010,285(47):36977-36983.
[5]Jean-Francois M J B,Poskitt D C,Turnbull S J,et al.Protection against Streptococcus equi infection by monoclonal antibodies against an M-like protein[J].J Gen Microbiol,1991,137(9):2125-2133.
[6]Chanter N,Talbot N C,Newton J R,et al.Streptococcus equi with truncated M-proteins isolated from outwardly healthy horses[J].Microbiology,2000,146(6):1361-1369.
[7]Flock M,Jacobsson K,Frykberg L,et al.Recombinant Streptococcus equi proteins protect mice in challenge experiments and induce immune response in horses[J].Infect Immun,2004,72(6):3228-3236.
[8]Lindmark H,Nilsson M,Guss B.Comparison of the fibronectin-binding protein FNE from Streptococcus equi subspecies equi with FNZ from S.equi Subspecies zooepidemicus reveals a major and conserved difference[J].Infect Immun,2001,69(5):3159-3163.
[9]Lindmark H,Guss B.SFS,a novel fibronectin-binding protein from Streptococcus equi,inhibits the binding between fibronectin and collagen[J].Infect Immun,1999,67(5):2383-2388.
[11]周益装,尤元海,张建中.链球菌属纤连蛋白结合蛋白的生物信息学分析[J].生物信息学,2011(1):60-64.
[12]耿建新.马链球菌兽疫亚种纤连蛋白结合蛋白功能片段的确定及免疫保护试验[D].南京:南京农业大学,2007.
——和田盘羊

