猪伪狂犬病病毒HNX株在免疫猪群中水平传播能力的研究
张明辉,库旭钢,凌云志,杨子靖,何启盖*
(1.华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070;2.华中农业大学 动物医学学院,湖北 武汉 430070)
猪伪狂犬病病毒(Pseudorabies virus,PRV)可以引起不同年龄段的猪发病,主要表现为发热、神经症状和繁殖障碍[1]。PRV 主要通过水平传播,也可以垂直传播[2]。在合适的环境中,病毒也可以气溶胶的形式传播[3]。
在一些欧洲国家,严格的净化措施已经彻底根除了PRV 在家畜中的传播[4]。2012 年以来,中国华北和华东地区大面积流行猪伪狂犬病(PR),发病率高达50 %~94.2 %,死亡率达10 %~30 %[5-6]。目前,有效的预防PR 的方法仍是免疫接种,gE 缺失基因工程苗的应用有利于PR 的净化工作。但新变异病毒株的出现,使现有疫苗的保护作用更加有限,即使按程序免疫的猪场仍然暴发PR[7]。
评价一种病毒是否发生重要变异,水平传播能力是一项重要的判定指标。本研究为验证PRV HNX株在猪群中的水平传播能力,通过对不同的疫苗保护力指标进行检测,评估Bartha-K61 株疫苗阻止PRV 水平传播的能力,为新型疫苗研制提供数据支持。
1 材料和方法
1.1 病毒株、细胞、疫苗及实验动物 PRV HNX株由本实验室分离鉴定;PRV 鄂A 株(Ea)、闽A 株(Fa)、IBRS-2 细胞及重组标准质粒pMD-gD 均由本实验室保存;Bartha-K61 株疫苗(gE 缺失基因工程苗)购自德国勃林格殷格翰公司;16 头80 日龄PRV阴性猪购自湖北省红安县农户。
1.2 主要试剂 ELISA 试剂盒购自IDEXX 公司;细胞因子检测试剂盒购自武汉博士德生物工程有限公司;DNA 提取试剂盒购自天根生化科技(北京)有限公司;PCR 相关试剂购自TaKaRa 公司;Probe Master Mix 酶购自Roche 公司;荧光定量PCR 探针及引物由金斯瑞生物科技有限公司合成。
1.3 实验动物分组及免疫 16 头PRV 阴性猪分为A、B 两组。A 组6 头,每头肌肉注射Bartha-K61株疫苗1 头份;B 组10 头,为未免疫组。免疫前、免疫后7 d、14 d、21 d 前腔静脉采血,分离血清,-80 ℃保存备用。
1.4 抗体及细胞因子检测 采用ELISA 试剂盒检测血清样品中抗gB 和gE 蛋白的抗体水平,S/N 值小于0.6 结果判为阳性,S/N 值大于0.7 为阴性;采用细胞因子检测试剂盒检测细胞因子α、β、γ 干扰素(IFNs)水平,并通过血清交叉保护中和试验综合评价疫苗保护力[8]。将200 TCID50的病毒(HNX株、Ea 株、Fa 株)与稀释的血清互作,加入细胞悬液,设立病毒对照和正常IBRS-2 细胞对照,持续观察3 d,以保护50 %细胞不出现病变的血清最高稀释倍数表示中和效价。
1.5 同居感染试验 根据抗体及细胞因子检测结果,在免疫后21 d,采用PRV HNX 株人工感染B组中抗gB 蛋白抗体水平较低的4 头猪,感染剂量为2 mL 107TCID50/只,颈部肌肉注射,并将人工感染的4 头猪分配2 头到A 组、2 头留在B 组,作为传染源以水平感染其它猪只。此时的饲养密度为1.31 m2/头。人工感染后每天观察猪只临床症状并采集鼻、粪拭子,监测直肠温度,持续14 d;每隔7 d采血,持续4 周。
1.6 排毒监测 采集的鼻、粪拭子经PBS 震荡重悬,10 000 r/min 离心10 min,取上清液,根据DNA提取试剂盒提取鼻、粪拭子DNA,采用gD 基因Taq Man 荧光定量PCR 方法[9]检测排毒情况,引物和探针序列为:PRV-gD-F(5'-CATCCTCACCGACTT CAT-3')/PRV-gD-R(5'-TACCAGTAGTTCACCACC-3')和PRV-gD-probe(5'-CAAGAGTGCCCGTTCGCC-3')。反应条件为:50 ℃2 min,95 ℃10 min;95 ℃15 s、56 ℃20 s、60 ℃50 s,40 个循环;72 ℃10 min。
标准质粒的初始浓度为649.3 ng/μL,换算结果为1.52×1011拷贝/μL。将标准质粒10 倍梯度稀释至1.52×1010拷贝/μL~1.52×101拷贝/μL,利用常规PCR 方法验证荧光定量PCR 的敏感性。常规PCR 目的基因为gD 基因,扩增大小为217 bp,引物为:PRV-gD-F(5'-CAGGAGGACGAGCTGGGGCT-3')/PRV-gD-R(5'-GTCCACGCCCCGCTTGAAGCT-3')。反应条件为:94 ℃3 min;94 ℃40 s、57 ℃40 s、72 ℃45 s,35 个循环;72 ℃10 min。
2 结果
2.1 疫苗免疫效果 以Bartha-K61 株疫苗免疫A组实验猪,ELISA 检测结果显示A 组的gE 抗体均呈阴性,B 组gB 和gE 抗体均呈阴性。免疫后7 d,A 组3 头实验猪呈gB 抗体阳性;免疫14 d 后,A组全部为gB 抗体阳性(图1)。结果表明Bartha-K61株活疫苗免疫后能够快速诱导机体产生免疫反应。
细胞因子检测结果显示,A、B 两组IFNs 差异不显著,而且未免疫的B 组实验猪产生的IFNs 水平也在逐渐升高(图2)。
免疫Bartha-K61 株活疫苗21 d 的A 组实验猪血清中和PRV HNX 株中和效价最高达1∶5.62,只有5头实验猪产生有效中和Ea 株和Fa 株的中和抗体(表1)。
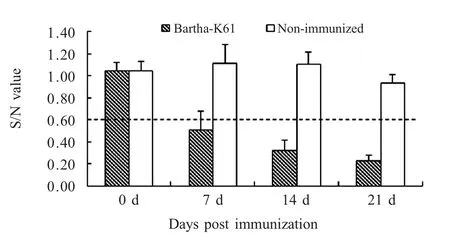
图1 免疫后gB 抗体水平Fig.1 Seroconversion for gB antibody after vaccination

图2 免疫后IFNs 水平检测结果Fig.2 The detection for IFNs at different times after vaccination

表1 免疫后实验猪血清中和抗体水平Table 1 Neutralization antibodies in pigs post vaccination
2.2 同居感染试验结果 采用PRV HNX 株人工感染B 组4 头猪后平均分配至A 组和B 组。被动感染3 d 后,部分免疫猪和未免疫猪出现临床症状,表现为打喷嚏、咳嗽、采食不积极、扎堆,但无神经症状。被动感染后7 d 免疫猪和未免疫猪体温有明显的升高(图3)。感染后14 d,所有实验猪临床症状消失,无死亡。抗体检测结果显示,被动感染7 d 后,免疫组实验猪均为gE 抗体阴性;14 d 后,免疫组3 头猪gE 抗体转阳;21 d 后,免疫组6 头猪全部gE 抗体转阳。表明Bartha-K61 株疫苗无法阻止HNX 株水平传播感染。
2.3 排毒监测 同时收集实验猪的鼻、粪拭子,采用荧光定量PCR 方法监测实验猪2 周内的排毒情况。结果显示,人工感染后实验猪鼻拭子中能够检测到病原,粪拭子中未检测出病原。同时使用常规PCR 方法检测荧光定量PCR 所用标准质粒,结果显示常规PCR 方法只能检测到103拷贝/μL 的标准质粒,因此荧光定量PCR 检测鼻拭子排毒的结果以103为起始值表示更为准确。检测结果显示免疫猪和未免疫猪受到感染后持续排毒,持续一周(图4)。
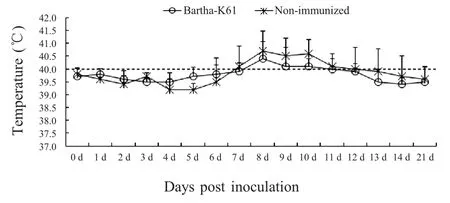
图3 同居感染后实验猪体温变化Fig.3 Rectal temperature of pigs after cohabitation
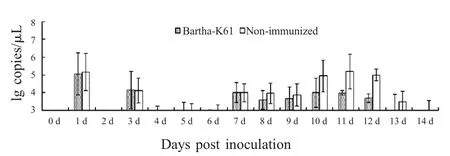
图4 同居感染后实验猪排毒检测结果Fig.4 The detection of virus excretion in pigs after cohabitation
3 讨论
IFNs 在抗PRV 感染中具有重要的作用[10]。疫苗免疫后,免疫猪产生的IFNs 差异不显著,而且未免疫猪产生的IFNs 水平也在逐渐升高,因此IFNs 指标在本研究中无法有效地评价疫苗保护力,IFNs 量化评估指标有待进一步研究。中和抗体在体液免疫中发挥重要作用,本研究实验结果显示免疫猪gB抗体水平很高,但中和抗体水平却较低,甚至没有。这与其他研究结果相同[11]。中和抗体水平低,导致群体免疫保护率低,最终未能阻止PRV HNX株的水平传播。即使Bartha-K61 株活疫苗在一定程度减慢了gE 抗体转阳速度,但最终仍未能阻止gE抗体转阳,未能阻止野毒感染。
荧光定量PCR 方法能够量化直观地比较不同样品的载毒量[12],本实验通过Taq Man 荧光定量PCR方法检测鼻拭子载毒量进而反应鼻排毒量。本实验中饲养密度为1.31 m2/头,人工感染猪在2 周内持续排毒,免疫猪和未免疫猪受到被动感染7 d 后开始持续排毒。预试验中发现滴鼻感染极易造成实验猪急性死亡,因此本研究采用肌肉注射途径,使人工感染猪成为有效的传染源。被动感染的实验猪均表现敏感,并且最终均呈野毒感染状态,表明PRV HNX 株具有很强的水平传播能力。这也暗示猪场育肥阶段的猪有必要加强免疫,不然一旦发生野毒感染,即使不造成死亡也会存在散毒的风险,不利于猪伪狂犬病的控制与净化。
本研究从免疫学指标和临床指标两大方面评价Bartha-K61 株活疫苗的保护力。从免疫学指标来看,疫苗诱导的血清中和抗体水平较低,不能够提供完全的保护力以抵抗新变异病毒株的感染。因此,有必要研制新型疫苗提升保护力。本研究为客观综合评价猪伪狂犬病疫苗的保护力提供参考。
[1]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[2]Hahn E C,Page G R,Hahn P S,et al.Mechanisms of transmission of Aujeszky's disease virus originating from feral swine in the USA[J].Vet Microbiol,1997,55(1):123-130.
[3]Christensen L S,Mousing J,Mortensen S,et al.Evidence of long distance airborne transmission of Aujeszky's disease(pseudorabies)virus[J].Vet Rec,1990,127(19):471-474.
[4]Maresch C,Lange E,Teifke J P,et al.Oral immunization of wild boar and domestic pigs with attenuated live vaccine protects against Pseudorabies virus infection[J].Vet Microbiol,2012,161(1):20-25.
[5]Wu Rui,Bai Chao-yong,Sun Jin-zhong,et al.Emergence of virulent pseudorabies virus infection in Northern China[J].J Vet Sci,2013,14(3):363-365.
[6]Yu Xiu-ling,Zhou Zhi,Hu Dong-mei,et al.Pathogenic pseudorabies virus,China,2012[J].Emerg Infect Dis,2014,20(1):102-108.
[7]Wang Chun-hua,Yuan Jin,Qin Hua-yang,et al.A novel gEdeleted pseudorabies virus(PRV)provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population in China[J].Vaccine,2014,32(27):3379-3385.
[8]Huang Li-ping,Lu Yue-hua,Wei Yan-wu,et al.Development of a blocking ELISA for detection of serum neutralizing antibodies against porcine circovirus type 2[J].J Virol Methods,2011,171(1):26-33.
[9]张明辉,库旭钢,余腾,等.猪伪狂犬病病毒gD 基因荧光定量PCR 检测方法的建立[C].中国畜牧兽医学会2014 年学术年会,2014.
[10]Low-Calle A M,Prada-Arismendy J,Castellanos J E.Study of interferon-β antiviral activity against Herpes simplex virus type 1 in neuron-enriched trigeminal ganglia cultures[J].Virus Res,2014,180:49-58.
[11]An Tong-qing,Peng Jin-mei,Tian Zhi-jun,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19(11):1749-1754.
[12]Gu Zhen-qing,Dong Jing,Wang Ji-chun,et al.A novel inactivated gE/gI deleted pseudorabies virus(PRV)vaccine completely protects pigs from an emerged variant PRV challenge[J].Virus Res,2015,195:57-63.

