猪流行性腹泻病毒SYBR Green I荧光定量RT-PCR检测方法的建立
曹贝贝,韩 丽,于朋飞,兰培英,程慧芳,宋 月,胡 慧
(1.河南省动物性食品安全重点实验室,河南 郑州 450002;2.河南农业大学 牧医工程学院,河南 郑州 450002)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由PED 病毒(PEDV)引起的一种急性高度接触性肠道传染病。该病以猪水样腹泻、呕吐和脱水为典型特征,各种年龄的猪和不同品种的猪群均易感,但对哺乳仔猪的危害最为严重,1 周龄以内的哺乳仔猪发病后2 d~4 d 死亡,致死率高达90 %以上,给养猪业造成了严重的经济损失[1-2]。
PEDV 属于尼多病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus),为不分节段的线性单股正链RNA 病毒[3]。PEDV 基因组靠近3' 端5 kb 区域内含有5 个主要的开放阅读框(ORF),编码典型的冠状病毒结构蛋白:核蛋白(Neucleocapsid,N)、膜糖蛋白(Membrane protein,M)、小膜蛋白(Small membrane protein,sM)和刺突糖蛋白(Spike protein,S);以及位于sM 蛋白和S 蛋白之间的ORF3,编码未知功能的多肽性片段[4-6]。本实验根据GenBank 登录的PEDV 的ZKHFQ 株N基因序列,通过序列分析获得其高度保守的特异性序列,并根据该特异性保守序列设计了一对特异性引物。在此基础上建立了PEDV SYBR Green I 荧光定量RT-PCR 检测方法,并对该方法进行了评价分析,为兽医临床的诊断和防制提供技术支持。
1 材料和方法
1.1 病毒株及临床样品 猪传染性胃肠炎病毒(TGEV)、猪细小病毒(PPV)、猪圆环病毒II 型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)和猪伪狂犬病毒(PRV)均由本实验室保存。PEDV 的临床样品来自河南各地市及其周边地市养殖场的7 日龄以内乳猪的肠道内容物。
1.2 主要试剂 pMD18-T 载体、反转录试剂盒、T4 DNA 连接酶、限制性内切酶、PCR 相关试剂、DNA Marker、DNA 凝胶回收试剂盒及SYBR Premix Ex Taq I 聚合酶均购自TaKaRa 公司;TRIzol 试剂购自Invitrogen 公司。
1.3 引物的设计及合成 应用Primer Premier 5.0 基因分析软件,参照GenBank 中登录的ZKHFQ 株PEDV N 基因序列设计一对引物5'-CAACAGCAGA AGCCCAAAC-3'/5'-GCTCACGAACAGCCACATT-3',扩增PEDV N 基因部分片段(298 bp),引物由上海生工生物工程技术服务有限公司合成。
1.4 重组质粒标准品的制备 按照TRIzol 总RNA提取试剂盒说明书方法提取RNA,参照Thermo 反转录试剂盒说明书进行反转录,将所得cDNA 进行常规PCR 扩增,PCR 产物纯化回收后与pMD18-T载体连接,转化感受态细胞,用质粒提取试剂盒提取质粒,由上海生工生物工程技术服务有限公司测序。将测序正确的阳性质粒作为DNA 标准品,用分光光度仪测定浓度后进行10 倍系列稀释,用于构建标准曲线。并根据标准质粒的浓度进行分析,计算质粒拷贝数。
1.5 荧光定量RT-PCR方法的优化 采用SYBR Premix Ex Taq 推荐的反应体系,以出现最高荧光值、出现最小的样本阈值循环数(Ct 值)以及在融解曲线分析中不出现非特异性峰为指标,对退火温度、循环条件和循环次数等进行优化。
1.6 标准曲线的绘制 将计算出拷贝数的质粒做10 倍梯度稀释,选取8 个适宜的稀释度作为标准阳性模板进行RT-PCR 扩增反应,每个稀释度设3 个平行试验。对扩增结果进行分析,绘制标准曲线。
1.7 特异性试验 采用建立的扩增方法对TGEV、PPV、PCV2、PRRSV、PRV 基因进行扩增,并选取PEDV 阳性质粒作阳性对照,灭菌水作阴性对照,检验所建立方法的特异性。
1.8 敏感性试验 分别以5.7×105拷贝/μL~5.7×101拷贝/μL 的质粒标准品作为模板,进行荧光定量RT-PCR 扩增,确定能得出阳性结果的最低稀释度的拷贝数,同时用常规PCR 进行检测,比较两种方法的敏感性,同时设阴性对照。
1.9 重复性试验 采用建立的阳性标准质粒为模板,选取4 个稀释度,分别在同等条件下进行扩增,每个稀释度做4 个平行试验,计算变异系数;同时,将上述所用样品保存,每周检查1 次,连续检测2 周,计算不同批次间变异系数。
1.10 临床样品检测 对来自河南省及其周边地区的26 份疑似PED 病猪的小肠内容物按照实验室常规方法进行处理后,分别采用建立的荧光定量RT-PCR 方法和常规PCR 方法进行检测,比较两种方法的阳性检出率和符合率,并用统计学方法进行结果分析。
2 结果
2.1 阳性标准品的制备 利用设计的引物进行PCR扩增,经1.0 %琼脂糖凝胶电泳检测,结果显示,从肠道内容物中扩增出约300 bp 的片段(图1)。对阳性重组质粒进行序列测定,BLAST 比对结果显示其与参考序列的同源性为100 %,表明PEDV N 基因片段的重组质粒构建正确。经核酸蛋白分析仪测定计算,质粒浓度为187 ng/μL,即5.7×1010拷贝/μL。
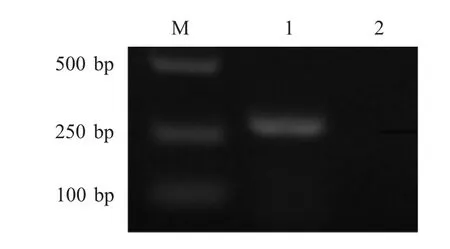
图1 PCR 产物琼脂糖凝胶电泳检测结果Fig.1 Amplification of PEDV N gene by RT-PCR products
2.2 荧光定量RT-PCR标准曲线的建立及反应条件的优化 通过反应条件的优化,20 μL 反应体系为:上下游引物各0.5 μL,质粒模板1 μL,SYBR Premix Ex TaqⅠ10 μL,ddH2O 8 μL,扩增参数为94 ℃5 min;95 ℃10 s、58 ℃10 s、72 ℃30 s,35 个循环。PEDV 荧光定量RT-PCR 扩增标准曲线如图2,溶解温度为85.79 ℃,标准差为0.0603,变异系数为0.000703。
选取浓度为5.7×108拷贝/μL~5.7×101拷贝/μL的质粒作为标准品,按照优化的条件进行荧光定量RT-PCR 扩增,得到的标准曲线如图2,斜率为-3.1899,截距为34.23,相关系数R2为0.99。结果显示其具有良好的线性关系。

图2 PEDV 荧光定量PCR 扩增标准曲线Fig.2 Standard curve of the real-time PCR for PEDV
2.3 特异性试验 以建立的荧光定量RT-PCR 分别对TGEV、PPV、PCV2、PRRSV 及PRV 等阳性模板进行检测。扩增结果显示,只有PEDV 扩增为阳性,其它均无特异性扩增(图3),表明该方法具有较强的特异性。
2.4 敏感性试验 以10 倍倍比稀释的质粒标准品(5.7×105拷贝/μL~5.7×101拷贝/μL)作为模板,进行RT-PCR 和常规PCR 扩增。扩增结果显示RTPCR 的最低检测量为5.7×101拷贝/μL,常规PCR的最低检测量为5.7×102拷贝/μL(图4),RT-PCR的敏感性是常规PCR 的10 倍,表明本实验建立的RT-PCR 方法具有较高的敏感性。
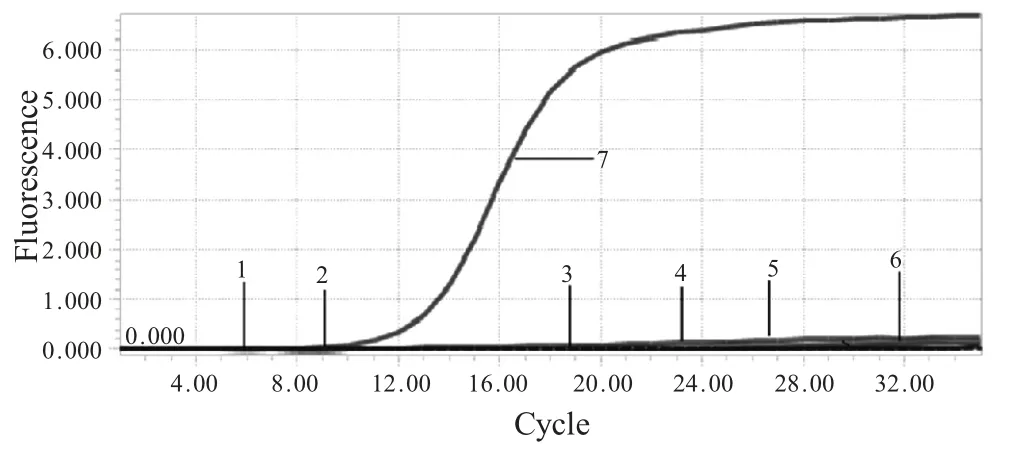
图3 PEDV 荧光定量RT-PCR 扩增特异性试验Fig.3 Specificity test dynamic curve of real-time RT-PCR
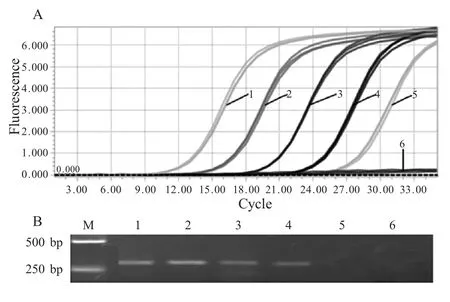
图4 荧光定量RT-PCR(A)与常规PCR(B)敏感性试验Fig.4 Sensitivity tests of real-time RT-PCR(A)and traditional PCR(B)
2.5 重复性试验 选取模板浓度分别为5.7×105拷贝/μL~5.7×102拷贝/μL 的重组质粒为样本,利用建立的荧光定量RT-PCR 方法分别重复扩增4 次,结果表明组内组间变异系数均小于1 %(表1),表明该荧光定量RT-PCR 检测方法具有较高的可重复性。
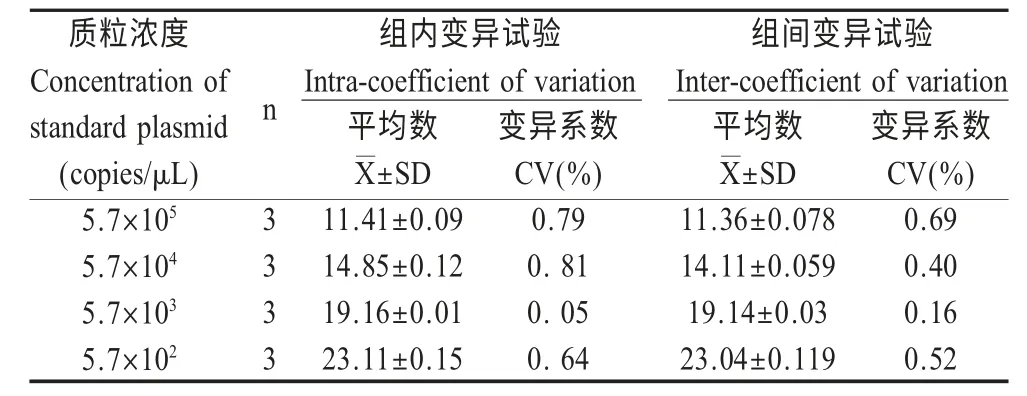
表1 荧光定量RT-PCR 的重复性试验结果Table 1 Reproducibility test of intra-and inter-assay for the real-time RT-PCR
2.6 临床样品检测结果 对26 份疑似PED 的病料样品进行检测,荧光定量RT-PCR 和常规PCR 检测双阳性病料样品11 份,双阴性病料样品9 份,荧光定量RT-PCR 法检测出单阳性病料样品6 份。二者的符合率为82.76%,RT-PCR 方法的阳性检出率比常规PCR 方法高23.07 %。用统计学的方法进行分析,采取配对样品t 检验,得到2 种方法的p 值为0.01,具有差异显著,表明所建立的荧光定量RT-PCR 检测方法敏感性高于常规PCR。
3 讨论
PEDV 的N 基因相对保守,基因突变率较低,突变选择定向性差,不太适合用于病毒株间的精细遗传进化分析,但N 基因因这些特点更适合用于PEDV 的检测。
目前针对PED 的实验室诊断方法,大致可以分3 类,即病原学检测、对病毒的抗原或抗体检测和病毒RNA 的检测。传统的病原学检测主要是在电镜下观察病毒粒子,这种方法不但耗时,而且不能准确诊断病因。崔现兰等利用免疫学方法检测抗体可以了解病毒感染及疾病的发生、发展过程,但抗体只在病毒感后一定时期才出现[7],因此,抗体检测作为快速检测PEDV 的方法受到限制。针对PEDV RNA 的检测方法很多,其中荧光定量PCR 技术应用更广泛,其以特异性强,灵敏度高,重复性好、定量准确等优点成为分子生物检测技术中的重要检测方法。
本实验构建了PEDV N 基因片段的标准质粒,基于SYBR Green I 建立了定量检测PEDV 的荧光定量RT-PCR 方法。研究数据显示,所建立的荧光定量RT-PCR 方法的熔解曲线产物峰单一整齐,无引物二聚体峰,熔解温度为85.79 ℃,与其他猪源病毒无交叉反应;质粒浓度在5.7×101拷贝/μL~5.7×108拷贝/μL 范围内的标准曲线的相关系数为0.99,显示出良好的线性关系;组间与组内试验的变异系数均小于1 %。表明建立的方法具有很好的特异性、重复性及灵敏性。用建立的荧光定量RT-PCR 对26份疑似PEDV 感染的临床病料样品进行了检测,结果有17 份呈阳性,而常规PCR 只检出11 份为阳性。而常规PCR 检测结果为阳性时,荧光定量RT-PCR 检测结果均为阳性,由此表明,荧光定量RT-PCR 比常规PCR 检测不仅灵敏度高,而且可以进行定量分析。荧光定量RT-PCR 方法对临床样品中PEDV 的检出率明显高于常规PCR,并且符合率为76.92 %。
综合分析表明,该方法具有良好的特异性、敏感性及可重复性,不但可以应用于PEDV 的流行性病学调查,也为PEDV 的定量检测及其早期感染的快速诊断奠定了基础。
[1]Pritchard G C,Paton D J,Wibberley G,et al.Transmissible gastroenteritis and porcine epidemic diarrhea in Britain[J].Vet Rec,1999,144(22):616-618.
[2]Kweon C,Kwon B,Woo S,et al.Immunoprophylactic effect of chicken egg yolk immunoglobulin(IgY)against porcine epidemic diarrhea in piglets[J].J Vet Med Sci,2000,62(9):961-964.
[3]Sergeev O V.Porcine epidemic diarrhea[J].Vopr Virusol,2009,54(2):4-8.
[4]吴玉璐,朱建平,杨莘,等.猪流行性腹泻病毒N 基因的表达及抗原性分析[J].中国预防兽医学报,2013,35(4):299-303.
[5]刘随新,石达,陈建飞,等.猪流行性腹泻病毒N 蛋白核仁定位信号对宿主细胞周期的影响[J].中国预防兽医学报,2013,35(3):173-176.
[6]Park S,Moon H,Luo Y,et al.Cloning and further sequence analysis of the ORF3 gene of wild-and attenuated-type porcine epidemic diarrhea viruses[J].Virus Genes,2008,36(1):95-104.
[7]崔现兰,马思齐,王明,等.应用免疫荧光法诊断猪流行性腹泻的研究[J].中国畜禽传染病,1990,5:20-24.

