LPS对绵羊输卵管上皮细胞β-防御素-1表达的影响及其机制研究
李 琦,曹贵方,智达夫,任丽欣,延 沁,刘默宁,郑欣欣
(内蒙古农业大学兽医学院 动物组织胚胎与发育生物学研究室,内蒙古 呼和浩特 010018)
绵羊输卵管炎是一种由多种病原微生物感染引起的免疫系统紊乱的综合性疾病,在畜牧生产中,输卵管炎已经成为大动物生殖系统疾病中一种多发并呈现愈发严重趋势的疾病,极大阻碍了畜牧业的发展。大肠杆菌引起机体免疫反应的主要成分是其细胞壁的组成成分脂多糖(Lipopolysaccharide,LPS),LPS 主要通过诱导体内单核巨噬细胞合成并释放多种炎症介质,参与机体的免疫炎症反应[1]。研究显示,在体外经LPS 刺激上皮细胞能够分泌与炎症相关的因子,介导炎症反应[2]。
防御素(Defensin)作为先天性免疫系统的重要组成部分,为一类富含精氨酸的阳离子抗菌肽[3],广泛分布于动物、植物和昆虫体内,具有高效、广谱的抗菌活性[4]。依据其半胱氨酸残基位置及二硫键连接方式分为3 类:α-防御素、β-防御素和θ-防御素。其中β-防御素具有广谱的抗菌活性,可以直接杀死细菌、真菌和病毒[5],是输卵管对抗微生物感染的重要屏障,可以作为预防和治疗的新型抗感染药物。目前,在绵羊体内发现2 种防御素绵羊β-防御素-1(SBD-1)和绵羊β-防御素-2(SBD-2)[6],其中SBD-1 在绵羊雌性生殖管道内广泛分布[7]。因此,本实验利用LPS 诱发绵羊输卵管上皮细胞,构建以LPS 模拟细菌侵染细胞的模型,研究LPS 能否诱导上皮细胞表达SBD-1,并进一步研究其具体调控机制,为临床上利用绵羊β-防御素来防御和治疗绵羊生殖道感染提供实验依据。
1 材料和方法
1.1 主要试剂 DNA Marker(DL2000)、反转录试剂盒、荧光定量酶SYBR®Premix Ex Taq II 购自宝生物工程(大连)有限公司;总RNA 极速提取试剂盒购自上海飞捷生物技术有限公司;LPS 和P38 抑制剂(SB203580 和SB202190)均购自Sigma 公司;IP细胞裂解液、BCA 蛋白浓度测定试剂盒及ECL 化学发光试剂盒均购自上海碧云天生物技术有限公司;预染蛋白分子量Marker 购自Thermo 公司;一抗GAPDH、P38 和p-P38 购自Santa Cruz 公司;HRP标记的山羊抗兔IgG(IgG-HRP)购自生工生物工程(上海)有限公司。
1.2 引物设计及合成 根据GenBank 中登录的SBD-1 基因(U75250)和绵羊内参基因β-肌动蛋白(β-actin)基因(U39357)设计引物。SBD-1 的引物序列为:5'-GGCTCCATCACCTGCTCCTC-3'/5'-CGTCTTC GCCTTCTGTTACTTCTT-3',扩增长度206 bp;β-actin的引物序列为:5'-GTCACCAACTGGGACGACA-3'/5'-AGGCGTACAGGGACAGC-3',扩增长度为208 bp。
1.3 细胞培养 取间情期成年绵羊的输卵管组织,剪除浆膜和脂肪组织,剖开输卵管,经0.05 %胰酶消化后,刮取输卵管内层细胞,经PBS 洗涤2 次后,加入含胎牛血清DMEM/F12 培养液,接种于75 cm2培养瓶中,于37 ℃5 % CO2中培养。传至第2 代,饥饿处理14 h,进行后续试验。以上所分离得到的细胞已经过形态学和免疫荧光等方法鉴定为绵羊输卵管上皮细胞。
1.4 细胞干预试验
1.4.1 检测LPS 处理后SBD-1 表达变化 取同一批次绵羊输卵管上皮细胞,对细胞添加不同剂量的LPS(10 ng/mL、50 ng/mL、100 ng/mL、200 ng/mL、1 mg/mL),分别培养不同时间(0 h、1 h、3 h、6 h、12 h 和24 h),以培养基替代LPS 作为阴性对照(0 ng/mL LPS)。在各相应时间点提取细胞总RNA,并以其反转录制备的cDNA 为模板,通过荧光定量PCR(qPCR)检测SBD-1 表达量变化[8],以确定LPS的最佳添加剂量和效应时间。
1.4.2 检测LPS 处理后P38 MAPK 表达变化 取同一批次绵羊输卵管上皮细胞,以LPS 最佳添加量,分别培养不同时间(0 min、10 min、20 min、40 min、80 min 和160 min),以0 min 收集的细胞作为阴性对照组。在各相应时间点收集细胞,采用裂解液裂解收集的细胞,超声破碎60 s,12 000 r/min 4 ℃低温离心10 min,取上清液,测定蛋白浓度,蛋白经SDS-PAGE 检测后转膜,5%脱脂奶粉室温封闭2 h;分别以GAPDH(1∶500)、P38(1∶500)、p-P38(1∶200)为一抗,山羊抗兔IgG-HRP(1∶4 000)为二抗,ECL显影。进行western blot 检测P38 蛋白的表达情况,以确定LPS 对P38 MAPK 通路影响。
1.4.3 P38 MAPK 通路阻断试验 取同一批次绵羊输卵管上皮细胞,分成6 组,第1 组为阴性对照,只添加无血清培养基;第2 组添加100 ng/mL LPS;第3 组添加P38 抑制剂SB203580(10 μM)和100 ng/mL LPS;第4 组添加SB203580(25 μM)和100 ng/mL LPS;第5 组添加P38 抑制剂SB202190(10 μM)和100 ng/mL LPS;第6 组添加P38 抑制剂SB202190(25 μM)和100 ng/mL LPS。12 h 后收集细胞,提取细胞总RNA,通过qPCR 方法检测SBD-1 表达量变化。总RNA 的提取与qPCR 扩增方法参见1.4.1。
1.5 数据统计与分析 试验数据经过收集、计算和整理后,通过数据分析软件SPSS 19.0 进行单因素方差分析,根据分析结果进行绘图。
2 结果
2.1 LPS对绵羊输卵管上皮细胞SBD-1基因表达的影响 对输卵管上皮细胞添加不同剂量的LPS,确定LPS 对绵羊输卵管上皮细胞SBD-1 表达的影响。结果显示,添加LPS 后,SBD-1 的表达量均有所升高,其中添加100 ng/mL LPS 组SBD-1 表达量最高(图1),所以确定后续试验添加100 ng/mL LPS,以观测SBD-1 基因表达变化。

图1 LPS 对绵羊输卵管上皮细胞SBD-1 基因的表达的剂量依赖关系Fig.1 The dose dependent of SBD-1 by LPS in ovine oviduct epithelial cells
为进一步明确LPS 与SBD-1 表达的调控关系,细胞添加100 ng/mL LPS,并在不同时间点收样,经qRT-PCR 检测结果显示,添加100 ng/mL LPS 后SBD-1 表达量在3 h 迅速增加,并在12 h 达到最高峰,之后在24 h 略有下降(图2)。与对照组相比,LPS 对SBD-1 的上调在6 h 开始出现极显著差异。后续试验添加LPS 的刺激时间为12 h。
2.2 LPS对P38 MAPK通路的影响 对绵羊输卵管上皮细胞添加LPS 检测P38 蛋白磷酸化情况,在细胞培养中添加100 ng/mL LPS 后于各个时间点收样,western blot 结果显示,添加LPS 后总P38 蛋白表达量无明显变化,而p-P38 蛋白在10 min 后逐渐增加,并且一直持续到20 min,达到峰值;在20 min后,p-P38 表达量逐渐降低,在160 min 基本与0 h对照组无显著性差异(图3)。
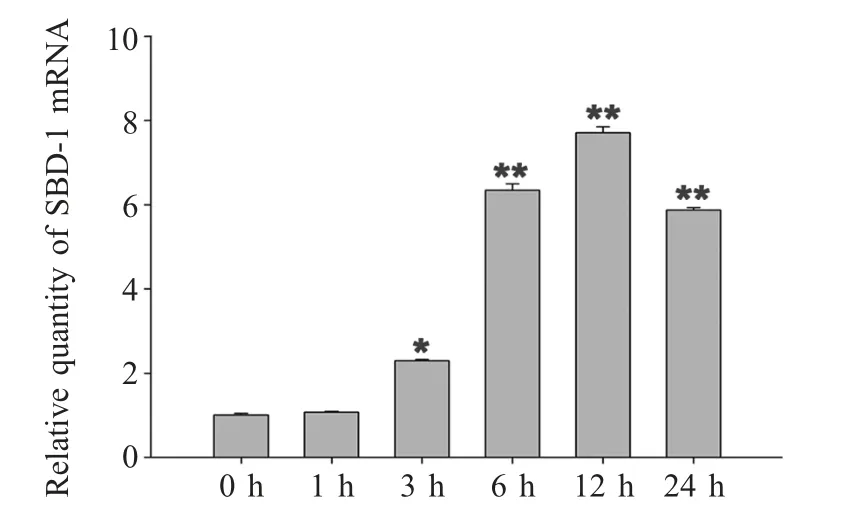
图2 LPS 对绵羊输卵管上皮细胞SBD-1 表达的时间依赖关系Fig.2 The time dependent of SBD-1 by LPS in ovine oviduct epithelial cells

图3 添加LPS 后绵羊输卵管上皮细胞p-P38 和P38 蛋白变化Fig.3 The change of p-P38 and P38 protien under treated with LPS in ovine oviduct epithelial cells
2.3 P38 MAPK通路阻断试验 通过添加P38 抑制剂,经qPCR 方法检测各组细胞中SBD-1 表达量的变化。结果显示:添加LPS 和P38 抑制剂组(SB203580、SB202190)和只添加LPS 组相比,SBD-1 表达量显著性降低,差异极显著;而上述添加抑制剂组同对照组相比差异不显著(图4),表明LPS 诱导SBD-1 表达的途径需要通过P38 信号通路。
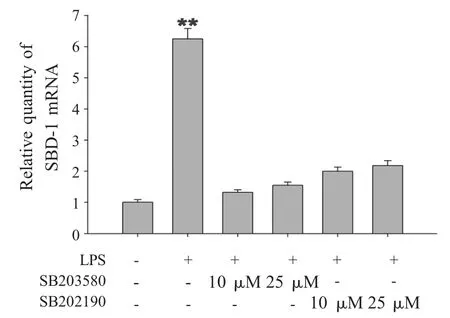
图4 LPS 诱导SBD-1 表达通过P38 途径Fig.4 LPS-induced SBD-1 expression via P38 pathway
3 讨论
长期以来国内外滥用抗生素使病原菌耐药性增加,影响治疗效果,因此积极研制可取代抗生素且无药物残留的药物成为当今医药学界研究的一个热点[9]。β-防御素具有重要的抗感染功能,是机体自身内源性抗菌肽[10]。利用β-防御素作为药物防治输卵管炎已成为关注的一个新方向。因此,研究β-防御素的调控机制为进一步探索输卵管炎发病机理、合理开发及利用输卵管炎相关药物奠定了理论基础。
本研究建立并优化了输卵管上皮细胞的分离和培养平台,并结合绵羊的常见感染源,构建以LPS模拟细菌侵染细胞的模型。结果表明,LPS 可呈浓度和时间依赖方式诱导绵羊输卵管上皮细胞中SBD-1 的表达。由于绵羊的生存环境的复杂性,生殖道的感染源并不是单一的,本研究重点讨论由革兰氏阴性细菌细胞壁主要成分LPS 所引起的输卵管炎的调控机制。在漫长的进化过程中,动物体内尤其是生殖道内自然产生的免疫排斥机制是保守的,但同时也绝非一成不变的。其他感染源是如何激活绵羊输卵管的免疫系统仍然需要进一步的研究。
我们参照LPS 引起炎症反应的分子机制,选取了经典的P38 MAPK 通路来研究LPS 调控绵羊输卵管上皮细胞SBD-1 表达的具体机制。本研究通过对绵羊输卵管上皮添加LPS 检测P38 MAPK 通路的活化情况。结果显示,P38 通路可被LPS 迅速激活。而MAPK 通路的另外两条JNK、ERK 通路是否能被LPS 所激活,则需要进一步的研究。另外,P38 MAPK 抑制剂SB203580 和SB202190 和LPS 共孵育实验结果表明,抑制P38 MAPK 可以明显阻断由LPS 所诱导的SBD-1 表达。这些结果表明,细菌感染绵羊输卵管后,LPS 可以在半小时内通过激活P38 MAPK 通路诱导高水平的SBD-1 表达。P38 MAPK 通路需要入核基因的启动,增强SBD-1 的转录表达,其中分子机制还需要我们通过CHIP 等技术进一步分析。
本研究结果表明细菌细胞壁主要成分LPS 可以显著诱导绵羊输卵管上皮细胞表达SBD-1,而P38 MAPK 通路参与调控这个过程。本研究对于细菌感染所引起的输卵管炎有了进一步的认识,随着研究深入,我们会更加了解和认识防御素,并根据其生理生化特性开发出相应的对抗微生物感染的药物,解决畜牧生产中的很多疾病。
[1]蒋建新,姚咏明,郑江.细菌内毒素基础与临床[M].北京:人民军医出版,2004.
[2]Ryu Su-Jung,Choi Hyeon-Son,Yoon Kye-Yoon,et al.Oleuropein suppresses LPS-induced inflammatory responses in RAW 264.7 cell and zebrafish[J].J Agric Food Chem,2015,63(7):2098-2105.
[3]Ganz T.Defensins:antimicrobial peptides of vertebrates[J].C R Biol,2004,327(6):539-549.
[4]孙岩,王路,温俊歌,等.β-防御素在天然免疫中的作用[J].动物医学进展,2011,32(5):120-123.
[5]Diamond G,Beckloff N,Weinberg A,et al.The roles of antimicrobial peptides in innate host defense[J].Curr Phaim Des,2009,15(21):2377-2392.
[6]Huttner K M,Brezinski-Caliguri D J,Mahoney M M,et al.Antimicrobial peptide expression is developmentally regulated in the ovine gastrointestinal tract[J].J Nutr,1998,128(Suppl2):297-299.
[7]唐博,曹贵方,吕东媛,等.蒙古绵羊雌性生殖道β-防御素(SBD-1)的序列分析及组织表达[J].中国兽医学报,2008,28(8):987-990.
[8]包图雅,曹贵方,曹金山,等.几种不同信号通路的抑制剂对17β-雌二醇诱导绵羊输卵管上皮细胞β-防御素-1(SBD-1)基因转录的影响[J].内蒙古大学学报(自然科学版),2010,41(04):398-403.
[9]Prost A.Compelling case for non-antibiotic mastitis treatment[J].Western Dairu Farmer,2005(6):30-31.
[10]Yarus S,Rosen J M,Cole A M,et al.Production of active bovine tracheal antimicrobial peptide in milk of transgenic mice[J].PNAS USA,1996,93(24):14118-14121.

