牛支原体及其脂质相关膜蛋白诱导胎牛肺细胞IL-1β 表达的分子机制研究
刘素丽,汪 洋,李 媛,周玉梅,高利萍,邵佳日,2,王 琪,陈 莹,辛九庆*
(1.中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物支原体病研究室,黑龙江 哈尔滨 150001;2.吉林农业大学 动物科学技术学院,吉林 长春 130118;3.东北农业大学 资源与环境学院,黑龙江 哈尔滨 150030;4.东北农业大学 动物医学院,黑龙江 哈尔滨 150030)
)
牛支原体(Mycoplasma bovis)属于柔膜体纲,支原体目,支原体属,缺乏细胞壁,对抗生素不敏感。最早于1961 年在患乳房炎的病牛中分离鉴定,2008 年我国首次从患肺炎犊牛肺脏中分离到M.bovis[1]并于2011 年完成Hubei-1 株的全基因组序列测定[1]。
M.bovis 为牛支原体相关疾病的病原体,主要引起牛的肺炎,犊牛关节炎和中耳炎等,是北美、欧洲和亚洲的一种主要病原[3-4]。支原体基因组小,G+C 含量低,生物合成及代谢能力低。但在支原体膜表面存在着大量的支原体脂质相关膜蛋白(Lipid-associated membrane proteins,LAMPs)。支 原体LAMPs 是介导支原体黏附宿主、侵入宿主的基础。同时,支原体LAMPs 能够与细胞膜表面受体结合,激发宿主的免疫应答[5]。
1 材料和方法
1.1 菌株、载体和细胞 M.bovis Hubei-1 株由本实验室分离鉴定;pMD18-T 和pCMV-C-EGFP 均由本实验室保存;原代胎牛肺(EBL)细胞由本实验室制备。
1.2 主要试剂 LA Taq DNA 聚合酶和T4 连接酶购自TaKaRa 公司;XhoⅠ和KpnⅠ购自NEB 公司;质粒提取试剂盒和胶回收试剂盒购自Omega 公司;TRIzol 试剂和Lipofectamine 2000 购自Invitrogen 公司;反转录试剂盒和SYBR Green Master(Rox)荧光染料购自Roche 公司;红外荧光DyLight700 标记的羊抗鼠IgG 和DyLight700 标记的羊抗兔IgG 购自Licor 公司;DAPI 购自碧云天生物技术研究所;LAMPs 由本实验室按文献[6]的方法制备。
1.3 引物的设计与合成 根据NCBI 中登录的EBL细胞p65 基因序列(DQ355511.1)和IL-1β 基因序列(NM 174093)分别设计扩增p65 基因的引物p65f/p65r[5'-AGACTCGAGCTATGTTCGACCTGTTCGC-3'(Xho I)/5'-GGGGTACCTTATCTGCTGATCCGACTCCG-3'(Kpn I)]和检测IL-1β 表达的引物IL-1β-f/IL-1β-r(5'-CTAGC TCATGTATTCTGAAG-3'/5'-CCTTAACTGGCCTCTTC AGC-3')及内参引物GAPDH-f/GAPDH-r(5'-ATCTCTG CACCTTCTGCCGA-3'/5'-GCAGGAGGCATTGCTGAC A-3')。
1.4 重组质粒pEGFP-p65的构建及鉴定 利用TRIzol 法提取EBL 细胞的总RNA,通过反转录制备cDNA,并以其为模板,利用特异性引物进行p65目的基因的扩增,将扩增得到的p65 基因通过XhoⅠ/KpnⅠ双酶切克隆于pCMV-C-EGFP 载体中,构建重组质粒pEGFP-p65,并进行测序鉴定。
1.5 M.bovis诱导EBL细胞IL-1β 表达的检测 以一定量的活M.bovis 及60℃30 min 灭活的M.bovis分别刺激EBL 细胞,刺激不同时间,检测IL-1β的表达;以不同剂量活的M.bovis 刺激EBL 细胞不同时间,提取各细胞总RNA 反转录制备cDNA,并以其为模板,通过GAPDH 基因作为内参进行SYBR Green I 荧光定量PCR 检测IL-1β 的表达。
1.6 LAMPs刺激EBL细胞的最佳剂量确定 分别以0.5 μg/mL、1 μg/mL、2 μg/mL、4 μg/mL 或8 μg/mL LAMPs 刺激EBL 细胞12 h,提取各组细胞总RNA反转录制备cDNA,并以其为模板利用荧光定量PCR 检测IL-1β 的相对表达水平,确定LAMPs 作用的最佳剂量。
1.7 LAMPs刺激EBL细胞的最佳时间确定 以1.6 中确定的LAMPs 最佳剂量刺激EBL 细胞0 h、2 h、6 h、12 h 或24 h,提取各组细胞总RNA 反转录制备cDNA,并以其为模板利用荧光定量PCR 检测IL-1β 的相对表达水平,确定最佳时间。
1.8 LAMPs刺激EBL细胞后p65入核情况检测 将pEGFP-p65 转染于EBL 细胞后,以LAMPs 最佳剂量刺激EBL 细胞,刺激时间为1.7 确定的最佳时间,采用4 %多聚甲醛固定细胞后以DAPI 染核,通过激光共聚焦扫描系统观察p65 的亚细胞分布。
2 结果
2.1 重组质粒pEGFP-p65的构建 利用TRIzol 试剂提取EBL 细胞总RNA 并反转录成cDNA,以其为模板,通过特异性引物进行p65 的扩增,将扩增得到的p65 克隆于pCMV-C-EGFP 载体构建重组质粒pEGFP-p65,双酶切鉴定结果与预期结果相符,测序结果与参考序列(DQ355511.1)相似性为100%。
2.2 M.bovis诱导EBL细胞IL-1β 表达的检测 分别以一定量灭活M.bovis 和活M.bovis 刺激EBL 细胞不同时间检测其IL-1β 的表达。结果显示,灭活M.bovis 和活M.bovis 均能够诱导EBL 细胞IL-1β 的表达,与灭活M.bovis 刺激组相比,活M.bovis 刺激EBL 细胞3 h 后即可以使IL-1β 表达水平显著增加(图2A)。此外,以不同剂量活M.bovis 刺激EBL 细胞不同时间,结果显示,与未刺激组相比,106ccu活M.bovis 刺激6 h 后即可诱导EBL 细胞IL-1β 的表达水平显著增加(图2B)。
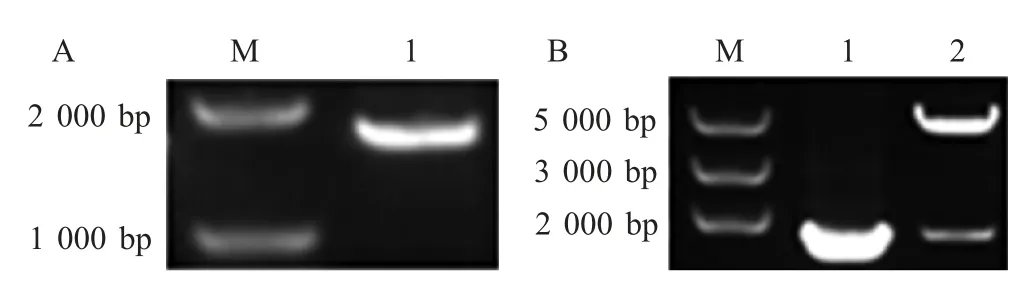
图1 p65 目的基因的扩增(A)及其重组表达质粒的鉴定(B)Fig.1 Amplification of p65 gene(A)and identification of pEGFP-p65(B)

图2 M.bovis 诱导EBL 细胞IL-1β 的表达Fig.2 The expression of IL-1β in EBL cells stimulated with M.bovis
2.3 LAMPs诱导EBL细胞IL-1β 表达的最佳剂量以不同剂量LAMPs 刺激EBL 细胞,荧光定量PCR结果表明IL-1β 表达水平分别在2 μg/mL 和8 μg/mL显著增加(图1),因此,选择2 μg/mL 作为LAMPs刺激的最佳剂量。
2.4 LAMPs诱导EBL细胞IL-1β 表达的最佳时间以2 μg/mL LAMPs 刺激EBL 细胞,作用时间分别为0 h、2 h、6 h、12 h 和24 h,荧光定量PCR 结果显示,IL-1β 在LAMPs 刺激12 h 和24 h 时显著增加(图4),因此,选择12 h 作为LAMPs 刺激EBL细胞的最佳时间。
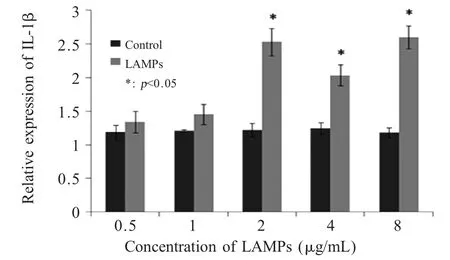
图3 不同剂量LAMPs 刺激IL-1β 的表达情况Fig.3 The expression of IL-1β induced by different concentrations of LAMPs
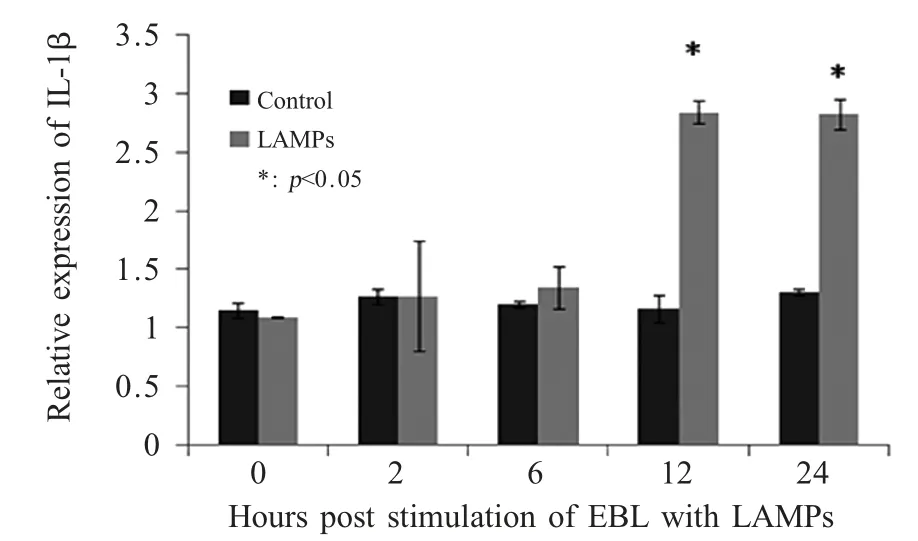
图4 LAMPs 刺激不同时间IL-1β 的表达情况Fig.4 The expression of IL-1β induced by the indicated concentrations of LAMPs for different time
2.5 LAMPs诱导EBL细胞中p65入核情况检测将pEGFP-p65 转染EBL 细胞,以2 μg/mL LAMPs 刺激EBL 细胞12 h,细胞经DAPI 染核后,在激光共聚焦扫描显微镜下检测到LAMPs 刺激的EBL 细胞中p65 主要分布于细胞核内,而未受LAMPs 刺激对照细胞中p65 呈胞浆均匀分布(图5)。

图5 激光共聚焦检测LAMPs 诱导p65 入核Fig.5 Nuclear translocation of p65 induced by LAMPs was detected by confocal laser microscope
3 讨论
EBL 细胞是由胎牛肺组织制备的一种原代细胞。该细胞一般可以传代至60 代左右[7]。该细胞是研究牛的病毒性、细菌性疾病的一个重要的细胞模型。支原体及其LAMPs 能够诱导其自然宿主体外培养细胞相关细胞因子的表达;同时,支原体诱导细胞因子的表达主要是通过NF-κB 等信号通路[8]。NF-κB 信号通路包括经典和非经典通路两部分,经典通路中,NF-κB 以p65:p50 二聚体形式易位至细胞核,与靶基因的启动子或增强子特异序列结合,调控相关基因的转录表达,参与炎症反应、免疫应答和细胞凋亡等生理病理过程。IL-1β 是一个重要的细胞因子,在许多病原及其毒力蛋白感染宿主过程中上调表达。吴移谋等将提取的穿透支原体(M.penetrans)的LAMPs 刺激人单核细胞(THP-1)能够激活NF-κB 信号通路[9]。
本研究中,以EBL 细胞作为LAMPs 刺激的靶细胞,经不同浓度LAMPs 刺激后,利用相对荧光定量PCR 检测细胞因子IL-1β 的表达水平,结果显示,LAMPs 浓度为2 μg/mL 和8 μg/mL 时IL-1β 的表达水平显著增高,因此确定LAMPs 的最佳浓度为2 μg/mL;以此最佳浓度刺激EBL 细胞作用不同时间,结果显示,刺激12 h 和24 h 后IL-1β 表达水平显著增高因此确定LAMPs 的最佳刺激时间为12 h。为了证明LAMPs 能够诱导p65 活化入核,本研究从EBL 细胞中扩增p65 基因,构建重组质粒pEGFPp65 并将其转染于EBL 细胞,然后以2 μg/mL LAMPs 刺激EBL 细胞12 h,利用激光共聚焦检测p65 的亚细胞分布。结果显示,融合表达的p65 和绿色荧光蛋白从胞浆均匀分布快速易位为细胞核中分布。因此,上述结果证明LAMPs 是通过诱导p65进入细胞核,并激活NF-κB 信号通路,促进细胞因子IL-1β 的上调表达,引发非特异性免疫应答抵御M.bovis 侵害。本研究为进一步研究M.bovis 的免疫机制奠定了基础。
[1]辛九庆,李媛.国内首次从患肺炎的犊牛肺脏中分离到牛支原体J.中国预防兽医学报,2008,30(9):661-664.
[2]Li Yuan,Xin Jiu-qing.The complete genome sequence of Mycoplasma bovis strain Hubei-1[J].PLoS One,2011,6(6):e20999.
[3]Nicholas R A,Ayling R D,Stipkovits L P.An experimental vaccine for calf pneumonia caused by Mycoplasma bovis:clinical,cultural,serological and pathological findings[J].Vaccine,2002,20:3569-3575.
[4]Pfutzner H,Sachse K.Mycoplasma bovis as an agent of mastitis,pneumonia,arthritis and genital disorders in cattle[J].Rev Sci Tech,1996,15:1477-1494.
[5]Into T,Okada K,Inoue N,et al.Extracellular ATP regulates cell death of lymphocytes and monocytes induced by membranebound lipoproteins of Mycoplasma fermentans and Mycoplasma salivarium[J].Microbiol Immunol,2002,46:667-675.
[6]Takashi S,Yutaka K,Koichi K,et al.A dipalmitoylated lipoprotein from Mycoplasma pneumoniae activates NF-κB through TLR1,TLR2,and TLR6[J].Immunology,2005,175:4641-4646.
[7]Song Zhi-qiang,Li Yuan,Liu Yang,et al.α-enolase,an adhesion-related factor of Mycoplasma bovis[J].PLoS One,2012,7,e38836.
[8]Masmudur M,Grant M.Modulation of NF-κB signaling by microbial pathogens[J].Nature,2011,9:291-306.
[9]吴移谋,曾焱华,邓仲良,詹利生,李忠玉,陈超群.穿透支原体脂质相关膜蛋白诱导人单核细胞产生炎症性细胞因子[J].中华传染病杂志,2006,24,251-253.

