杀菌性/通透性增加蛋白对感染绵羊肺炎支原体的盘羊杂交羊的免疫调节作用研究
郭海英,沈 文,陈冬梅,陈凯丽,高宝德,张晓丽,孙延鸣*
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.石河子大学 生命科学学院,新疆 石河子 832003)
巴什拜羊是新疆地区优良的地方品种,盘羊是国家二级野生保护动物,二者均具有很强的适应性和抗病能力。资料报道新疆野生盘羊与巴什拜母羊的杂交后代羊继承了它们的优良生产性能[1],但该幼龄杂交后代较巴什拜羔羊易感绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)而引起大量死亡。推测盘羊的杂交后代可能存在先天性免疫能力下降,其可能与羊的疾病抗性基因变异有关[2]。
杀菌通透性增加蛋白(Bactericidal/permeabilityincreasing protein,BPI)是存在于人和哺乳动物中性粒细胞内的一种阳离子抗菌肽,具有杀灭革兰氏阴性菌、中和内毒素等活性,在动物机体先天免疫中起重要的作用[3]。研究表明BPI 具有抑制促炎细胞因子IL-6 等的作用,促进抗炎因子如IL-10 的表达,减轻炎症反应[4]。一些促炎细胞因子也是MO 感染的急性和慢性过程中重要组成部分,在肺部防御与炎症中起重要的作用[5],Pietsch 等建立肺炎支原体BALB/c 小鼠模型检测细胞因子基因的表达水平,其中IL-1β、IL-6、IFN-r、IL-4 等表达水平具有显著变化[6]。
本实验室前期研究发现巴什拜羊及杂交羊的BPI 基因N 端活性区域有3 处核苷酸差异,并导致3 处氨基酸改变。为进一步研究BPI 蛋白的免疫调节功能,本研究将MO 人工感染盘羊杂交羊,利用真核表达的重组BPI 蛋白(rBPI)进行免疫调节试验,同时测定了外周血中IL-1β、IL-4、IL-6 及BPI 表达量的变化规律,为研究BPI 在MO 的抗病机理研究中奠定了基础。
1 材料和方法
1.1 菌株、蛋白和实验动物 MO 菌株由石河子大学动物科技学院预防兽医实验室提供,与Y-98 标准株的同源性为98 %;巴氏拜羊rBPI 由本实验室表达制备,并且前期研究表明80 μg/mL rBPI 对大肠杆菌及沙门氏菌具有抑制作用[7];12 只盘羊杂交羊(盘羊♂×巴什拜羊♀)及6 只巴什拜羊由塔城裕民县提供,均为2 月龄~3 月龄,体质量为10 kg~15 kg,MO ELISA 抗体检测均为阴性。
1.2 主要试剂 MO ELISA 诊断试剂盒购自ADL公司;嗜中性粒细胞分离液购自天津市灏洋生物制品科技有限责任公司;绵羊IL-1β、IL-4、IL-6、ELISA 试剂盒购自上海蓝基Blue Gene 公司;TRIzol购自Invitrogen 公司;SYBR Premix Ex TaqTM和Prime Script RT reagent Kit 购自TaKaRa 公司。
1.3 实验羊分组、人工感染及rBPI注射 参照文献[2]方法对实验羊人工感染MO,2 mL/只(106ccu/mL),试验全程中饲喂均不添加抗生素。6 只巴什拜羊为A 组,12 只盘羊杂交羊随机分为B、C 2个组,感染MO 后的第4 d 开始C 组羊每天注射rBPI 2 mL(浓缩后浓度为74.54 mg/mL),A 和B 组羊注射同体积的生理盐水。
1.4 临床观察与病原的分离鉴定 在感染后2 周,从每组随机抽取2 只实验羊采集鼻腔棉拭子,接种于支原体专用培养基培养,在5%CO237 ℃培养4 d,培养基由粉红转为黄色为阳性,并进行理化特性鉴定[8]。每日定时测量记录体温,并观察临床症状,直至21 d 实验结束后迫杀,检查肺脏病变。
1.5 感染前后嗜中性粒细胞BPI的表达水平检测在感染前及感染后的第2 d、5 d、7 d、14 d、21 d,分别采取静脉血分离嗜中性粒细胞,采用TRIzol 抽提法提取总RNA 并反转录制备cDNA,于-20 ℃保存备用。参考GenBank 中绵羊的BPI(XP_004014614)和GAPDH(HM043737.1)序列,利用Primer primer 5.0 分别设计引物,BPI 引物(F:5'-CTCGGGAAAG GGCAATACA-3'/R:5'-CCTCCACACTCAGGTCAAA-3'),GAPDH 引 物(F:5'-TCCGTTGTGGATCTGACCTG-3'/R:5'-CCCTGTTGCTGTAGCCGAAT-3'),引物由北京华大基因公司合成。分别以3 组cDNA 作为模板,进行荧光定量PCR 检测,每个样品均重复3 次,所得数据采用2-△△Ct法进行处理。
1.6 感染前后血清细胞因子的ELISA检测 在感染前及感染后的第2 d、5 d、7 d、14 d、21 d,颈静脉采血分离血清,-20 ℃保存备用。参照ELISA试剂盒说明书检测血清中细胞因子IL-1β、IL-4 及IL-6 的浓度。以OD450nm值为纵坐标,以标准品的浓度为横坐标绘制标准曲线。
1.7 数据分析 采用SPSS 17.0 软件分析比较不同实验组间血清中IL-1β、IL-4、IL-6 的浓度及BPI 表达水平差异,采用Duncan's multiple range test 分析数据。
2 结果
2.1 病原分离鉴定与临床观察结果 鼻腔采集的棉拭子使用常规方法培养MO,当培养基由粉红转为黄色时取培养物涂片姬姆萨染色镜检,可见球形及多形性支原体,接种于支原体平板,4 d 后在显微镜下可观察到典型支原体菌落,同时经生化鉴定,结果表明样本均为MO 感染,阳性率为100 %,表明实验羊均已人工感染MO。
在感染后2 d~3 d,A 组实验羊均表现为食欲减退、体温一过性升高(40 ℃~41℃),呼吸啰音之后体温恢复正常,无死亡病例,剖检后肺表面有轻微出血点;B 组杂交羊体温持续升高(40 ℃~42 ℃),有咳嗽、流浆液性鼻涕、严重呼吸啰音及腹泻症状,2 只实验羊死亡,剖检肺表面有不同程度的粉色肉变和肝变,有出血点出血斑,死亡率为33 %;C 组杂交羊起初体温升高、食欲减退、咳嗽症状,后期体温正常,饮食量增加,无死亡病例,剖检肺表面有出血点和出血斑。结果显示,C 组杂交羊经rBPI 治疗后,临床症状和病理变化有所减轻。
2.2 BPI表达水平检测结果 人工感染前后各组羊血液嗜中性粒细胞中BPI 相对表达水平如图1 所示。感染MO 后,起初BPI 的表达量逐渐升高,第2 d、5 d 3 组之间差异不显著。在第7 d,C 组BPI基因的相对表达水平显著低于A、B 组(p<0.05),在第14 d~21 d C 组极显著高于B 组(p<0.01),而在第7 d~21 d A 组极显著高于B 组(p<0.01)。

图1 感染MO 前后各组实验羊BPI-mRNA 的动态表达水平Fig.1 The relative expression levels of BPI-mRNA in different groups at pre-and post-infection of rBPI
2.3 IL-1β 检测结果 人工感染前后各组实验羊的IL-1β 表达量如图2 所示,在攻毒后第2 d,3 个组的IL-1β 表达量逐渐升高。C 组注射rBPI 后,在第7 d~21 d,其IL-1β 表达量分别显著低于A、B组(p<0.01),在第21 d A 组IL-1β 显著低于B 组(p<0.05)。
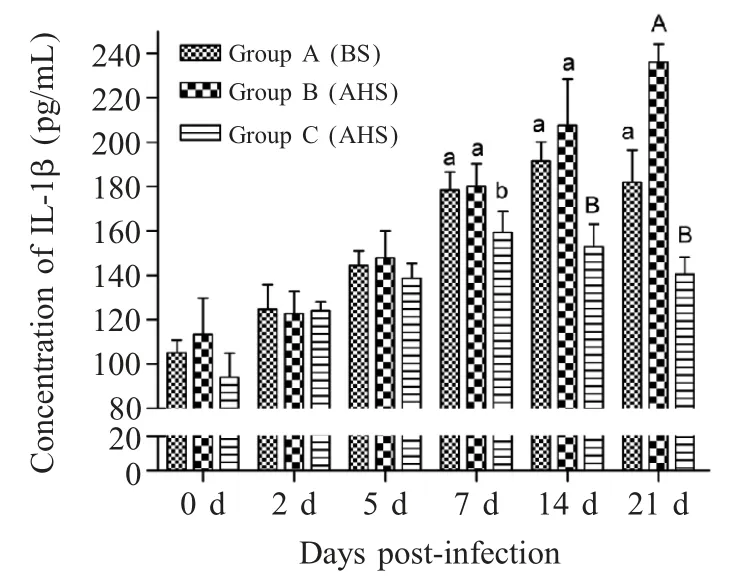
图2 感染MO 前后各组羊IL-1β 的浓度Fig.2 Concentration of IL-1β of each group at preand post-injection of protein
2.4 IL-4检测结果 人工感染前后各组羊的IL-4表达量如表3 所示,在感染后第2 d,3 组的IL-4 表达量均逐渐下降。在感染后的第7 d~21 d,C 组IL-4 表达量分别极显著高于对照组A、B 组(p<0.01);在第14 d~21 d,A 组IL-4 显著高于B 组(p<0.05)。
2.5 IL-6检测结果 人工感染前后各组实验羊的IL-6 表达量如表4 所示,感染后血清中IL-6 表达量逐渐升高,在第14 d~21 d,C 组的IL-6 极显著低于A、B 组(p<0.01),A 组也显著低于B 组(p<0.05)。

图3 感染前后各组羊IL-4(pg/mL)的浓度Fig.3 Concentration of IL-4(pg/mL)of each group at preand post-injection of protein
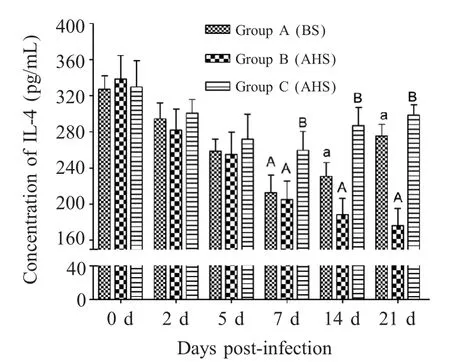
图4 感染前后各组羊IL-6(pg/mL)的浓度Fig.4 Concentration of IL-6(pg/mL)of each group at preand post-injection of protein
3 讨论
BPI 具有杀灭革兰氏阴性菌、结合内毒素的作用,被誉为“超级抗生素”[9],近年来BPI 作为先天免疫中的一种免疫防御分子在感染性疾病中的作用倍受关注。本实验以绵羊支原体肺炎为疾病模型,注射rBPI,动态检测外周血中BPI 基因表达及3 种细胞因子变化。初步证明注射rBPI 的杂交羊BPI 表达水平显著增加,临床症状减轻,未发现死亡,而对照组杂交羊的BPI 在后期下降迅速,死亡率达33.3%,表明rBPI 对感染MO 的杂交羊具有一定抗病作用。此外,MO 感染后所有实验羊的BPI 水平均升高,其中A 组巴氏拜羊的BPI 水平在14 d 和21 d 明显高于B 组盘羊杂交羊(p<0.01),并且巴什拜羊在感染后仅出现较轻的炎症反应,由此表明,体内BPI 水平可能因绵羊品种不同而导致感染后症状差异明显。
IL-1β 是一种生物学功能非常复杂的多肽细胞因子,是参与免疫反应与炎症反应的重要调节剂。研究表明肺炎支原体感染过程中,人外周血单核细胞、人肺上皮肿瘤细胞A549 等均表达高浓度的IL-1β[10]。BALB/c 小鼠支原体肺炎模型中在其初期和后期感染过程中,IL-1β mRNA 表达水平增加[6],与本实验结果一致,而注射rBPI 后,治疗C 组杂交羊的IL-1β 表达量在第7 d 之后逐渐下降,可能使患羊肺炎炎症减轻,与临床症状相符。
IL-4 是一种具有多种生物效应的细胞因子,肺炎支原体感染机体后,血清中IL-4 水平的变化情况报道结果不一。Esposito 等报道在急性支原体肺炎患儿血清IL-4 水平与正常组相比无显著性差异[11]。季钗等报道,肺炎急性期儿血清IL-4 水平极显著低于对照组,而恢复期IL-4 水平较急性期上升[12]。本实验中,感染MO 后IL-4 水平逐渐降低,rBPI 治疗后,治疗C 组杂交羊血清IL-4 浓度逐渐升高,有助于调节紊乱的TH1/TH2 免疫平衡,使机体趋向于恢复正常。
IL-6 是另一种重要的促炎细胞因子,在人支原体肺炎感染中作为一种重要的非特异性炎症因子,参与肺部炎症病理过程。有研究表明肺炎支原体感染的病人中血清IL-6 水平升高,可以作为支原体肺炎的鉴定及严重程度的一个重要的指标[13]。田芳等发现肺炎支原体患儿重症组治疗前外周血IL-6 表达量显著高于轻症组,并且两者均明显高于正常儿童,在治疗后恢复期IL-6 表达量又明显在下降,是反映支原体肺炎病情的良好指标[14]。本实验人工感染MO 后,血清IL-6 的水平逐渐升高;注射rBPI后,治疗C 组杂交羊的血清IL-6 表达量在第14 d以后逐渐下降,而未经治疗的B 组杂交羊则继续升高,与田芳等检测结果一致,表明rBPI 可以降低患羊的IL-6 水平,使机体处于恢复期,对机体有利。
不同品种绵羊感染MO 后表达BPI 水平有差异,巴什拜羊对肺炎支原体表现为抗性,其BPI 水平表达量相对较高,rBPI 对易感MO 的盘羊杂交羊具有一定的免疫调节及治疗效果,本研究为MO 的临床治疗和新药的研发提供新的实验依据。
[1]马长宾,孙延鸣,朱晓光,等.新疆野生盘羊与巴什拜羊杂交一代生产性能测定[J].畜禽业,2009,2:44-45.
[2]姜方配,沈文,鲁海富,等.ISG15 蛋白对感染绵羊肺炎支原体的盘羊杂交羊的免疫调节作用[J].中国预防兽医学报,2013,35(11):925-928.
[3]胡伶俐.牛杀菌-通透性增加蛋白和防御素基因融合质粒的构建及其在大肠杆菌中表达[D].武汉:华中农业大学,2010.
[4]祝威,汪欣,杜宝东.杀菌-通透性增强蛋白对分泌性中耳炎大鼠中耳黏膜TNF-α 和IL-6 表达的影响[J].吉林大学学报:医学版,2004,30(1):41-44.
[5]Michelow I C,Katz K,McCracken G H,et al.Systemic cytokine profile in children with community-acquired pneumonia[J].Pediatr Pulmonol,2007,42(7):640-645.
[6]Pietsch K,Ehlers S,Jacobs E.Cytokine gene expression in the lungs of BALB/c mice during primary and secondary intranasal infection with Mycoplasma pneumoniae[J].Microbiology,1994,140(8):2043-2048.
[7]陈冬梅,沈文,刘恺,等.巴什拜羊BPI 基因的克隆与真核表达[J].江苏农业科学,(In Press),2015,5.
[8]张萍慧,郝永清,张爱荣,等.绵羊肺炎支原体的分离与鉴定[J].畜牧与饲料科学,2010,31(1):142-143.
[9]张海燕,刘金梅,毛景欣.杀菌性/通透性增加蛋白(BPI)极其在荣昌猪抗病育种上的研究进展[J].畜禽业,2009,245(9):36-38.
[10]Yang J,Hooper W C,Phillips D J,et al.Cytokines in Mycoplasma pneumoniae infections[J].Cytokine Growth Factor Rev,2004,15(2):157-168.
[11]Esposito S,Droghetti R,Bosis S,et al.Cytokine secretion in children with acute Mycoplasma pneumoniae infection and wheeze[J].Pediatr Pulmonol,2002,34:122-127.
[12]季钗,潘滔,陈黎勤.肺炎儿血清白细胞介素12 与白细胞介素4 水平及意义[J].试用儿科临床杂志,2001,16(2):83-84.
[13]Hsieh C C,Tang R B,Tsai C H,et al.Serum interleukin-6 and tumor necrosis factor-alpha concentrations in children with Mycoplasma pneumonia[J].Microbiol Immunol Infect,2001,34:109-112.
[14]田芳,韩波,段梅.肺炎支原体肺炎患儿血清TNF-α,IL-6及半乳凝素3 浓度测定的临床意义[J].中国当代儿科杂志,2014,16(10):1001-1004.

