猪瘟病毒衣壳蛋白与宿主细胞核仁素蛋白相互作用
张 鑫,时洪艳,徐 佳
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,黑龙江 哈尔滨 150001;2.黑龙江省动物卫生监督所,黑龙江 哈尔滨 150069)
猪瘟病毒(Classical swine fever virus,CSFV)为单股、正链、有囊膜的RNA 病毒,基因组大小为12.5 nt[1],仅含有一个ORF,编码一个多聚蛋白,水解后形成4 个结构蛋白和8 个非结构蛋白。CSFV衣壳蛋白(C)为结构蛋白与病毒RNA 形成复合体[2],具有转录调节作用,在病毒粒子成熟过程中发挥重要作用[3]。对CSFV C 蛋白的定位分析研究表明C蛋白定位在细胞核仁中[4]。
细胞核仁素(NCL)蛋白是一个在核仁中高度表达的细胞蛋白。NCL 在细胞浆和浆膜中也存在。NCL 参与一系列不同的细胞生理过程,包括核糖体的生物合成、蛋白质的转运、染色质重塑及翻译调控等[5]。
本实验通过共定位、GST pull-down 以及免疫共沉淀(Co-IP)等方法,鉴定C 蛋白与NCL 蛋白相互作用关系,为进一步研究CSFV 复制以及病毒与细胞之间的相互关系提供实验依据。
1 材料和方法
1.1 主要实验材料 pEGFP-CSFV-C 由本实验室构建[4];CSFV SHIMEN 株由本研究所刘长明惠赠;ST细胞由本实验室保存;质粒提取试剂盒购自QIAGEN 公 司;LipofectamineTM2000 购 自Invitrogen 公司;红色荧光TRITC 标记的山羊抗兔IgG 购自Gibco公司;鼠抗beta actin(ab6276)、兔抗NCL(ab22758)及兔抗GFP 抗体(ab183734)均购自Abcam 公司;DyLightTM800 标记的山羊抗兔IgG、山羊抗鼠IgG、FITC 标记的山羊抗鼠IgG 均购自KPL 公司;protein A/G PLUS-agarose 购自Santa Cruz Biot-echnology 公司;X-tremeGENE siRNA 转染试剂购自Roche 公司。
1.2 原核表达载体的构建 根据C 基因序列(AY775178),设计扩增C 蛋白基因引物F-GST-C:5'-GTGGATCCTCTGATGATGGCGCAAGTGG-3',RGST-C:5'-GTCTCGAGCGCCCATGCCAATAGGGCT TTT-3'。反应条件为:94 ℃5 min;94 ℃30 s、50 ℃30 s、72 ℃30 s,30 个循环;72 ℃10 min。将PCR 产物经Bam HⅠ和XhoⅠ双酶切后回收克隆于pGEX-6p 中构建重组质粒,重组质粒命名为pGEXCSFV-C,由北京华大基因生物技术有限公司测序。
1.3 C蛋白的表达与纯化 将重组质粒pGEX-CSFV-C 转化至感受态细胞BL21(DE3)中,经1 mM IPTG 诱导表达。收集菌体细胞,经1/10 体积的裂解液(1 mM EDTA,100 mM NaCl,1 % Triton X-100,50 mM Tris-base,pH8.0)裂解。表达的重组蛋白经Glutathione sepharoseTM4B 树脂进行纯化。
1.4 C蛋白与NCL蛋白在细胞中共定位分析 将ST 细胞接种共聚焦显微镜专用培养皿中,待细胞形成80 %~90 %单层时,将重组质粒pEGFP-CSFV-C按照LipofectamineTM2000 说明书进行转染,以pEGFP-c2 载体质粒作为对照。将转染后的细胞经PBS 清洗,多聚甲醛固定,自然干燥。以兔抗NCL抗体(1∶100)为一抗,37 ℃作用1 h,以TRITC 标记山羊抗兔IgG(1∶400)为二抗,37 ℃作用45 min。经5 μg/mL DAPI 染液染核,加入适量PBS 利用共聚焦显微镜进行观察。
1.5 GST pull-down试验 将纯化的GST-C 融合蛋白结合到Glutathione sepharoseTM4B 树脂上。ST细胞经1 mL RIPA 裂解缓冲液(50 mM Tris-HCl,pH7.4,150 mM NaCl,1 mM EDTA,and 1 % Triton X-100,1 mM PMSF)裂解。取500 μg 细胞裂解物加入到GST-C 蛋白与Glutathione sepharoseTM4B 混合物中,4 ℃作用过夜。PBS 清洗3 次,沉淀物采用12%SDS-PAGE 电泳检测后,进行western blot 分析。
1.6 Co-IP试验 pEGFP-CSFV-C 转染ST 细胞24 h后,ST 细胞经RIPA 裂解缓冲液裂解。裂解物经过阴性抗体和protein A/G PLUS-agarose 在4 ℃作用30 min 去除非特异性反应。取上清液,加入1 μg 兔抗NCL 抗体,4 ℃过夜后,加入20 μL protein A/G PLUS-agarose,4 ℃作用3 h。经PBS 洗涤3 次,沉淀物经12 % SDS-PAGE 电泳检测后,进行western blot 分析。
1.7 NCL蛋白siRNA干扰后对CSFV复制的影响NCL siRNA 序列由GenePharma 公司设计合成,序列如下:5'-GGAUGAUAGCAGCGGAGAATT-3'(sense),5'-UUCUCCGCUGCUAUCAUCCTT-3'(antisense)。siRNA 转染方法按照说明书进行,转染后37 ℃孵育48 h,接种CSFV SHIMEN 株(接种量为1 000 TCID50),病毒孵育36 h,收集病毒液。
1.8 病毒滴度测定 CSFV 经10 倍倍比稀释后接种至96 孔板中的ST 细胞,每个滴度8 个重复孔,36 h 后收集病毒液,采用Reed and Munch 方法测定病毒TCID50,重复计算3 次后利用Duncan 法进行数据分析。
2 结果
2.1 C蛋白表达与纯化鉴定 将pGEX-CSFV-C 转化至感受态细胞BL21(DE3)中,经IPTG 诱导表达并纯化后进行SDS-PAGE 分析,结果显示在约40 ku处可见一明显条带(图1A)。以GST 抗体为一抗进行western blot 鉴定,结果显示,GST-C 蛋白已正确表达,大小约为40 ku(图1B)。
2.2 C蛋白与NCL蛋白在细胞中共定位分析 将pEGFP-CSFV-C 质粒转染ST 细胞后,对CSFV C 蛋白与NCL 蛋白在ST 细胞中的共定位进行分析。结果显示,CSFV C 蛋白定位在细胞浆和核仁中,NCL 蛋白主要定位在核仁中,CSFV C 蛋白与NCL蛋白在核仁中存在共定位现象(图2)。
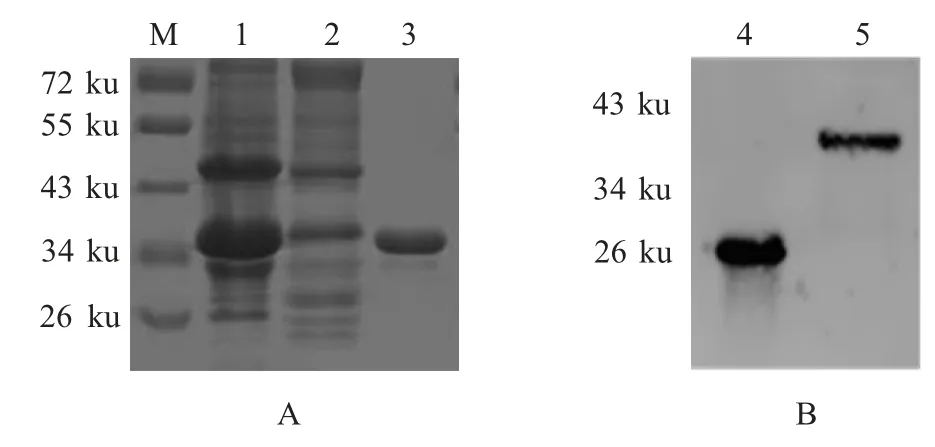
图1 C 蛋白表达的SDS-PAGE(A)分析及western blot(B)鉴定Fig.1 Expression and identification of GST-C protein by SDS-PAGE(A)and western blot(B)
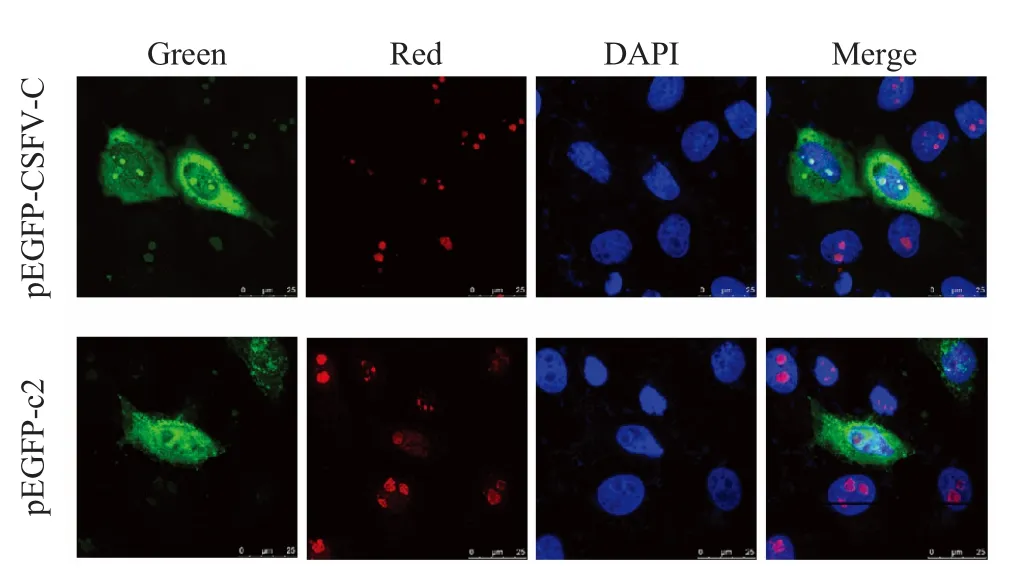
图2 C 蛋白与NCL 蛋白在细胞中共定位分析Fig.2 Co-localization of CSFV C and NCL protein
2.3 C蛋白与NCL蛋白在体外相互作用分析 采用GST pull-down 方法,以GST-C 蛋白捕获细胞中的NCL 蛋白,同时以GST 蛋白作为对照,进行western blot 检测。结果显示,以GST-C 蛋白进行的GST pull-down 试验,沉淀物中存在细胞的NCL 蛋白,而对照试验的沉淀物中无细胞的NCL 蛋白(图3),表明CSFV C 蛋白与ST 细胞中的NCL 蛋白存在相互作用。
2.4 C蛋白与NCL蛋白在转染细胞中相互作用分析 采用Co-IP 方法将pEGFP-CSFV-C 转染到ST 细胞中,同时以pEGFP-c2 空载体为对照。结果显示,在pEGFP-CSFV-C 转染的ST 细胞中进行Co-IP 试验,存在细胞的NCL 蛋白,而对照中无NCL 蛋白(图4),表明CSFV C 蛋白与NCL 蛋白在转染细胞中存在相互作用。
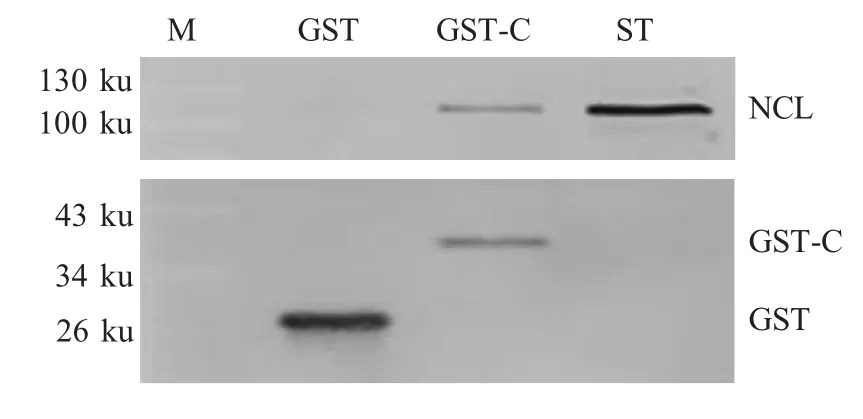
图3 C 蛋白与NCL 蛋白在体外相互作用分析Fig.3 Cellular NCL protein interacts with C protein of CSFV in vitro
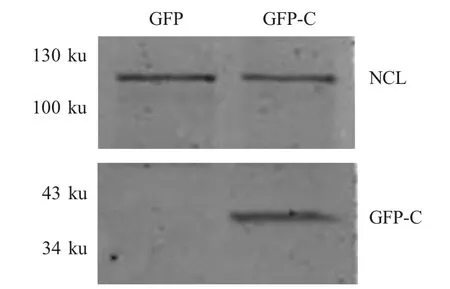
图4 C 蛋白与NCL 蛋白在转染细胞中相互作用分析Fig.4 Cellular NCL protein interacts with C protein of CSFV in transfected cells
2.5 NCL蛋白干扰后对CSFV复制的影响 采用siRNA 方法抑制NCL 蛋白后对细胞进行接毒,分析NCL 蛋白在CSFV 复制过程中的作用。结果显示NCL 蛋白被特异性siRNA 抑制后,CSFV 的复制能力下降(图5)。
3 讨论
CSFV C 蛋白不仅是病毒的结构蛋白,而且在病毒基因表达调控中具有重要作用[3]。CSFV C 蛋白与细胞的泛素化途径作用调控CSFV 生长周期[6]。CSFV 的复制和致病性依赖许多细胞因子[7]。前期研究中发现C 蛋白主要定位在细胞的细胞浆和核仁中[4]。在宿主细胞中,C 蛋白发挥生物学功能需要与细胞蛋白发生直接或者间接的相互作用。研究C 蛋白与宿主细胞蛋白的相互作用,将有助于对CSFV 复制机制的深入了解。
图5 NCL 蛋白干扰后对CSFV 复制的影响Fig.5 NCL knock down impair CSFV replication
NCL 蛋白是核仁中的磷酸化蛋白,具有多种生物学功能[8]。NCL 有助于病毒的黏附和进入[9-10]。并且与一些病毒蛋白存在着相互作用,如与1-型单纯疱疹病毒US11 蛋白、流感病毒(H3N2)NS1 蛋白及丙型肝炎病毒NS5B 蛋白均存在相互作用[11-13]。此外,NCL 与一些病毒的非编码区(UTR)存在着相互作用,包括猫嵌环状病毒和脊髓灰质炎病毒[14-15]。NCL 可能通过与病毒的蛋白或者非编码区的相互作用,在病毒复制中扮演一定的作用。
本研究通过共定位分析以及Co-IP 方法,首次发现C 蛋白与NCL 蛋白之间存在相互作用关系。推测NCL 蛋白可能通过与C 蛋白的相互作用,在C蛋白的转运过程中发挥一定的作用。NCL 蛋白被抑制后,CSFV 复制受到影响。NCL 蛋白与C 蛋白的相互作用可能对病毒的复制提供便利。本研究为进一步分析C 蛋白转运机制以及C 蛋白在CSFV 复制过程中的功能提供了实验依据。
[1]Meyers G,Rumenapf T,Thiel H J.Molecular cloning and nucleotide sequence of the genome of hog cholera virus[J].Virology,1989,171(2):555-567.
[2]Thiel H J,Stark R,Weiland E,et al.Hog cholera virus:molecular composition of virions from a pestivirus[J].J Virol,1991,65(9):4705-4712.
[3]Heimann M,Roman-Sosa G,Martoglio B,et al.Core protein of pestiviruses is processed at the C terminus by signal peptide peptidase[J].J Virol,2006,80(4):1915-1921.
[4]刘宁,时洪艳,陈建飞,等.猪瘟病毒衣壳蛋白的细胞核定位研究[J].中国预防兽医学报,2014,36(1):71-72.
[5]Lo S J,Lee C C,Lai H J.The nucleolus:reviewing oldies to have new understandings[J].Cell Res,2006,16(6):530-538.
[6]Gladue D P,Holinka L G,Fernandez-Sainz I J,et al.Effects of the interactions of classical swine fever virus Core protein with proteins of the SUMOylation pathway on virulence in swine[J].Virology,2010,407(1):129-136.
[7]Lohse L,Nielsen J,Uttenthal A.Early pathogenesis of classical swine fever virus(CSFV)strains in Danish pigs[J].Vet Microbiol,2012,159(3-4):327-336.
[8]Tajrishi M M,Tuteja R,Tuteja N.Nucleolin:The most abundant multifunctional phosphoprotein of nucleolus[J].Commun Integr Biol,2011,4(3):267-275.
[9]Tayyari F,Marchant D,Moraes T J,et al.Identification of nucleolin as a cellular receptor for human respiratory syncytial virus[J].Nat Med,2011,17(9):1132-1135.
[10]Thongtan T,Wikan N,Wintachai P,et al.Characterization of putative Japanese encephalitis virus receptor molecules on microglial cells[J].J Med Virol,2012,84(4):615-623.
[11]Greco A,Arata L,Soler E,et al.Nucleolin interacts with US11 protein of herpes simplex virus 1 and is involved in its trafficking[J].J Virol,2012,86(3):1449-1457.
[12]Melen K,Tynell J,Fagerlund R,et al.Influenza A H3N2 subtype virus NS1 protein targets into the nucleus and binds primarily via its C-terminal NLS2/NoLS to nucleolin and fibrillarin[J].Virol J,2012,9:167.
[13]Shimakami T,Honda M,Kusakawa T,et al.Effect of hepatitis C virus(HCV)NS5B-nucleolin interaction on HCV replication with HCV subgenomic replicon[J].J Virol,2006,80(7):3332-3340.
[14]Cancio-Lonches C,Yocupicio-Monroy M,Sandoval-Jaime C,et al.Nucleolin interacts with the feline calicivirus 3' untranslated region and the protease-polymerase NS6 and NS7 proteins,playing a role in virus replication[J].J Virol,2011,85(16):8056-8068.
[15]Waggoner S,Sarnow P.Viral ribonucleoprotein complex formation and nucleolar-cytoplasmic relocalization of nucleolin in poliovirus-infected cells[J].J Virol,1998,72(8):6699-6709.

