一株自然重组的鸡传染性支气管炎病毒的分离鉴定及分析
徐倩倩,王秋玲,张婷婷,韩宗玺,梁殊林,赵 妍,马得莹,刘胜旺*
(1.东北农业大学 动物科技学院,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/禽病研究室,黑龙江 哈尔滨 150001)
鸡传染性支气管炎(Infectious Bronchitis,IB)是由IB 病毒(IBV)引起的一种鸡的急性的、高度接触性传染的呼吸道疾病[1]。IBV 能够感染各种日龄、各个品种的鸡,但雏鸡更加易感,该病呈世界范围内分布。病毒的感染可以导致鸡发病和死亡、引起肉鸡饲料转化率下降或蛋鸡产蛋率的下降以及蛋品质的降低,同时诱发其他病原微生物的继发感染或混合感染,导致较高的死亡率。该病属于养禽业的重要传染病之一。
IBV 是Nido 病毒目、冠状病毒科的γ-冠状病毒,其基因组是不分节段的单股正链RNA,全长约27.6 nt[2-3]。病毒基因组的5' 末端为非编码区,占5'端2/3 基因组的核苷酸片段为病毒复制酶编码区,编码非结构蛋白nsp2~nsp16。3' 端基因组1/3 的核苷酸编码病毒的4 种结构蛋白和4 种附属蛋白。结构蛋白分别为纤突蛋白(S)、膜蛋白、小膜蛋白和核蛋白。病毒的S 蛋白在感染的组织中裂解为5' 端的S1 和3'端的S2 2 个亚单位。由于病毒RNA 依赖的RNA 聚合酶缺乏校正功能,因此病毒在进化过程中极易发生突变。IBV 的S1 蛋白与病毒的免疫原性、血清型、组织嗜性、致病性和遗传变异有关,S1 基因点突变的积累、缺失、插入以及基因重组是造成病毒变异的主要原因,因此病毒流行病学分析、分型、遗传演化研究主要是通过对S1 基因的研究来评估的。
我国广泛使用为“肾型”IB 疫苗,但“肾型”IB 还是频繁发生[4]。本研究从吉林省德惠市某鸡场发病鸡群的濒死鸡的气管中分离到一株IBV,通过系统的基因组分析,表明该病毒为一株自然重组病毒。
1 材料和方法
1.1 主要实验材料 2013 年9 月吉林省德惠市某父母代蛋鸡场鸡群发生疑似IBV 感染,采取濒死病鸡的肾脏,进行病毒分离。SPF 鸡胚由中国农业科学院哈尔滨兽医研究所实验动物中心提供;扩增全序列的引物参照已发表的LX4、4/91 和H120 IBV株相应序列合成[5]。鼠源反转录酶和TRIzol 均购自Invitrogen 公司;DNA 纯化/回收试剂盒购自Omega公司;pMD18-T、Ex Taq DNA 聚合酶、3'/5'-Full RACE Kit 和DNA Marker 购自TaKaRa 公司;大肠杆菌JM109 由本实验室保存。
1.2 病毒分离与鉴定 采取濒死病鸡病变的肾脏组织研磨后通过9 日龄~10 日龄SPF 鸡胚分离病毒,37 ℃培养72 h 后收集尿囊液。以1 % SPF 鸡外周血红细胞对分离病毒株不同代次鸡胚尿囊液做鸡红细胞凝集试验(HA)。
1.3 病毒RNA的提取、基因组扩增及克隆 将无菌收集的尿囊液按TRIzol 试剂盒操作说明书方法提取总RNA。通过特异性引物[N(-)]经反转录制备cDNA。PCR 反应条件按文献[5]进行。基因组5' 末端和3'末端的扩增参照RACE Kit 使用说明书进行。将扩增出的片段分别克隆于pMD18-T 载体中进行序列测定[5]。
1.4 ORF的确定和序列分析 应用Gene Runner 3.0 对测序结果进行序列的拼接,与H120 序列进行比较。应用DNAStar 中的MEGALIGN 程序对病毒株全序列进行拼接和比对,并且进行S1 基因的进化树分析。应用SimPlot 软件检测病毒基因组的重组序列,并且分析其重组位点。本研究选取17 株参考病毒株,包括Massachusetts、4/91 和Ark 型。
2 结果
2.1 病毒的分离与鉴定 接种病料组织上清液的SPF 鸡胚,在第一代鸡胚出现轻微病变,第二代病变典型,表现为胚体卷曲,弥漫性出血,羊膜增厚。各代次鸡胚尿囊液均不能够使鸡外周血红细胞发生凝集,表明鸡胚尿囊液中不含有正粘病毒、副粘病毒和腺病毒等。
2.2 分离病毒株全基因组特征 提取含有分离病毒株的鸡胚尿囊液的总RNA,采用IBV 特异性引物,经RT-PCR 分别扩增出12 条与预计大小相符的片段。同时,通过5'-和3'-RACE 得到的基因组5'和3'末端扩增产物。将这些扩增的基因片段进行拼接,结合参考病毒株H120 的对应位置进行比较,表明分离病毒株基因组的组成特征为5'-1a-1b-S-3a-3b-E-M-5a-5b-N-3',符合IBV 基因组组成特征(表1)。将分离株命名为ck/CH/LJL/130908。测定ck/CH/LJL/130908 基因组全长序列为27 747 nt,其中不包括3' 末端的Poly A 序列。该分离株基因组GenBank 注册号为KP868573。
2.3 ck/CH/LJL/130908基因型和基因组进化特征通过对分离株ck/CH/LJL/130908 的S1 进化分析表明,该分离株为Massachusetts 型(图1),与Massachusetts 型的代表株H120 疫苗株和Mass41 强毒株的S1 基因同源性分别为96.4 %和94.4 %。通过对病毒基因组进化分析显示,分离株ck/CH/LJL/130908与Ark 型在同一分支,表明具有较近的亲缘关系(图2)。全基因组序列同源性分析还显示,ck/CH/LJL/130908 的Ark、ArkDPI11 和ArkDPI101 之间的同源性分别为96.4 %、97 %和97 %,而与H120 和M41之间同源性分别为94.8 %和90.8 %。这一结果提示该分离株的基因组可能存在重组现象。
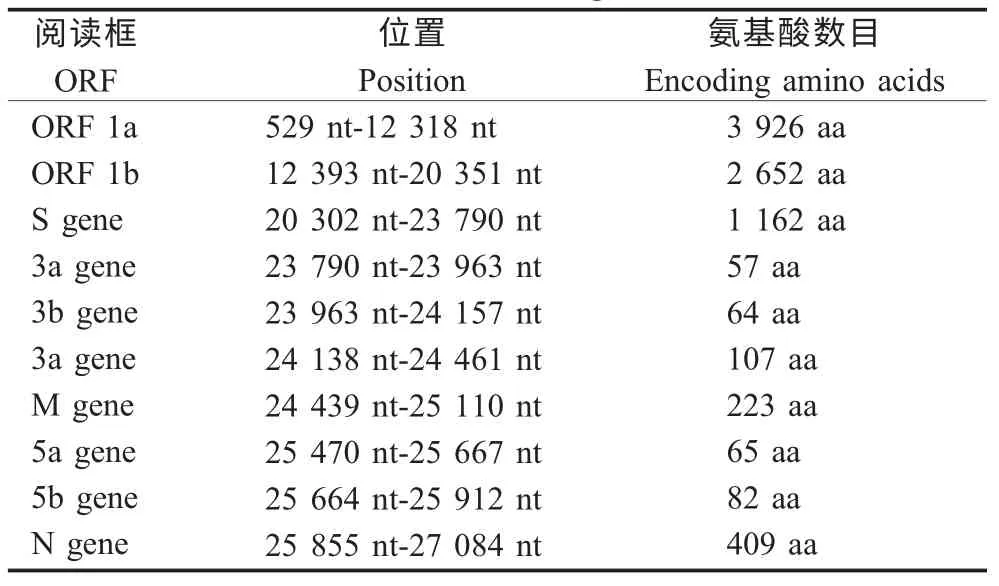
表1 ck/CH/LJL/130908 的开放阅读框Table 1 Open reading frames in the ck/CH/LJL/130908 genome
2.4 ck/CH/LJL/130908重组分析 以ck/CH/LNM/091017 为查询病毒株,以ArkDPI11、H120 和4/91为参考病毒株,进行SimPlot 分析,结果证明ck/CH/LNM/091017 为重组病毒株,其5'末端非编码区到ORF1ab 的Nsp2 区为4/91 样序列,ORF1ab 的Nsp2 末端到Nsp15 为Ark 样序列,S 大部分为Massachusetts 样序列,S 基因的3' 端到基因组3' 末端为Ark 序列(图3)。这一结果表明ck/CH/LNM/091017是由ArkDPI11、H120 和4/91 3 种病毒株发生多重重组而来。
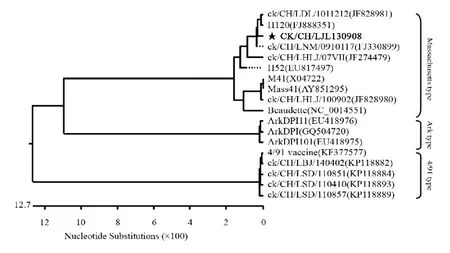
图1 病毒ck/CH/LJL/130908 与17 株参考病毒株的S1 基因分析Fig.1 Phylogenetic analysis of isolate ck/CH/LJL/130908 based on S1 gene with 17 IBV reference strains

图2 病毒ck/CH/LJL/130908 基因组进化分析Fig.2 Phylogenetic analysis of isolate ck/CH/LJL/130908 based on the complete genomic sequenes with IBV reference strains
3 讨论
本实验从吉林省德惠市某父母代蛋种场疑似IBV 感染的发病鸡气管中分离到一株病毒,通过病毒致SPF 鸡胚病变特征、病毒对鸡外周血红细胞凝集特性及病毒基因组分析,表明该病毒为IBV。
通过对IBV ck/CH/LJL/130908 进行基因分型表明,该分离株为Massachusetts 型病毒,S1 基因的同源性与疫苗病毒株H120 比强病毒株M41 高,表明与H120 疫苗株遗传关系近。但对其基因组进行进化分析表明,ck/CH/LJL/130908 与Ark 株具有较近的亲缘关系。这一结果提示该病毒株的基因组可能存在重组现象。
SimPlot 分析在研究核苷酸之间关系上准确性高于同源性分析,该方法所得结果更能够准确解析代表病毒株之间的关系,并能准确预测序列重组是重组位点的位置[6],是研究病毒重组最常用、也是最有效的方法。本研究根据病毒基因组进化分析的结果,选取4/91、Ark 和H120 病毒株作为推测的亲本病毒株,采用SimPlot 分析发现ck/CH/LJL/130908 分离株是由以上3 株病毒发生自然重组而产生的,重组的位点分别位于ORF1ab 的Nsp2、Nsp3、Nsp16和S2 区。
值得注意的是分离株ck/CH/LJL/130908 的来源问题。H120 疫苗在国内鸡群中广泛使用,4/91 疫苗在国内部分地区使用,分离株ck/CH/LJL/130908 来源的鸡群曾经在2 日龄时使用H120 疫苗进行首次免疫,在17 日龄左右时使用4/91 疫苗进行加强免疫。因此,病毒ck/CH/LJL/130908 的基因组中存在H120 和4/91 样的序列是可能的。Ark 病毒株是由美国分离到的病毒[7],就目前所知,该型病毒仅流行于美洲地区,中国未见该型病毒的分离和流行病学研究的报道。因此,病毒ck/CH/LJL/130908 的基因组中Ark 样序列的来源不明。可能在中国,该型的病毒型已经存在,只是还尚未分离到。
由于ck/CH/LJL/130908 病毒分离于2013 年,该型病毒是否已在中国普遍存在有待流行病学监控,对其造成的经济损失有待进一步评估。此外,由于该型病毒是来源于4/91、Ark 和H120 病毒株的重组,重组后病毒的血清型是否发生了改变以及现有疫苗对其保护效果等的评价有待进一步证实。
[1]Cavanagh D.Coronaviruses in poultry and other birds[J].Avian Pathol,2005,34(6):439-448.
[2]Carstens E.Report from the 40th meeting of the executive committee of the international committee of taxonomy of Viruses[J].Arch Virol,2009,154(9):1571-1574.
[3]Kinde H,Daft B M,Castro A E,et al.Viral pathogenesis of a nephrotropic infectious bronchitis virus isolated from commercial pullets[J].Avian Dis,1991,35(2):415-421.
[4]Han Zong-xi,Sun Chun-yang,Yan Bao-long,et al.A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J].Infect Genet Evol,2011,11(1):190-200.
[5]Liu Xiao-li,Shao Yu-hao,Ma Hui-jie,et al.Comparative analysis of four Massachusetts type infectious bronchitis coronavirus genomes reveals a novel Massachusetts type strain and evidence of natural recombination in the genome[J].Infect Genet Evol,2013,14:29-38.
[6]Lole K S,Bollinger R C,Paranjape R S,et al.Full-length human immunodeficiency virus type 1 genomes from subtype C-infected seroconverters in India,with evidence of intersubtype recombination[J].J Virol,1999,73(1):152-160.
[7]Gelb J,Cloud S S.Effect of serial embryo passage of an Arkansas-type avian infectious bronchitis virus isolate on clinical response,virus recovery,and immunity[J].Avian Dis,1983,27(3):679-687.

