北里乳杆菌97-1产细菌素97-1的抑菌活性及生物特性的研究
张 旺,刘琳琳,王云峰,王宏磊,祁小乐,高玉龙,王永强,高宏雷,李 凯,刘长军,张艳萍,卢彤岩,何高明,王笑梅*,崔红玉*
(1.石河子大学动物科技学院,新疆石河子 832002;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽免疫抑制病创新团队,黑龙江哈尔滨 150001;3.哈尔滨动物生物制品国家工程研究中心有限公司,黑龙江哈尔滨 150028;4.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨 150070)
细菌素(Bacteriocin)是由某些类细菌在代谢过程中产生的具有抑制其它细菌生长活性的蛋白质或多肽[1-2]。其中以乳酸乳杆菌(L.lacticacid)和乳酸短杆菌(L.breris)研究最为广泛。1984 年,Anand 等首次在双歧乳杆菌NCDC 1452 中发现Bifidocin B 能够抑制革兰氏阳性菌[3]。此后,Yildirim 等发现能够产细菌素Cremoris R 的乳酸短杆菌[3-4];Ghanbari 等在鲟鱼体内分离得到产细菌素的乳酸乳杆菌[5-7];Todorov等在发酵乳中分离得到产细菌素Bacteriocin AMA-K的植物乳酸乳杆菌AMA-K[8]。乳酸乳杆菌因来源不同,种属不同,其所产的细菌素抗菌效果也有很大差异[9],乳酸菌的抗菌活性主要包括其代谢过程中所产的细菌素,有机酸和过氧化氢[10]。乳酸菌所分泌的抗菌物质,能够作为天然食品防腐剂来抑制病原菌及腐败菌,或者作为“替代抗生素”应用于饲料添加剂等领域。
本实验对北里乳杆菌97-1(Lactobacillus kitasatonis 97-1)分泌的细菌素97-1(Bacteriocin 97-1)的抑菌特性及理化特性进行初步研究,为进一步研制和开发微生态制剂提供实验依据。
1 材料和方法
1.1 实验菌株 北里乳杆菌97-1(简称:乳杆菌97-1)由中国农业科学院哈尔滨兽医研究所国家重点实验室从黑龙江省健康鸡群肠道内容物中分离鉴定,保藏于中国微生物菌种保藏管理委员会普通微生物中心(微生物保藏号为CGMCC No.9440)和中国农业科学院哈尔滨兽医研究所菌种保藏中心;指示菌种单核细胞增生李斯特菌购自中国药品生物制品检定所;沙门氏菌CVCC578 及金黄色葡萄球菌CVCC0804 购自中国兽医微生物菌种保藏中心;大肠杆菌ATCC25922 和链球菌ATCC69615 由河北北方学院动物科技学院惠赠,其他菌种详见表3。
1.2 主要试剂 MRS 培养基购自青岛海博公司,过氧化氢酶、胰蛋白酶、胃蛋白酶、中性蛋白酶均购自Sigma 公司,蛋白透析袋购自Millpore 公司。
1.3 细菌素的制备及鉴定 将乳杆菌97-1 在MRS培养液37 ℃静置培养48 h 后离心分离保留上清液,以单核细胞增生李斯特菌为指示菌株,采用牛津杯法[7-9]进行抑菌实验,通过平板菌落计数法进行指示菌的菌落计数,调整指示菌浓度为1×106cfu/mL。参照参考文献[8-9]方法,将周围6 个孔加入200 μL上清液,中间孔加入200 μL 的MRS 液体培养基(pH4.5)作为空白对照,37℃静置培养24 h~72 h 测量抑菌圈直径。同时,分别用过氧化氢酶、胰蛋白酶、胃蛋白酶和中性蛋白酶在各自作用的最适pH值下处理上清液,使各酶的终浓度为5 mg/mL,37 ℃处理2 h 后,再将pH 值调回6.5,用PBS 缓冲液将体积补至同一体积,以不加酶处理的上清液作为对照,以指示菌的抑菌活性作为鉴定细菌素的存在。
1.4 细菌素97-1的纯化及物理、化学特性试验
1.4.1 细菌素97-1 的纯化 将乳杆菌97-1 在MRS培养液中37 ℃静置培养48 h 后,置于80 ℃水浴30 min,灭活蛋白水解酶。分别用5 M 磷酸和5 M氢氧化钠调节pH 值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0 及11.0;4 ℃搅拌过夜。14 000 g/min,4 ℃,离心20 min,弃上清。用0.05 M的磷酸钠(pH6.5)洗涤菌体,14 000 g/min,4 ℃,离心20 min,重复两次,弃上清。用0.1 M 氯化钠(pH1.5~2.0)重悬菌体,4 ℃搅拌过夜,使吸附在菌体表面的细菌素脱落,14 000 g/min,4 ℃,离心20 min,收集上清,透析除水,得到初步纯化的细菌素,命名为细菌素97-1(Bacteriocin97-1)。
1.4.2 细菌素97-1 的高温耐受试验 取初步纯化的细菌素97-1 分别置于30 ℃、37 ℃、42 ℃、60 ℃、80 ℃、100 ℃水浴中处理2 h 和121 ℃高压15 min,以单增李斯特氏菌为指示菌进行抑菌活性检测。
1.4.3 细菌素97-1 的酸碱耐受试验 将初步纯化的细菌素97-1 用5 M 磷酸和5 M 氢氧化钠调节pH 值为2.0、4.0、6.0、8.0、10.0、12.0,处理2 h 后调回pH6.0,以MRS 培养基(pH6.0)为空白对照检测酸碱对细菌素97-1 的影响。
1.5 乳杆菌97-1的生长与产细菌素变化曲线的测定 将乳杆菌97-1 划线,挑取单菌落进行复苏,按1∶50 转接到MRS 培养基中,37 ℃静置培养,每2 h取样一次,直至24 h,分别检测菌液的OD600nm值及pH 值,绘制菌株生长曲线和pH 值变化曲线,同时以指示菌检测上清液中细菌素的抗菌活性,以获取细菌素产量随菌株生长的变化关系。
1.6 细菌素97-1的抗菌谱范围测定 以20 种常见革兰氏阳性细菌和8 种革兰氏阴性细菌(表3)作为测试菌进行抑菌活性测定。
2 结果
2.1 北里乳杆菌97-1产生细菌素的鉴定 采用牛津杯法进行乳杆菌97-1 的抑菌试验,结果显示菌株发酵上清液在6 个周围实验孔均产生了大约15 mm的抑菌圈(6 个重复),而中央对照孔无抑菌圈产生,表明乳杆菌97-1 可以产生抗菌活性物质(图1)。而乳杆菌97-1 的上清液经胰蛋白酶、胃蛋白酶和中性蛋白酶处理后抑菌活力完全消失,表明发酵上清液的抗菌物质可以被蛋白酶分解,抗菌活性物质为蛋白类抗菌肽;但经过氧化氢酶处理的样品仍具有抑菌活力,与未作任何处理的样品抑菌活力一致,进一步表明发酵上清液中发挥抑菌作用的物质为蛋白类的细菌素而非过氧化氢(表1)。以上结果表明,乳杆菌97-1 所分泌的细菌素97-1 为蛋白类抗菌肽。
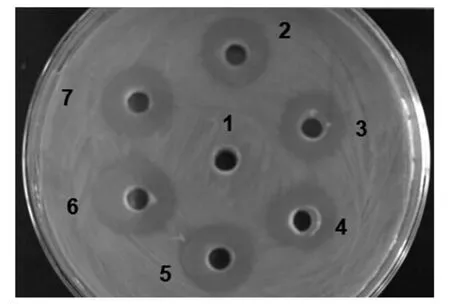
图1 北里乳杆菌97-1 对单增李斯特氏菌的抑菌活性Fig.1 The antimicrobial activity of the bacteriocin against L.monocytogenes produced by L.kitasatonis 97-1
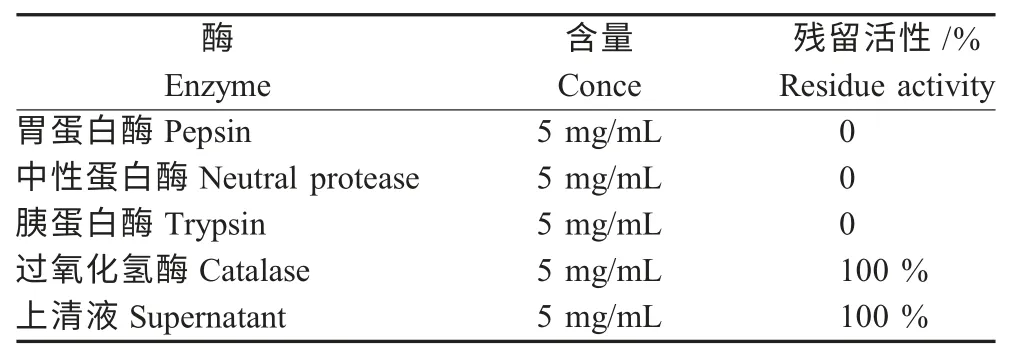
表1 乳杆菌97-1 上清中抑菌物质对各种酶的耐受性Table 1 The sensitive of bacteriocin produced by L.kitasatonis 97-1 to enzymes
2.2 细菌素97-1对高温和强酸强碱的耐受性 将乳杆菌97-1 MRS 培养上清液进行高温和强酸强碱处理,结果显示该菌所产细菌素在121 ℃高压处理15 min 后仍有90 %的抑菌活性(表2),表明该细菌素具有高度的热稳定性;而过酸处理(pH<2)和过碱(pH>10)处理后抗菌活性只有原来的30 %(过酸)和20 %(过碱),其在pH4.0~8.0 范围内具有稳定活性,抗菌活性维持在70 %~100 %。
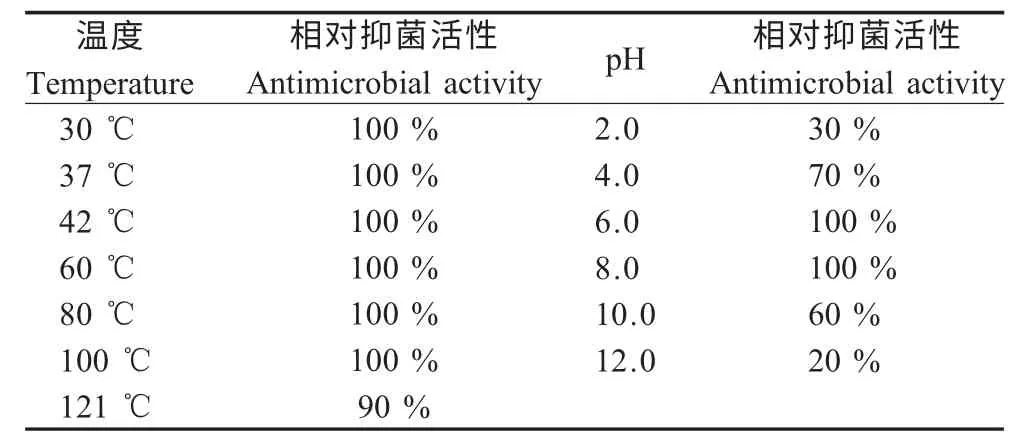
表2 热处理和酸碱处理对抗菌活性的影响Table 2 Effect of heat and pH on the antimicrobial activity
2.3 乳杆菌97-1的生长曲线与产细菌素变化曲线随着乳杆菌97-1 在MRS 培养基生长,培养液pH 值从6.5 逐步下降至4.0。细菌素97-1 的产量随着乳杆菌97-1 的生长而增加,在发酵14 h 后达到最大抑菌活性6 400(AU/mL),并且抑菌活性在稳定期(6 h左右)内保持稳定(图2)。
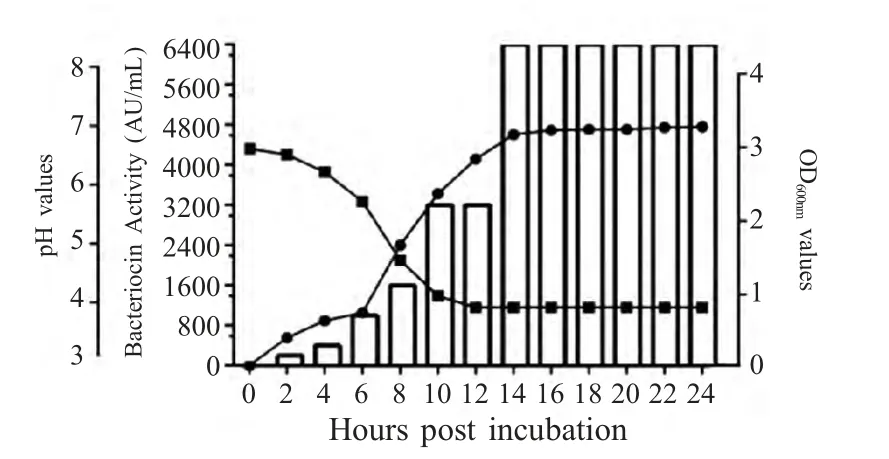
图2 乳酸菌97-1 生长曲线及生长过程中抑菌活性和pH 值变化的相关性Fig.2 The growth curve of 97-1 and antimicrobial activity in the process of growth and the correlation of pH values
2.4 细菌素97-1的广谱抗菌活性 以20 种常见革兰氏阳性细菌和8 种革兰氏阴性细菌作为测试菌进行抑菌活性测定,结果表明细菌素97-1 具有较广的抑菌图谱(表3)。
3 讨论
本研究结果显示北里乳杆菌所产生的细菌素97-1 具有广谱抗菌活性,该结果与Yildirim 等在1998 年发现的细菌素Bifidocin 有所不同,细菌素Bifidocin 不能抑制金黄色葡萄球菌,产气荚膜梭菌,链球菌等革兰氏阳性菌和所有革兰氏阴性菌[3],只能抑制部分特定病原细菌。北里乳杆菌所产生的细菌素97-1 和Anand 等在1984 年发现的双歧乳杆菌NCDC 1 所产生的Bifidocin B 抑菌范围比较相近,具有同时抑制革兰氏阴性菌和革兰氏阳性菌的特性[4],均具有广谱抗菌活性。之前国内外发现的由革兰氏阳性菌所产生的细菌素绝大部分是不能抑制革兰氏阴性菌的生长,这种具有同时抑制革兰氏阳性和阴性菌的细菌素只在双歧杆菌属的一些菌株中被发现,如乳杆菌NK24 所产的细菌素NK24。双歧杆菌所产的细菌素目前已经在食品领域作为天然食品防腐剂得到应用,并具有很好的安全性。本研究发现的北里乳杆菌所产生的细菌素97-1 具有光谱抗菌特性,在生物技术领域具有广泛应用前景和潜力。
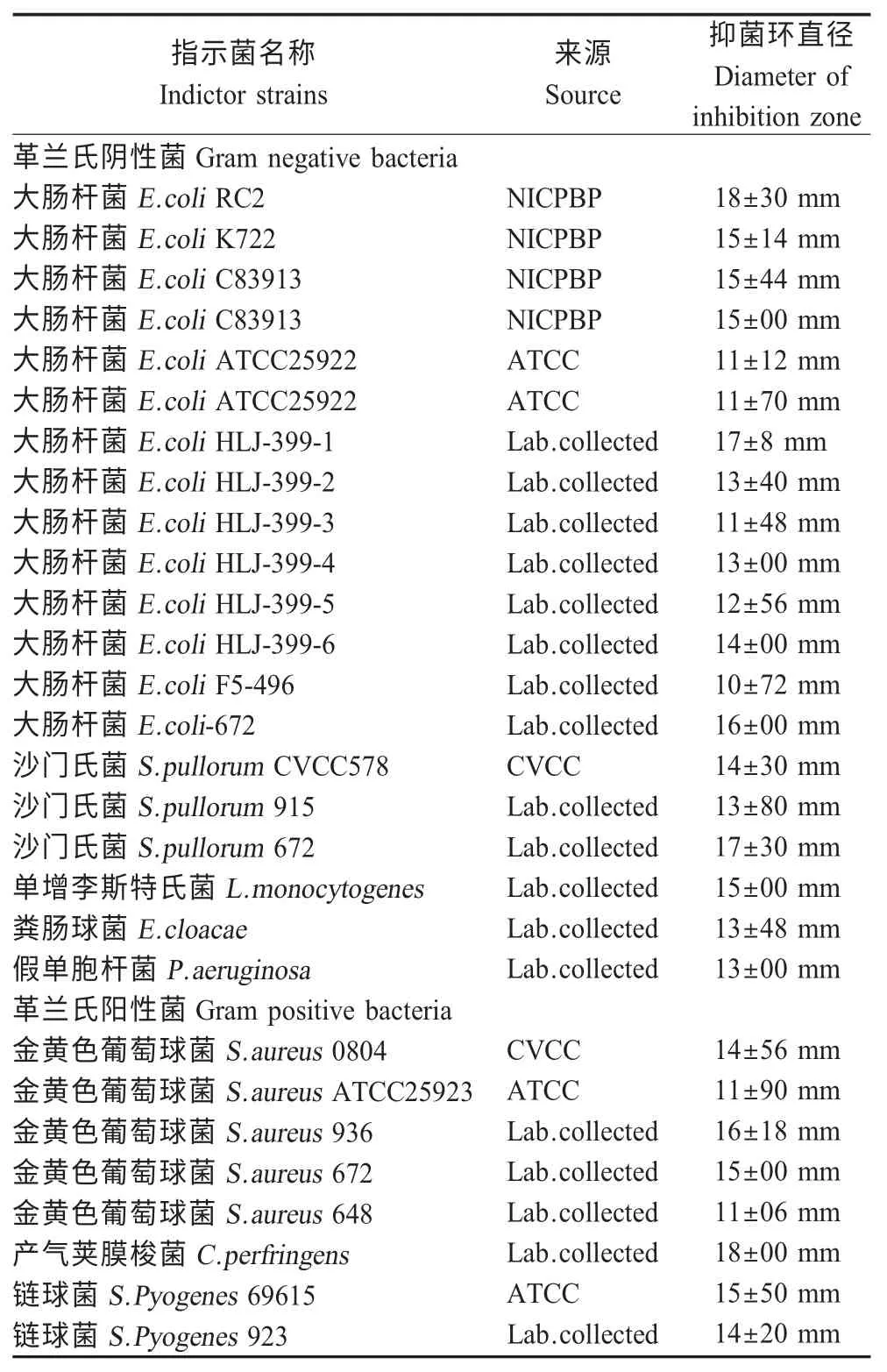
表3 细菌素97-1 的抑菌图谱Table 3 Bacteriostatic spectrum of bacteriocin 97-1
此外,细菌素97-1 具有良好的稳定性,一是具有高耐热稳定性,能够在121 ℃高压下保持抑菌活性,这将为批量化生产和操作应用提供了条件;二是具有耐酸碱特性,在pH4.0~8.0 范围内保持良好的抑菌活性,虽然部分限制其使用条件,但也为使用pH 来调控细菌素浓度成为可能。
[1]杨红亚,崔红玉,闫帅,等.黑龙江散养鸡中一株乳酸菌的分离鉴定及益生特性和抗病毒特性研究[J].中国预防兽医学报,2013,35(06):444-448.
[2]高明,崔红玉,王笑梅,等.嗜酸乳杆菌表面锚定展示H5N1 亚型禽流感病毒血凝素HA1 蛋白的研究[J].中国预防兽医学报,2014,36(08):593-596.
[3]Ahmadova A,Todorov S D,Hadji-Sfaxi I,et al.Antimicrobial and antifungal activities of Lactobacillus curvatus strain isolated from homemade Azerbaijani cheese[J].Anaerobe,2013,20:42-49.
[4]Martinez F A,Balciunas E M,Converti A,et al.Bacteriocin production by Bifidobacterium spp.A review[J].Biotechnol Adv,2013,31(4):482-488.
[5]Garvie E I.Detection and characterization of a bacteriocin produced by Lactococcuslactis subsp.cremoris R isolated from radish[J].Lett Appl Microbiol,1999,28(2):157.
[6]Arthur T D,Cavera V L,Chikindas M L.On bacteriocin delivery systems and potential applications[J].Future Microbiol,2014,9(2):235-248.
[7]Todorov S D.Bacteriocin production by Lactobacillus plantarum AMA-K isolated from Amasi,a Zimbabwean fermented milk product and study of the adsorption of bacteriocin AMA-K TO Listeria sp[J].Braz J Microbiol,2008,39(1):178-187.
[8]Martinez R C,Wachsman M,Torres N I,et al.Biochemical,antimicrobial and molecular characterization of a noncytotoxicbacteriocin produced by Lactobacillus plantarum ST71KS[J].Food Microbiol,2013,34(2):376-381
[9]Klaenhammer T R.Genetics of bacteriocins produced by lactic acid bacteria[J].FEMS Microbiol Rev,1993,12(1-3):39-85.
[10]Yamamoto Y,Togawa Y,Shimosaka M,et al.Purification and characterization of a novel bacteriocin produced by Enterococcus faecalis strain RJ-11[J].Appl Environ Microbiol,2003,69(10):5746-5753.

