19 ku脂蛋白信号肽优化表达的牛病毒性腹泻病毒E2基因重组卡介苗初步免疫研究
时 坤,孙凡婷,张 妍,李 晶,刘 菲,刘 杨,杜 锐*
(1.吉林农业大学中药材学院/教育部动物生产及产品质量安全重点实验室/吉林省药用动物二级实验室,吉林长春 130118;2.吉林农业大学动物科学技术学院,吉林长春 130118)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)为黄病毒科(Flaviviridae),瘟病毒属(Pestivirus)成员,为牛病毒性腹泻-黏膜病的病原,该病的临床表现为病畜发热、腹泻、怀孕母畜流产或产畸形胎、持续感染等[1-2]。E2蛋白为BVDV 主要的保护性抗原,其N 端区域是引起体液免疫应答的主要区域。张梦等将BVDV E2基因在卡介苗(Bacillus Calmette-Guerin,BCG)中进行表达,免疫小鼠后刺激机体产生了抗BVDV 和结核分枝杆菌的中和抗体,E2基因重组卡介苗(rBCG)的构建为防制BVD提供了新途径[3-6]。
研究表明,结核杆菌19 ku 脂蛋白信号肽通过融合表达的形式可以介导外源蛋白锚定于BCG 菌体表面。19 ku 脂蛋白自身具有较高的免疫原性,可以引发一系列的免疫应答。在抗原递呈过程中,19 ku脂蛋白信号肽为外源蛋白激活机体更完善的免疫应答提供了保证[7]。本研究将已构建的融合表达编码19 ku 脂蛋白信号肽的E2基因的rBCG(rBCG/19ku-E2)免疫小鼠,通过对小鼠体液免疫和细胞免疫水平的检测,初步评价rBCG/19ku-E2的免疫原性,为研制高效防制BVD 的亚单位疫苗奠定了基础。
1 材料和方法
1.1 病毒株、重组卡介苗、血清及实验动物BVDV Changchun184 株、rBCG/19ku-E2、rBCG/E2、rBCG/pMV261(pMV261 空载体构建的rBCG 作为实验对照组)、BCG 及小鼠血清均由吉林农业大学经济动物疾病实验室保存。6 周龄~8 周龄雄性昆明鼠共72 只购自长春实验动物繁育场。
1.2 主要试剂 FITC 标记的兔CD4+单克隆抗体(MAb)、APC 标记的兔CD8+MAb、红细胞裂解液购自美国BD 公司;刀豆蛋白(Con A)购自Sigma 公司;HRP 标记的羊抗鼠IgG(IgG-HRP)购自武汉博士德生物工程有限公司;小鼠干扰素γ(IFN-γ)、白细胞介素-4(IL-4)、IL-10、IL-12 ELISA 检测试剂盒购自美国RD 公司。
1.3 实验设计 将昆明鼠随机分成6 组,每组12只。分别腹腔注射rBCG/19ku-E2、rBCG/E2、rBCG/pMV261、BCG、BVDV 灭活苗、对照组等体积注射生理盐水(200 μL/只),每隔14 d 加强免疫一次,共免疫3 次。免疫前尾静脉采血,第二免、三免前(14 d、28 d)及三次免疫后14 d 眼球采血。采集血液于37 ℃放置2 h,4 ℃过夜,2 000 r/min 离心10 min,分离血清。
1.4 小鼠血清抗体效价测定 采用包被缓冲液将纯化后的BVDV Changchun184 病毒液做1∶400 稀释,加入96 孔酶标板,100 μL/孔。以1 % BSA 为封闭液,以小鼠血清为一抗(1∶1 600),100 μL/孔,同时设阴阳性对照复孔,37℃孵育2 h。以羊抗小鼠IgG-HRP(1∶4 000)为二抗,OPD-H2O2避光显色测定OD490nm值对血清中抗体水平进行检测。
1.5 流式细胞术检测 无菌条件下收集小鼠脾细胞,各组均取1×106个细胞,每组中分别加入FITC标记的兔抗鼠CD4+MAb、APC 标记的兔抗鼠CD8+MAb,以FACS 缓冲液重悬沉淀进行流式细胞仪检测。
1.6 细胞因子检测试验 根据小鼠IL-4、IL-10、IFN-γ 和IL-12 ELISA 检测试剂盒说明,采用生物素双抗体夹心ELISA 法测定小鼠血清样品中4 种IL水平。
1.7 数据统计与分析 利用SPSS17.0 软件对实验数据进行方差分析。对于柱状图用GraphPad Prism5软件进行分析。
2 结果
2.1 小鼠血清抗体效价的测定结果 按照间接ELISA 的方法测定小鼠血清抗体的效价,各组小鼠血清OD490nm值的抗体效价变化情况结果显示,在免疫14 d 时,各组间抗体差异不显著(p>0.05),从免疫的28 d 开始,BCG 免疫组抗体水平持续上升,至第42 d 达到峰值,在56 d 时抗体水平已呈现下降趋势。rBCG/19ku-E2组在免疫第42 d 达到峰值,14 d~42 d,其抗体效价一直呈上升趋势,并且高于其他对照组(图1)。
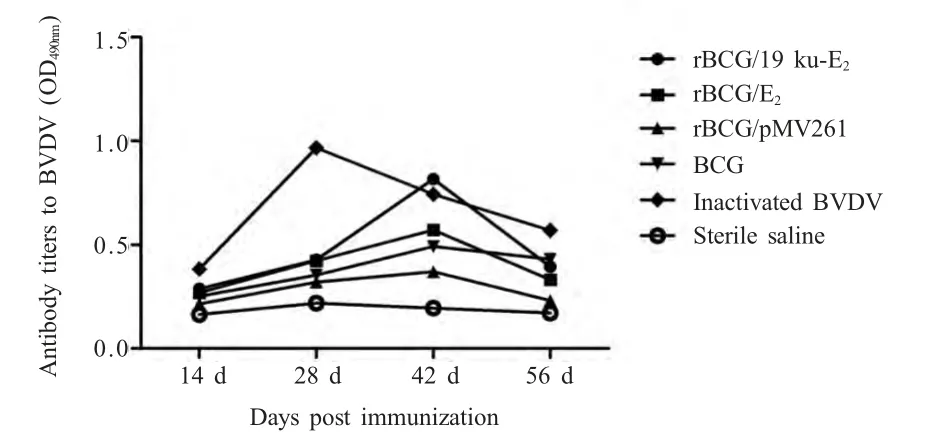
图1 小鼠血清样品中抗体效价变化情况Fig.1 Dynamics of antibody titers to BVDV in immunazed mice
BVDV 灭活苗免疫的小鼠出现高水平抗体的时间最早,但持续时间较短。在28 d 时血清抗体已达到峰值,之后一直呈现下降的趋势。
2.2 T淋巴细胞亚群含量的检测结果 采用FCM分别检测三免后各组及对照组小鼠脾脏CD4+和CD8+T 淋巴细胞亚群含量。检测结果表明,免疫组组间及对照组中CD4+和CD8+T 淋巴细胞亚群的含量差异不显著,rBCG 对淋巴细胞亚群含量影响微弱。
2.3 细胞因子检测结果 根据小鼠IL-4、IL-10、IL-12 和IFN-γ ELISA 检测试剂盒说明,采用生物素双抗体夹心ELISA 法测定小鼠血清样品中IL-4、IL-10、IL-12 和IFN-γ 4 种细胞因子的水平。结果显示,BCG 组4 项细胞因子水平均高于其他免疫组(图2)。
小鼠血清样品中IL-4 细胞因子水平检测结果显示,免疫组均在42 d 时达到峰值,与生理盐水对照组均差异极显著(p<0.01)。之后各组均出现下降的趋势。在免疫期间,BCG 免疫组高于其他组IL-4 细胞因子水平。
小鼠血清样品中IL-10 细胞因子水平检测结果显示,在免疫期间,各免疫组IL-10 细胞因子水平均呈现上升趋势。rBCG/19ku-E2组变化差异较大,在免疫后第56 d,其IL-10 细胞因子水平高于BCG其它组。
小鼠血清样品中IL-12 细胞因子水平检测结果显示,rBCG/E2 组、BVDV 灭活苗组、rBCG/19ku-E2组在第42 d、56 d 上升趋势基本一致,IL-12 细胞因子水平明显高于生理盐水对照组,数据分析结果表明该阶段的IL-12 细胞因子水平与生理盐水差异极显著(p<0.01)。
小鼠血清样品中IFN-γ 细胞因子水平检测结果显示,各组在检测的4 种细胞因子中IFN-γ 含量水平最高。免疫组IFN-γ 细胞因子水平在免疫期间均呈上升趋势。其中rBCG/19ku-E2组上升幅度较小,而BCG 组、rBCG/E2组上升幅度最明显。
3 讨论
rBCG 疫苗已广泛应用于很多疾病疫苗的研究,并且有一部分疫苗已在动物模型中完成初步免疫实验。rBCG 作为外源基因的活载体虽然具有免疫持久、免疫佐剂效果、诱导黏膜免疫等优点,但外源基因在BCG 中的表达效率低,并且抗原不能有效递呈,影响了免疫应答的效率,为解决rBCG 表达效率较低的问题,近年国内外学者对BCG 的表达载体、启动子以及信号肽等影响因素做了很多的研究。脂蛋白在结核杆菌所表达的蛋白中具有良好的免疫原性。目前对于19 ku 脂蛋白的研究并不是很多,其生物功能也没有明确。有研究表明,19 ku脂蛋白可以增强B 细胞、CD4+T 和CD8+T 细胞的应答,有效释放IL-2、IFN-γ 和IL-12。Stover 等通过western blot 检测表明,19ku-OspA 融合蛋白表达大部分均参与到细胞膜的结构中[8]。Langermann 等研究19 ku 信号肽与多种分泌蛋白信号肽对外源基因表达途径影响时发现,19 ku 信号肽融合蛋白可以定位于膜表面[9]。Bastos 等应用抗体染色技术在rBCG 表面发现与19 ku 融合的PRRSV G5 和M 蛋白[10]。Joan 等融合19ku-HIV-1gp120 基因发现,融合基因可以增加外源基因的稳定性,对基因的表达具有重要影响[11]。
本研究中,对已构建的rBCG 进行体液免疫和细胞免疫的检测。Mamoru 等通过长期监测rBCGSIVGag 免疫的猪血清抗体水平,发现与对照组相比rBCG 免疫后可持续产生抗猿猴免疫缺陷病毒的血清抗体长达50 周[12]。本研究中,对免疫期间小鼠血清抗体水平的持续监测表明,14 d 时,免疫组与生理盐水对照组的抗体水平均维持在较低水平。28 d时,BVDV 免疫组抗体水平迅速升高,高于其他rBCG 免疫组,但BVDV 免疫组的抗体水平持续时间较短。与BVDV 免疫组抗体相比,rBCG 免疫组小鼠抗体血清从28 d 后持续升高,42 d 时达到峰值,这表明rBCG 免疫的小鼠,血清抗体水平可维持的时间较长。在rBCG 免疫组中,rBCG/19ku-E2的抗体水平要高于其他rBCG 免疫组,这可能是由于19 ku 脂蛋白信号肽的介导作用。
细胞免疫应答在BCG 发挥免疫效力过程中具有重要意义,其中CD4+T 淋巴细胞亚群在细胞免疫过程中发挥着主导作用,即rBCG 在介导细胞免疫时主要通过MHCⅡ途径呈递抗原[13-15]。rBCG 由于可诱导细胞因子的释放,因此更多的研究者将其投入到艾滋病的预防领域。在本实验中,IFN-γ 细胞因子含量要远高于其他3 种已检测的细胞因子,因此在rBCG 中主要诱导Th1 型免疫应答,BCG 较其他rBCG 的细胞因子释放水平高,这可能是因为构建rBCG 的过程可能影响BCG 细胞因子的释放机制。但rBCG 对细胞因子释放的作用仍然非常可观。以上结果为研制高效防治BVD 的亚单位疫苗奠定了坚实的基础。
[1]张芳芳,王光华,郑福英,等.青海牦牛病毒性腹泻病毒的分离与鉴定[J].中国兽医科学,2001,41(11):1101-1105.
[2]Collett M,Larson R,Belzer S K,et al.Proteins encoded by bovine viral diarrhea virus:the genomic organization of a pestivirus[J].Virology,1988,165(1):200-208.
[3]张梦.BVDV E2 基因在BCG 中的优化表达及其表达产物免疫效果的研究[D].长春:吉林农业大学,2012.
[4]姜宇,刘亚刚.牛病毒性腹-黏膜病病毒的分子生物学研究进展[J].西南民族大学学报,2006,32(3):559-563.
[5]Baxi M K,Deregt D,Robertson J,et al.Recombinant bovine adenovirus type 3 expressing bovine viral diarrhea virus glycoprotein E2 induces an immune response in cotton rats[J].Virology,2000,78(1):234-243.
[6]杜锐,刘苓钰,时坤,等.鹿源牛病毒性腹泻-黏膜病病毒E2基因的克隆与序列分析[J].吉林农业大学学报,2009,31(4):443-446.
[7]Neyrolles O,Gould K,Gares M P,et al.Lipoprotein access to MHC class I presentation during infection of murine macrophages with live mycobacteria[J].Immunol,2001,166(1):447-457.
[8]Stover C K,Bansal G P,Hanson M S,et al.Protective immunity elicited by recombinant bacille Calmette-Guerin(BCG)expressing outer surface protein A(OspA)lipoprotein:a candidate Lyme disease vaccine[J].Exp Med,1993,178(1):197-209.
[9]Langermann S,Palaszynski S R,Burlein J E,et al.Protective humoral response against pneumococcal infection in mice elicited by recombinant bacille Calmette-Guerin vaccines expressing pneumococcal surface protein A[J].Exp Med,1994,180(6):2277-2286.
[10]Bastos R G,Dellagostin O A,Barletta R G,et al.Construction and immunogenicity of recombinant Mycobacterium bovis BCG expressing GP5 and M protein of porcine reproductive respiratory syndrome virus[J].Vaccine,2002,21(1/2):21-29.
[11]Joseph J,Fernández-Lloris R,Pezzat E,et al.Molecular characterization of heterologous HIV-1gp120 gene expression disruption in mycobacterium bovis BCG host strain:a critical issue for engineering mycobacterial based-vaccine vectors[J].J Biomed Biotechnol,2010,10(1155):1-10.
[12]Mamoru K,Kazuhiro M,Mitsuo H,et al.Intradermal and oral immunization with recombinant Mycobacterium bovis BCG expressing the simian immunodeficiency virus Gag protein induces long-lasting,antigen-specific immune responses in guinea pigs[J].Clinical Immunology,2006,119(1):67-78.
[13]Derrick S C,Repique C,Snoy P,et al.Immunization with a DNA vaccine cocktail protects mice lacking CD4 cells against an aerogenic infection with Mycobacterium tuberculosis[J].Infect Immune,2004,72(3):1685-1692.
[14]Flynn J L,Goldstein M M,Triebold K J,et al.Major histocompatibility complex class I-restricted T cells are required for resistance to Mycobacterium tuberculosis infection[J].Proc Natl Acad Sci,1992,89(24):12013-12017.
[15]van Pinxteren L A,Cassidy J P,Smedegaard B H,et al.Control of latent Mycobacterium tuberculosis infection is dependent on CD8 T cells[J].Immunol,2000,30(12):3689-3698.

