超级细菌blaNDM-1基因Taq Man-MGB荧光定量PCR检测方法的建立
施开创,李凤梅,张步娴,黎宗强*,莫胜兰,许心婷
(1.广西动物疫病预防控制中心,广西南宁 530001;2.广西大学动物科学技术学院,广西南宁 530005)
2009 年12 月,从一名印度裔瑞典病人尿路感染中首次分离到一株携带新德里金属β-内酰胺酶1(New Delhi metallo-β-lactamase-1,NDM-1)、具有超强耐药性的肺炎克雷伯菌[1];随后,从印度、巴基斯坦、英国等国家的病人分离到180 株以大肠杆菌、肺炎克雷伯菌等为主的肠杆菌科细菌,它们携带编码NDM-1 的blaNDM-1基因,除对替加环素和多粘菌素敏感外,对多种抗生素如β-内酰胺类、碳青霉烯类、大环内酯类、氨基糖苷类及喹诺酮类等均具有耐药性[2]。这种耐药“超级细菌”(Superbug)迄今已在巴尔干半岛各国、美国、加拿大、荷兰、中国等许多国家出现和流行,呈世界性分布[3-4]。
目前,blaNDM-1基因主要发现于肠杆菌科的大肠杆菌、肺炎克雷伯菌以及不动杆菌属的鲍曼不动杆菌等;其它一些细菌也可携带该基因,其中携带blaNDM-1基因的沙门氏菌已在美国、法国、中国等多个国家被发现[5]。当前,对blaNDM-1基因阳性菌的筛查主要采用表型筛查和基因检测[6]。表型筛查包括E-test 法、改良Hodge 试验、亚胺培南-EDTA 纸片协同试验等[6],但其存在耗时长、特异性差、灵敏度低等缺点。基因检测具有快速、特异及敏感等优点,现已报道的检测方法包括普通PCR、荧光定量PCR、LAMP、基因芯片技术等[7-9]。本研究针对blaNDM-1及其变异体基因序列的保守区域,设计一对特异性引物和一条MGB 探针,建立了检测blaNDM-1基因的Taq Man-MGB 荧光定量PCR 方法,为监测携带blaNDM-1基因的动物源致病性超强耐药菌提供了有效的技术手段。
1 材料和方法
1.1 菌 株 鸡白痢沙门氏菌(CVCC538)、大肠杆菌(ATCC25922)、多杀性巴氏杆菌(CVCC386)、鼠伤寒沙门氏菌(ATCC14028)标准株均购自国家兽医微生物菌种保藏中心。鸡源致病性沙门氏菌34 株分离株由广西动物疫病预防控制中心分离、鉴定和保存,应用ATB Expression 自动药敏仪进行ATB VET药敏试剂条(含28 种肠杆菌科常用抗菌药物)药敏试验,表明这些分离株均为六重以上的耐药菌[10]。
1.2 主要试剂 Premix Ex TaqTM(Perfect Real Time)试剂盒、RNA PCR Kit(AMV)Ver.3.0、MiniBEST Viral RNA/DNA Extraction Kit Ver.4.0、pMD18-T 载体、E.coli DH5α 感受态细胞、Hin d Ⅲ和Eco RⅠ内切酶、质粒DNA 提取试剂盒均购自TaKaRa 公司;产NDM-1 细菌检测试剂盒购自杭州天和微生物试剂有限公司。
1.3 引物和探针的设计与合成 参考GenBank 中登录的blaNDM-1基因(FN396876、AB604953、AB614355)及其变异体blaNDM-2~blaNDM-12基因序列(JF703135、JQ734687、JQ348841、JN104597、JQ235754、JX262694、AB744718、KC999080、KF361506、KP265940、AB926431)的保守区域,利用软件Beacon Designer 7.9 设计1对特异性引物和1 条Taq Man-MGB 探针(表1),由TaKaRa 公司合成。
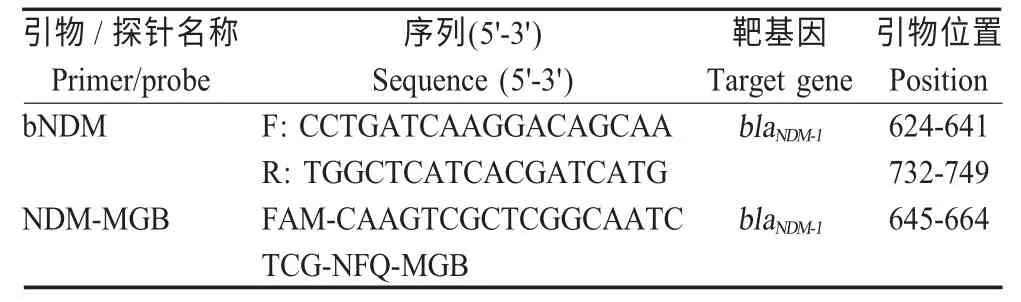
表1 引物及探针序列Table 1 Sequences of primers and probe
1.4 重组质粒标准品的构建 根据blaNDM-1基因及其变异体blaNDM-2~blaNDM-12基因序列,选取一段长279 bp 的保守序列,由TaKaRa 公司通过体外合成单链DNA 小片段,再通过PCR 方法扩增该片段后,克隆至pMD18-T 载体中构建重组质粒pMD-NDM279。以重组质粒pMD-NDM279 为模板,利用引物bNDM 进行PCR 扩增,回收、纯化扩增产物后克隆至pMD18-T 载体中,构建重组质粒pNDM-1,并经过测序鉴定,作为阳性标准品。测定其OD260nm/OD280nm值,计算质粒浓度,并根据公式换算成拷贝数:每μL 样品中质粒的拷贝数=质粒浓度(ng/μL)×阿伏伽德罗常数×10-9/(660×质粒碱基数)。
1.5 荧光定量PCR反应条件的优化 以重组质粒pNDM-1 为模板,建立20 μL 反应体系,采用方阵法逐一对引物浓度(0.1 pmol/μL~0.6 pmol/μL)、MGB 探针浓度(0.2 pmol/μL~0.8 pmol/μL)、参比染料浓度(50×稀释,用量0.2 μL~0.5 μL)、退火温度(54 ℃~64 ℃)进行优化,以确定Taq Man-MGB 荧光定量PCR 的最佳反应条件。
1.6 标准曲线的制作 以10 倍系列稀释成7 个浓度梯度的重组质粒(2.59×109拷贝/μL~2.59×103拷贝/μL)为模板,建立20 μL 反应体系,根据优化的反应条件,进行荧光定量PCR 扩增,生成标准曲线。
1.7 特异性试验 以pNDM-1 及鸡白痢沙门氏菌、鼠伤寒沙门氏菌、大肠杆菌、多杀性巴氏杆菌标准株的基因组DNA 为模板,以无模板反应体系为阴性对照,应用建立的荧光定量PCR 方法进行检测。
1.8 敏感性试验 以10 倍系列稀释的pNDM-1 作为模板,进行荧光定量PCR(模板分别为2.59×106拷贝/μL~2.59×100拷贝/μL 7 个梯度)和普通PCR(模板分别为2.59×109拷贝/μL~2.59×101拷贝/μL 9个梯度)扩增,确定其检出下限。
1.9 重复性试验 将10 倍系列稀释的5 个浓度梯度(2.59×108拷贝/μL~2.59×104拷贝/μL)的pNDM-1 作为模板,进行荧光定量PCR 重复性试验,分析其稳定性。进行组内重复性试验时,每个稀释度重复3 孔;进行组间重复性试验时,同1 次反应每个稀释度重复3 孔,重复3 次反应,间隔1周。
1.10 临床样品检测 应用所建立的荧光定量PCR方法,对34 株鸡源致病性沙门氏菌进行blaNDM-1基因的筛查,以评价该方法的实用性。
同时采用2010 年国家卫生部制定的《产NDM-1 泛耐药肠杆科细菌感染诊疗指南(试行版)》中的双纸片协同试验,按照产NDM-1 细菌检测试剂盒说明,进行细菌产NDM-1 的表型鉴定。将美洛培南(10 μg)纸片和滴加EDTA 的美洛培南(1 500 μg)纸片的抑菌圈直径进行比较,两者差值≥5 mm者为阳性,判定为细菌产NDM-1;两者差值<5 mm者为阴性,判定为细菌不产NDM-1。最后将双纸片协同试验结果与荧光定量PCR 检测结果进行比较,分析两种方法的符合率。
2 结果
2.1 重组质粒标准品的制备 以含有blaNDM-1基因279 bp 片段的重组质粒pMD-NDM279 为模板,采用特异性引物进行PCR 扩增,将其克隆至pMD18-T载体,构建重组质粒标准品pNDM-1。对其测序鉴定表明正确构建了blaNDM-1基因重组质粒标准品(图1)。经测定,其浓度为79.989 μg/mL,换算成拷贝数为2.59×1010拷贝/μL。
2.2 荧光定量PCR最佳反应条件的确定 经过优化试验,获得最佳反应条件,确定Taq Man-MGB 荧光定量PCR 20 μL 反应体系为:Premix Ex TaqTM(Perfect Real Time)10 μL,Rox 参比染料(50×)0.5 μL,上下游引物bNDM-F(10 μM)、bNDM-R(10 μM)各0.5 μL,NDM-MGB 探针(10 μM)1.0 μL,pNDM-1质粒模板2.0 μL,灭菌双蒸水5.5 μL。反应程序为:95 ℃20 s;95 ℃5 s、58 ℃20 s,40 个循环,同时收集荧光信号。
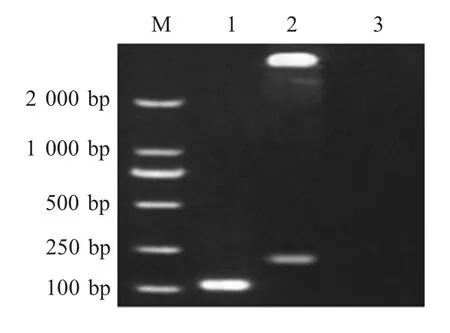
图1 重组质粒pNDM-1 的鉴定Fig.1 Identification of the recombinant plasmid pNDM-1
2.3 标准曲线的制作 以7 个梯度的重组质粒标准品为模板,进行Taq Man-MGB 荧光定量PCR,绘制扩增曲线和标准曲线(图2)。结果显示,起始模板量与Ct 值之间存在良好的线性关系,相关系数R2达到0.999。

图2 Taq Man-MGB 荧光定量PCR 的扩增曲线(A)及标准曲线(B)Fig.2 Dynamic curves(A)and standard curve(B)of the real-time PCR
2.4 特异性试验结果 采用建立的荧光定量PCR方法分别以重组质粒pNDM-1 及鸡白痢沙门氏菌、鼠伤寒沙门氏菌、大肠杆菌、多杀性巴氏杆菌标准株的基因组DNA 为模板进行特异性试验,结果显示仅重组质粒标准品为阳性,其它细菌标准株及对照均为阴性,表明该方法具有良好的特异性(图3)。
2.5 敏感性试验结果 以2.59×106拷贝/μL~2.59×100拷贝/μL 7 个梯度的重组质粒pNDM-1 作为模板进行Taq Man-MGB 荧光定量PCR,结果显示其检出下限为2.59 拷贝/μL;以2.59×109拷贝/μL~2.59×101拷贝/μL 9 个梯度的重组质粒pNDM-1 作为模板进行普通PCR,结果显示其检出下限为2.59×102拷贝/μL。结果表明荧光定量PCR比普通PCR 敏感性高100 倍(图4)。
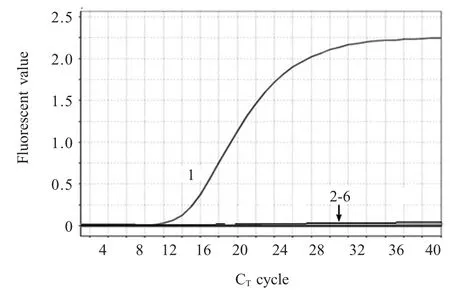
图3 Taq Man-MGB 荧光定量PCR 特异性试验的扩增曲线Fig.3 Dynamic curves of the real-time PCR for specificity detection
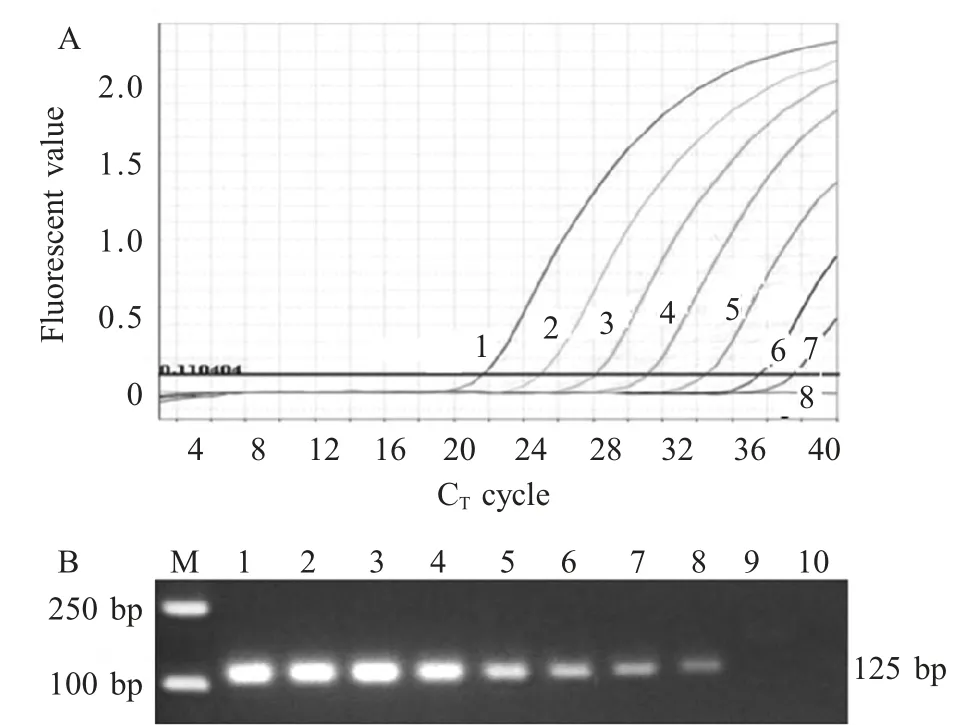
图4 Taq Man-MGB 荧光定量PCR 与普通PCR 敏感性试验Fig.4 Sensitivity tests of the real-time PCR(A)and conventional PCR(B)
2.6 重复性试验结果 以5 个浓度梯度的重组质粒pNDM-1 为模板,进行重复性试验,结果显示组内及组间重复性试验的变异系数为0.35 %~1.20 %,均小于1.5 %(表2),表明所建立的荧光定量PCR方法重复性良好。
2.7 临床样品检测 应用所建立的荧光定量PCR对34 株于2013 年~2015 年采自广西的鸡源致病性沙门氏菌分离株进行blaNDM-1基因筛选,结果显示未能检测到携带blaNDM-1基因的沙门氏菌分离株。
应用双纸片协同试验对大肠杆菌、鸡白痢沙门氏菌、多杀性巴氏杆菌、鼠伤寒沙门氏菌标准株以及34 株鸡源致病性沙门氏菌分离株进行耐药表型检测,结果显示,所有细菌对美洛培南和复合美洛培南的抑菌圈直径的相差值均为小于5 mm,判定为阴性,不产生NDM-1。将双纸片协同试验与Taq Man-MGB 荧光定量PCR 的结果进行比较,两者的符合率为100 %。

表2 Taq Man-MGB 荧光定量PCR 的重复性分析Table 2 Reproducibility assay of Taq Man-MGB real-time PCR
3 讨论
除了blaNDM-1基因,迄今还发现其变异体blaNDM-2~blaNDM-12,它们之间核苷酸序列同源性很高,仅存在个别碱基位点的差异[4]。blaNDM-1~blaNDM-12基因位于细菌内部的质粒上,可通过接合作用水平传播,将其超强耐药性向同种和不同种细菌扩散[2],使其它细菌种类携带blaNDM-1基因,对畜牧业和公共卫生安全造成严重威胁[5]。加强对携带blaNDM-1基因耐药细菌的监测,对及早发现超强耐药菌并防止其传播扩散意义重大。
迄今,所发现携带blaNDM-1基因的大肠杆菌、肺炎克雷伯菌、鲍曼不动杆菌、沙门氏菌等主要来自病人及环境样本,极少来自动物[5]。在我国,Wang等2012 年首次报道从鸡源洛菲不动杆菌(Acinetobacter lwoffii)中检测到blaNDM-1基因[11];温肖会等[12]应用PCR 方法对分离自动物及环境的229 株大肠杆菌、31 株链球菌进行检测,未发现携带blaNDM-1基因的分离株。沙门氏菌是重要的人畜共患病原菌,近年来出现严重的耐药及多重耐药现象[13],我国已从病人中分离到携带blaNDM-1基因的沙门氏菌[14],但未见来自动物的报道。
本研究针对blaNDM-1基因及其变异体blaNDM-2~blaNDM-12基因序列的保守区域,设计特异性引物和Taq Man-MGB 探针,经过优化反应条件,建立了特异性强、敏感性高、重复性好的blaNDM-1基因Taq Man-MGB 荧光定量PCR 方法,可以用于快速检测blaNDM-1基因及其变异体blaNDM-2~blaNDM-12基因。
2013 年~2015 年,从广西各地分离鉴定了34株鸡源致病性沙门氏菌,药敏试验表明这些分离株多重耐药严重,均为6 重耐药以上[10]。本研究应用所建立的Taq Man-MGB 荧光定量PCR 方法对这34株致病性沙门氏菌分离株进行检测,未能检测到携带blaNDM-1基因的分离株,表明目前广西养鸡场存在携带blaNDM-1基因“超级细菌”的几率较低。但由于养殖环节不合理使用甚至滥用抗菌药物极为严重,应予高度重视,不断扩大监测面,建立有效的防控措施。
动物致病性细菌的耐药问题日益严峻,必须加强监测和防范,以确保畜牧业健康发展和公共卫生安全。本研究建立的blaNDM-1基因Taq Man-MGB 荧光定量PCR 方法具有特异性强、敏感性高、重复性好的特点,为监测携带blaNDM-1基因及其变异体blaNDM-2~blaNDM-12基因的超级细菌提供了有效的技术手段。
[1]Yong D,Toleman M A,Giske C G,et al.Characterization of a new metallo-beta-lactamase gene,blaNDM-1,and a novel erythromycin estsrase gene carried on a unique genetic structure in Klebsiella pneumonia sequence type 14 from India[J].Antimicrob Agents Chemother,2009,53(12):5046-5054.
[2]Kumarasamy K K,Toleman M A,Walsh T R,et al.Emergence of a new antibiotic resistance mechanism in India,Pakistan,and the UK:a molecular,biological,and epidemiological study[J].Lancet Infect Dis,2010,10(9):597-602.
[3]Berrazeg M,Diene S,Medjahed L,et al.New Delhi Metallobeta-lactamase around the world:an eReview using Google Maps[J].Euro Surveill,2014,19(20):20809.
[4]Dortet L,Poirel L,Nordmann P.Worldwide dissemination of the NDM-type carbapenemases in Gram-negative bacteria[J].Biomed Res Int,2014,2014:249856.
[5]Wailan A M,Paterson D L.The spread and acquisition of NDM-1:a multifactorial problem[J].Expert Rev Anti Infect Ther,2014,12(1):91-115.
[6]Nordmann P,Poirel L,Carrer A,et al.How to detect NDM-1 producers[J].J Clin Microbiol,2011,49(2):718-721.
[7]Huang Li,Hu Xiu-mei,Zhou Man,et al.Rapid detection of New Delhigene and variants coding forcarbapenemases with different activities by use of a PCR-based in vitro protein expression method[J].J Clin Microbiol,2014,52(6):1947-1953.
[8]Solanki R,Vanjari L,Ede N,et al.Evaluation of LAMP assay using phenotypic tests and conventional PCR for detection of blaNDM-1and bla KPC genes among carbapenem-resistant clinical Gram-negative isolates[J].J Med Microbiol,2013,62(Pt 10):1540-1544.
[9]Cuzon G,Naas T,Bogaerts P,et al.Evaluation of a DNA microarray for the rapid detection of extended-spectrum β-lactamases(TEM,SHV and CTX-M),plasmid-mediated cephalosporinases(CMY-2-like,DHA,FOX,ACC-1,ACT/MIR and CMY-1-like/MOX)and carbapenemases(KPC,OXA-48,VIM,IMP and NDM)[J].J Antimicrob Chem,2012,67(8):1865-1869.
[10]施开创,李凤梅,邹联斌,等.鸡源致病性沙门氏菌的分离鉴定及血清型和药物敏感性分析[J].中国畜牧兽医,2015,42(8):2160-2168.
[11]Wang Yang,Wu Cong-ming,Zhang Qi-jing,et al.Identification of New Delhi metallo-β-lactamase 1 in Acinetobacter lwoffii of food animal origin[J].PLoS one,2012,7(5):e37152.
[12]温肖会,翟少伦,邱婷,等.细菌blaNDM-1基因PCR 检测方法的建立及应用[J].动物医学进展,2013,34(12):145-149.
[13]刘芳萍,赵玉林,李昌文,等.鸡源性沙门氏菌耐药基因检测与耐药相关性分析[J].中国预防兽医学报,2013,35(8):627-630.
[14]Huang Jin-wei,Wang Ming-hua,Ding Hui,et al.New Delhi metallo-β-lactamase-1 in carbapenem-resistant Salmonella strain,China[J].Emerg Infect Dis,2013,19(12):2049-2051.

