以CotB为分子载体表面展示鸡白痢沙门氏菌OmpC的重组枯草杆菌芽孢对小鼠免疫效果的研究
刘明刚,戴茜茜,徐毓琴,张飞燕,唐慧琴,潘康成,2*
(1.四川农业大学 动物医学院/动物微生态研究中心,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
沙门氏菌感染是一类极其重要的传染病,目前疫苗接种仍是实践中抗沙门氏菌感染的主要措施。但由于沙门氏菌减毒活疫苗或者灭活全菌疫苗存在脂多糖不良反应、免疫持续期短、毒力返祖风险以及沙门氏菌血清型复杂且各血清型之间不能提供交叉保护等限制了疫苗的应用[1-3]。因此,以沙门氏菌某些确切、无毒副作用的成份制备亚单位疫苗的研究受到关注[2,4]。沙门氏菌外膜蛋白存在一个孔形成蛋白家族,称为孔蛋白[5]。在众多孔蛋白中,外膜蛋白C(Outer membrane protein C,OmpC)为携带独特外露表位的主要表面抗原,能够诱导机体产生高水平的抗OmpC 抗体,并可以加强细胞介导的保护性免疫反应,为机体提供抗沙门氏菌感染的保护性免疫反应。同时不同血清型沙门氏菌中ompC 基因具有高度保守性,使其在疫苗研制方面具有重要应用潜力[5-7]。枯草芽孢杆菌芽孢展示系统凭借其出色的安全性与稳定性广泛应用于抗原等其他生物活性分子表面展现与递送等[8-9]。在构成芽孢衣壳蛋白的多肽中,CotB(Coat protein B)由于更接近芽孢表面,因此更适宜作为载体将外源蛋白,尤其是疫苗抗原展现于芽孢表面,通过斑点免疫印迹研究表明,当以CotB 作为分子载体时,每个芽孢可表达约1×103重组分子,同时芽孢衣壳蛋白由枯草芽孢杆菌母细胞产生,并在芽孢的形成过程中在母细胞的细胞质中进行组装,因此不受分泌信号与跨膜转运的束缚[8-9]。因此,本实验通过对小鼠口服给予本实验室构建以CotB 为分子载体表面展示鸡白痢沙门氏菌外膜蛋白OmpC 的重组枯草芽孢杆菌SE1 芽孢,研究其免疫效果,为开发新型鸡白痢沙门氏菌口服疫苗奠定基础。
1 材料和方法
1.1 菌株及实验动物 鸡白痢沙门氏菌CVCC533和鼠伤寒沙门氏菌SL1344 购自中国兽医药品监察所;重组枯草芽孢杆菌SE1(168ΔamyE::cotB-ompC)由本中心保存与构建;野生型枯草芽孢杆菌168 由本中心保存。5 周龄SPF 级的雌性昆明小鼠(体质量23.0±2.0 g)购自成都达硕实验动物有限公司。
1.2 主要试剂 辣根过氧化物酶标记的兔抗鼠IgG(IgG-HRP)与羊抗鼠IgA 购自Santa Cruz Biotechnology;高吸附96 孔平底聚苯乙烯酶标板和EL-TMB显色试剂盒购自生工生物工程(上海)有限公司。
1.3 枯草芽孢杆菌芽孢制备 通过营养耗尽法[10]进行重组枯草芽孢杆菌SE1 与野生型枯草芽孢杆菌168 的芽孢制备,培养物65 ℃水浴处理1 h,杀死残余营养型细胞,芽孢化悬液经离心(10 000 r/min,10 min,4 ℃)收集沉淀,去离子水重悬沉淀,调整芽孢浓度为5×1010cfu/mL,-20 ℃保存备用。
1.4 实验设计 120 只5 周龄SPF 级的雌性昆明小鼠(体质量23.0±2.0 g)预饲适应期结束后,随机分为5 组,每组24 只,按照表1 实验设计进行处理,A组与B 组在试验的第0、15 d 分别两次灌服重组枯草芽孢杆菌SE1 与野生型枯草芽孢杆菌168 的芽孢,每次每只灌服量为200 μL,含芽孢1.0×1010cfu;C 组与D 则将重组枯草芽孢杆菌SE1 与野生型枯草芽孢杆菌168 的芽孢拌料饲喂小鼠,每克饲料含1.0×106cfu 芽孢。G 组为非免疫组,仅饲喂基础日粮;所有动物实验程序按照中国疾病预防控制中心关于实验动物福利与使用指导进行。
1.5 小鼠血清IgG及肠粘膜SIgA抗体水平的检测
1.5.1 间接ELISA 包被抗原制备 鸡白痢沙门氏菌CVCC533 活化后,挑取单菌落接种于100 mL 营养肉汤中,37 ℃160 r/min 振荡培养16 h,平板活菌计数并用PBS(pH7.4)调整细菌浓度为4×109cfu/mL。
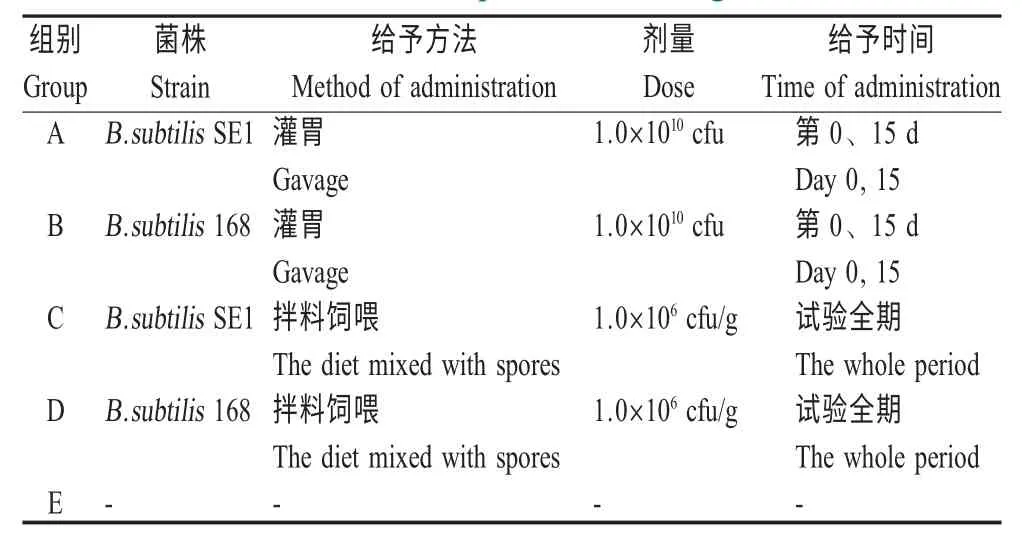
表1 实验设计Table 1 Experimental design
1.5.2 抗体检测样品的采集 在试验前1 d 与试验第22 d 时,每组随机选取4 只小鼠进行眼眶采血,室温与4 ℃条件下分别静置2 h 后离心收集血清(4 ℃,2 500 r/min,10 min),-20 ℃保存。采血后的小鼠颈椎脱臼迫杀,无菌剖取小肠,向肠腔内注入预冷的0.5 mL PBS,轻轻晃动肠段2 min 后收集内容物,4 ℃4 500 r/min 离心10 min 收集上清液,-20 ℃保存。
1.5.3 免疫小鼠抗体水平的检测 采用包被液0.05 mol/L 碳酸盐缓冲液(pH9.6)稀释热灭活后的鸡白痢沙门氏菌菌液至1×109cfu/mL,参照文献方法进行全细胞间接ELISA 法检测样品血清IgG 与小肠内容物SIgA 水平[11]。统计样品的P/N 值即免疫前后样品ELISA OD450nm值间的比值,当P/N≥2.1 判为阳性,表明产生具有保护作用的抗体,而当1.5≤P/N<2.1则判为可疑,P/N<1.5 为阴性,未产生保护性抗体。
1.6 鼠伤寒沙门氏菌SL1344 LD50测定 参照文献[12]的方法,测定鼠伤寒沙门氏菌SL1344 对小鼠的LD50。保存的鼠伤寒沙门氏菌SL1344 经活化后,挑取单菌落接种于50 mL 营养肉汤中,37 ℃160 r/min振荡培养16 h,5 000 r/min 离心5 min,收集菌体,灭菌生理盐水洗涤3 次,重悬菌体。采用平板活菌计数法检测细菌浓度,并调整细菌浓度为4×109cfu/mL、4×108cfu/mL、4×107cfu/mL 与4×106cfu/mL。取32 只5 周龄SPF 级的昆明小鼠,随机分为4组,每组8 只,每组小鼠分别腹腔注射0.5 mL 上述4 个浓度的鼠伤寒沙门氏菌SL1344 菌液,观察72 h,记录死亡率与存活率,计算LD50。
1.7 重组芽孢抗鼠伤寒沙门氏菌感染交叉保护作用方法1.4 中的小鼠饲喂至第22 d 时,每组随机取16只,各分成2 组,一组腹腔注射2×LD50/只的鼠伤寒沙门氏菌SL1344,另一组腹腔注射10×LD50/只的鼠伤寒沙门氏菌SL1344,观察72 h,记录发病与死亡情况。
1.8 数据统计 采用SPSS 统计处理软件(Version 20.0)对实验数据进行分析。
2 结果
2.1 免疫小鼠血清IgG及肠粘膜SIgA水平检测结果 将鸡白痢沙门氏菌CVCC533 全菌作为包被抗原,对免疫前1 d 与试验第22 d 的各组小鼠OmpC特异性血清IgG 与肠粘膜SIgA 抗体水平进行ELISA检测,结果显示,两种方式口服重组芽孢组(A 组与C 组)血清IgG 与粘膜SIgA 的P/N≥2.1,而对照组(B、D 与E 组)P/N<1.5;口服重组芽孢组所诱导的血清IgG 与粘膜SIgA 的P/N 值较3 个非重组芽孢组差异均极显著(p<0.01);拌料饲喂给予重组芽孢组(C 组)P/N 值显著高于灌胃给予重组芽孢组(A 组)(p<0.05)(表2)。结果表明,口服给予小鼠重组芽孢可以诱导产生血清IgG 和肠道粘膜SIgA,其中拌料饲喂所诱导产生的免疫保护抗体水平优于灌服。
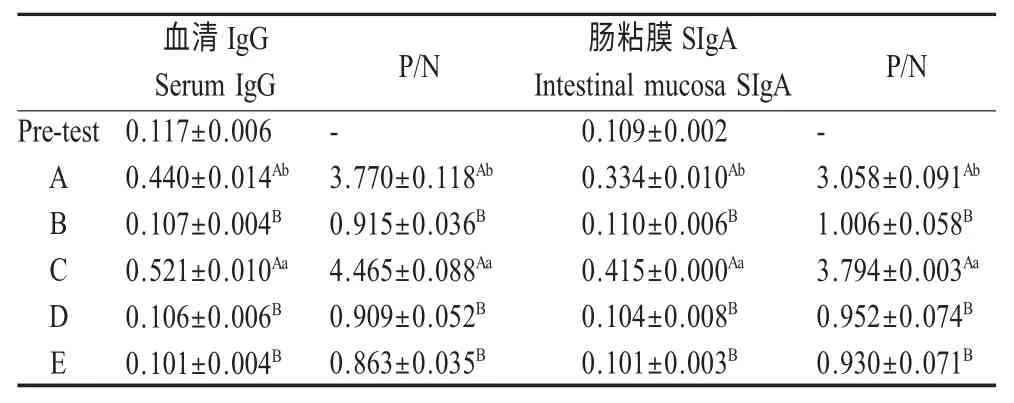
表2 口服重组芽孢前后小鼠血清IgG 与肠粘膜SIgA 水平Table 2 Serum IgG and intestinal mucosa SIgA titers before and after oral immunizations
2.2 攻毒试验评估重组芽孢交叉保护作用 重组芽孢保护性试验是评估其抗沙门氏菌感染免疫活性的另一个重要指标,同时通过对鸡白痢沙门氏菌CVCC533 与鼠伤寒沙门氏菌SL1344 的OmpC 进行PCR 扩增与测序,并结合NCBI 数据库中核苷酸与蛋白质BLAST 工具分析,二者OmpC 同源性高达99 %。通过方法1.6 计算鼠伤寒沙门氏菌SL1344 LD50为2×108cfu/只(95 %置信区间为1.31×108cfu~3.0×108cfu)。本试验选取2×LD50与10×LD50两个剂量进行小鼠攻毒试验,观察72 h,结果显示,通过灌胃和拌料饲喂给予重组芽孢的A 组和C 组小鼠均可完全保护2×LD50攻毒剂量的鼠伤寒沙门氏菌SL1344 感染,而对照组(B、D 与E 组)在24 h 内相继死亡。在使用10×LD50剂量攻毒试验中,对照组(B、D 与E 组)均在攻毒后16 h 内死亡,而重组芽孢组在72 h 的观察期内保护率均为50 %(表3)。
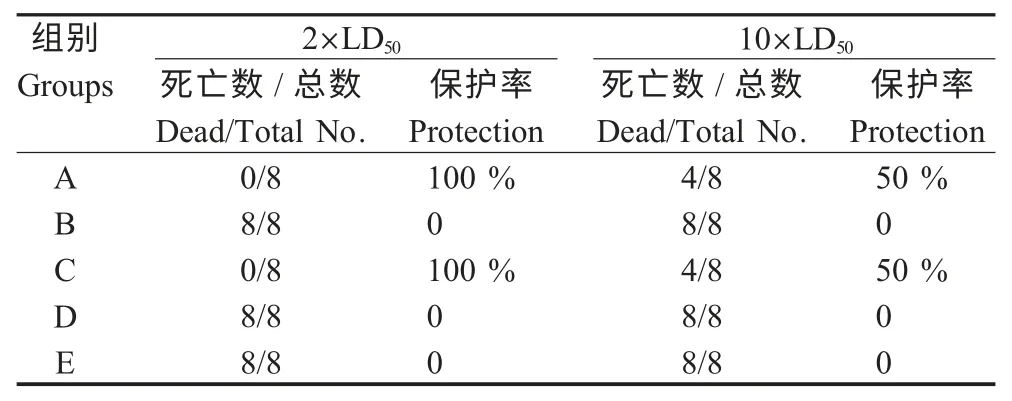
表3 重组芽孢对鼠伤寒沙门氏菌SL1344攻毒交叉保护作用Table 3 Cross-protection of mice immunized with recombinant spores against the challenge with S.typhimurium strain SL1344
3 讨论
通过口服等粘膜途径免疫的粘膜疫苗可以刺激机体产生较高水平的局部免疫甚至系统性免疫反应,能够有效阻止病原体、致敏源等有害物质通过粘膜表面侵入机体[13]。沙门氏菌作为常见的肠道致病菌,主要通过突破肠道上皮粘膜屏障侵入机体而引起急性或慢性感染[14]。因此,研制可有效刺激局部粘膜免疫反应的粘膜疫苗对预防沙门氏菌感染意义重大。
本实验选取兼具极佳稳定性与安全性的枯草杆菌芽孢展示系统表达与递送在临床分离的多种沙门氏菌血清型中具有高度保守性的鸡白痢沙门氏菌主要表面抗原OmpC,结果表明,与对照组相比,口服重组芽孢可以诱导产生极显著(p<0.01)水平的血清IgG 与肠粘膜SIgA 特异性抗体。相对于使用荚膜多糖Vi 抗原等其他成份制备的亚单位疫苗不能刺激产生抗原特异性SIgA 抗体的缺点,表面展示OmpC 的重组芽孢经口服后可被M 细胞摄取并转移至派伊尔氏淋巴集结中,在那里可与抗原递呈细胞及免疫细胞相互作用激发粘膜免疫应答,产生抗原特异性SIgA 抗体,而这一特性对预防通过粘膜侵入机体的沙门氏菌至关重要[14-15]。
感染哺乳动物与鸟类的大多数沙门氏菌属于肠道沙门氏菌,该类沙门氏菌不但血清型众多,而且往往具有宿主特异性,缺乏交叉保护作用,因此限制了沙门氏菌疫苗的应用[1,3]。研究表明通过免疫沙门氏菌外膜蛋白等成份,可以刺激产生具有交叉保护作用的免疫反应[12]。在其中一项研究中,研究者使用孔蛋白免疫小鼠后,使用同源或异源沙门氏菌进行攻毒试验,结果表明孔蛋白可提供显著的交叉保护作用(p<0.01)[12]。鸡白痢沙门氏菌OmpC 与鼠伤寒沙门氏菌OmpC 具有较高的同源性,在本实验中重组芽孢所诱导的免疫反应对异源沙门氏菌感染具有一定交叉保护作用,为研发新型沙门氏菌疫苗提供了新的思路。
[1]Singh B.Salmonella vaccines for animals and birds and their future perspective[J].Open Vaccine J,2009,2:100-112.
[2]Organization W H.Typhoid vaccines:WHO position paper[J].Weekly Epidemiolo Rec,2008,83(6):49-59.
[3]Okamura M,TachizakI H,Kubo T,et al.Comparative evaluation of a bivalent killed Salmonella vaccine to prevent egg contamination with Salmonella enterica serovars Enteritidis,Typhimurium,and Gallinarum biovar Pullorum,using 4 different challenge models[J].Vaccine,2007,25(25):4837-4844.
[5]Sood S,Rishi P,Vohra H,et al.Cellular immune response induced by Salmonella enterica serotype Typhi iron-regulated outermembrane proteins at peripheral and mucosal levels[J].J Med Microbiol,2005,54(9):815-821.
[6]Baalaji N S,Mathew M,Krishnaswamy S.Functional assay of Salmonella typhi OmpC using reconstituted large unilamellar vesicles:a general method for characterization of outer membrane proteins[J].Biochimie,2006,88(10):1419-1424.
[7]Agarwal R K,Porteen K,Dubal Z B,et al.Evaluation of recombinant outer membrane protein based vaccine against Salmonella Typhimurium in birds[J].Biologicals,2013,41(3):162-168.
[8]Hinc K,Isticato R,Dembek M,et al.Expression and display of UreA of Helicobacter acinonychis on the surface of Bacillus subtilis spores[J].Microb Cell Fact,2010,9:2.
[9]Ning D,Leng X,Li Q,et al.Surface-displayed VP28 on Bacillus subtilis spores induce protection against white spot syndrome virus in crayfish by oral administration[J].J Appl Microbiol,2011,111(6):1327-1336.
[10]Nicholson W,Setlow P.Sporulation,germination and outgrowth[M].In:Harwood C R,Cutting S M,editors.Molecular biological methods for Bacillus.Chichester,UK:wiley.1990.
[11]Von Hunolstein C,Gomez M M,Pezzella C,et al.Evaluation of two serological methods for potency testing of whole cell pertussis vaccines[J].Pharmeuropa Bio,2008,2008(1):7-18.
[12]Tabaraie B,Sharma B K,Sehgal R,et al.Evaluation ofSalmonella porins as a broad spectrum vaccine candidate[J].Microbiol Immunol,1994,38(7):553-559.
[13]Pavot V,Rochereau N,Genin C,et al.New insights in mucosal vaccine development[J].Vaccine,2012,30(2):142-154.
[14]Gonzalez-escobedo G,Marshall J M,Gunn J S.Chronic and acute infection of the gall bladder by Salmonella Typhi:understanding the carrier state[J].Nat Rev Microbiol,2011,9(1):9-14.
[15]Hale C,Bowe F,Pickard D,et al.Evaluation of a novel Vi conjugate vaccine in a murine model of salmonellosis[J].Vaccine,2006,24(20):4312-4320.

