抗禽白血病病毒p27蛋白线性抗原表位的鉴定
李晓菲,朱海波,高 奇,王 琦,孙佳善,高玉龙,祁小乐,王永强,高宏雷,王笑梅*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/禽免疫抑制病科技创新团队,黑龙江 哈尔滨 150001;2.哈尔滨动物用生物制品国家工程研究中心有限公司,黑龙江 哈尔滨 150001;3.江苏省动物重要疫病与人畜共患病协同创新中心,江苏 扬州 225009)
禽白血病是由禽白血病病毒(Avian leukosis virus,ALV)引起的禽类多种肿瘤性疾病的统称。ALV 属于反转录病毒科,禽C 型反转录病毒属。根据病毒感染的宿主范围、干扰谱和囊膜抗原,可以将ALV 进一步区分为A 至G 7 个亚群[1-2]。J 亚群ALV(ALV-J)最早于1988 年在英国分离得到[2]。1999 年中国首次报道ALV-J 的出现,继而中国大部分地区相继出现ALV 感染的报道[3-5]。ALV 大范围的流行给我国养禽业造成了严重的经济损失[6]。
目前,该病的主要预防方法为淘汰阳性鸡,选育出无白血病鸡群以净化种群[7]。因此,该病的准确诊断尤为重要。本实验利用原核表达的重组衣壳蛋白(p27 蛋白)免疫小鼠,通过杂交瘤技术最终获得一株抗p27 蛋白的单克隆抗体(MAb)。并通过对p27蛋白的截短表达,确定了该MAb 识别的抗原表位,为禽白血病病原检测方法的建立提供了有利的工具。
1 材料和方法
1.1 病毒株、细胞和实验动物 ALV-J HPRS103株、ALV-A RAV-1 株和ALV-B RAV-2 株均由英国Pirbright 研究所Dr Nair 惠赠;DF-1、S/P20 细胞由本实验室保存;6 周龄BALB/c 雌鼠由本研究所实验动物中心提供。
1.2 主要试剂 大肠杆菌(E.coli)DH5α 和BL21 感受态购自天根生化科技(北京)有限公司;pET-30a 质粒由本实验室保存;PEG-4000、HPR 标记的羊抗鼠IgG(IgG-HRP)、羊抗鼠IgG-FITC 购自Sigma 公司;抗体亚类鉴定试剂盒购自赛默飞公司;蛋白纯化用材料购自GE healthcare。
1.3 重组表达质粒的构建及目的蛋白的表达 根据ALV-J HPRS103 株的序列(Z46390)设计一对引物5'-CACGAATTCAGCGCCTGCTACGGTGGTGACCC-3'(Eco RⅠ)/5'-ACTCTCGAGGGAGTTCATCTATTGC AACAACCAG-3'(XhoⅠ)。经PCR 扩增p27 目的基因,通过Eco R Ⅰ/Xho Ⅰ双酶切后克隆于pET-30a中,构建重组表达质粒pET-p27。将其转化BL21 E.coli 感受态细胞中,经IPTG 诱导表达,制备p27重组蛋白,按照文献[8]方法对重组蛋白进行纯化。
1.4 动物免疫及细胞融合 将纯化的p27 蛋白与等体积的弗氏完全佐剂乳化,对小鼠(100 μg/只)进行颈背部皮下注射。两周后,以弗氏不完全佐剂乳化的p27 蛋白对小鼠进行加强免疫。间隔两周,用二免同样的方法进行第3 次免疫。三免后21 d,用纯化的p27 蛋白(100 μg/只)对小鼠进行腹腔注射,3 d后,取小鼠脾细胞与SP2/0 骨髓瘤细胞进行融合[9]。
1.5 杂交瘤细胞的筛选及MAb的亚类鉴定 以纯化的p27 蛋白作为检测抗原,通过间接ELISA 方法进行杂交瘤细胞株的筛选。将筛选到的阳性杂交瘤细胞株利用有限稀释法进行克隆纯化3 代,直到阳性率为100 %。将纯化的杂交瘤细胞按文献[11]的方法腹腔接种6 周龄~8 周龄的小鼠制备小鼠腹水MAb。并利用MAb 亚型试剂盒对其进行亚类鉴定。具体步骤参考说明书。
1.6 MAb的间接免疫荧光(IFA)鉴定 将ALV-A、ALV-B 和ALV-J 分别接种于DF-1 细胞单层中,连续培养4 d 后,将细胞单层经无水乙醇固定15 min,以制备的MAb(1∶100)为一抗,羊抗鼠IgG-FITC(1∶100)为二抗,通过显微镜观察进行IFA 鉴定。
1.7 抗原表位的初步鉴定 将p27 编码基因分成部分重叠的6 段:p27-1(aa1-aa111)、p27-2(aa91-aa177)、p27-3(aa151-aa239)、p27-4(aa91-aa125)、p27-5(aa119-aa153)和p27-6(aa147-aa177),PCR 扩增后,克隆于原核表达载体pGEX-6P-1 中,阳性重组质粒测序正确后转化E.coli BL21,并以IPTG 诱导进行重组蛋白的表达。以制备的MAb 作为一抗,羊抗鼠IgG-HRP 作为二抗对表达的多肽进行western blot鉴定,初步确定p27 抗原表位所在的区域。
将MAb 识别的p27 片段继续进行截短表达,并采用原核表达的肽段包被96 孔ELISA 反应板,以制备的MAb 作为一抗,羊抗鼠IgG-HRP 作为二抗检测所表达肽段与MAb 的反应情况,从而确定p27抗原表位所在的位置。
2 结果
2.1 p27蛋白的原核表达、纯化及鉴定 以ALV-J HPRS103 cDNA 为模板,通过PCR 扩增p27 目的基因,并通过双酶切后克隆于pET-30a 质粒中构建重组表达质粒pET-p27。将pET-p27 转化E.coli BL21后,经IPTG 诱导获得可溶性表达的重组p27 蛋白。重组蛋白经过纯化后,SDS-PAGE 检测结果显示其分子量为36 ku,与预期结果相符(图1)。

图1 重组蛋白的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of the recombinant p27 protein expression
2.2 阳性杂交瘤细胞株的建立、MAb效价测定及MAb免疫球蛋白亚类鉴定 以原核表达的重组p27蛋白为免疫原免疫小鼠后,将小鼠脾细胞与SP2/0骨髓瘤细胞融合,通过间接ELISA 筛选阳性克隆以及3 次杂交瘤细胞克隆纯化,最终获得一株持续分泌ALV p27 蛋白的杂交瘤细胞株,命名为2C7。采用已建立的间接ELISA 方法对2C7 进行MAb 效价测定,结果显示小鼠腹水的效价为212。其IgG 亚型为IgG1/Kappa。
2.3 MAb的特异性鉴定 将纯化的重组蛋白进行western blot 鉴定。结果显示,在36 ku 处出现特异性条带,而空载体对照未出现相应条带。表明MAb 2C7 能够识别ALV 的衣壳蛋白p27(图2A)。
将ALV-A、ALV-B 和ALV-J 分别接种于DF-1细胞,未接毒的DF-1 细胞作为阴性对照。接毒后4 d以MAb 2C7 作为一抗,进行IFA 试验。IFA 试验结果表明,制备的MAb 2C7 与ALV-A,ALV-B 和ALV-J 均呈阳性反应(图2B),表明该MAb 能够与不同亚群的ALV 反应。
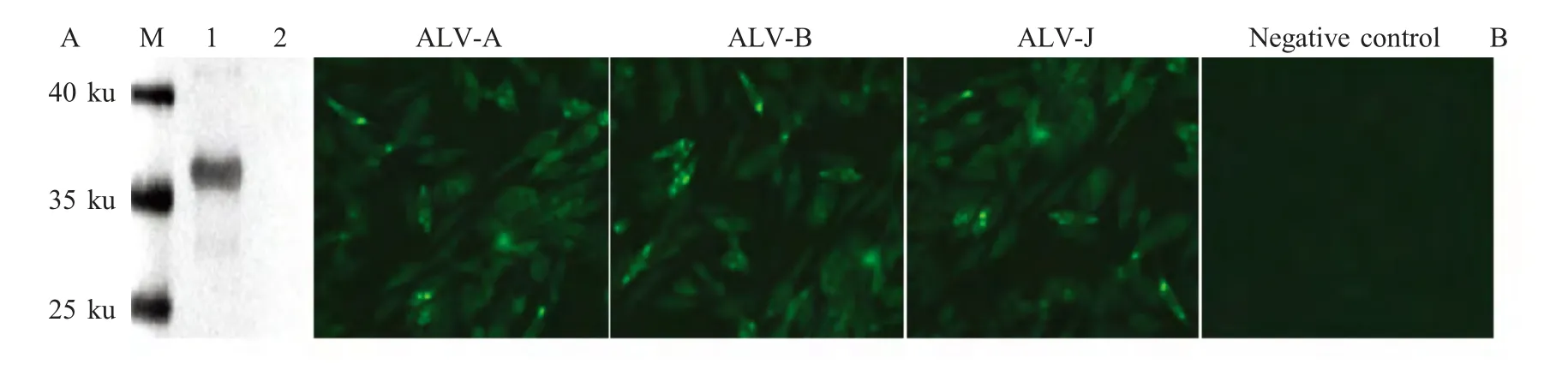
图2 MAb 的western blot 和IFA 鉴定Fig.2 Identification of the MAb by western blot(A)and IFA(B)
2.4 MAb线性抗原表位的鉴定 将p27 编码基因分成部分重叠的6 段:p27-1(aa1-aa111)、p27-2(aa91-aa177)、p27-3(aa151-aa239)、p27-4(aa91-aa125)、p27-5(aa119-aa153)和p27-6(aa147-aa177)分别克隆于pGEX-6P-1 中进行原核表达。以MAb 2C7为一抗,对表达的重组蛋白进行western blot 验证。结果显示,重组蛋白p27-5 能够与MAb 2C7 发生特异性反应(图3)。表明p27 蛋白的抗原表位可以初步确定在aa119~aa153 之间。
将p27-5 进一步进行截短表达p27-7(aa119-aa134)、p27-8(aa129-aa142)和p27-9(aa137-aa153),利用表达的肽段包被96 孔ELISA 检测板,以MAb 2C7 作为一抗,羊抗鼠IgG-HRP 作为二抗进行检测。结果表明多肽p27-8 能够与MAb 2C7 发生特异性反应(图4)。结果表明p27 蛋白的抗原表位可以进一步确定为129LVAITASALQAFRE142。
氨基酸序列比对结果显示,本研究鉴定的p27线性表位在ALV-A、ALV-B 和ALV-J 亚群之间高度保守。因此,该表位对于ALV 群特异性抗原检测试剂盒的研究具有重要意义。

图3 重组蛋白的SDS-PAGE 及western blot 分析Fig.3 SDS-PAGE(A)and western blot(B)analysis of the recombinant proteins
3 讨论

图4 重组蛋白的ELISA 分析Fig.4 ELISA analysis of the recombinant proteins
p27 蛋白是病毒衣壳蛋白,在外源性ALV-A、ALV-B 和ALV-J 各亚群间同源性高达90%,含量高,占病毒总蛋白成分的30 %以上,是制备检测抗体的首选抗原,对禽白血病的诊断具有重要意义。
本研究将p27 蛋白进行原核表达,原核表达系统操作简单,蛋白表达量高并且成本低[9-10]。采用纯化的原核表达蛋白作为免疫原免疫6 周龄BALB/c雌鼠,最终筛选得到一株MAb 2C7。Western blot 鉴定表明MAb 2C7 能够识别ALV 衣壳蛋白p27。IFA试验表明MAb 2C7 能够与家禽中常见的ALV 亚群:A、B 和J 亚群病毒发生特异性反应,这表明该MAb 与不同亚群ALV 具有良好的反应活性,为禽白血病病原学诊断方法的建立提供了有利的工具。
P27 蛋白作为ALV 的群特异性抗原,因为其序列保守并且含有许多抗原性强表位而成为制备检测抗体的首选抗原,对禽白血病的诊断具有重要意义。然而,目前对于p27 蛋白抗原表位的分析很少。确定蛋白上特异的抗原决定簇位点是研究蛋白质结构和功能的重要方法并且已经应用到疾病诊断和表位疫苗的研究中[11-13]。本研究通过对p27 蛋白进行截短表达,确定了其抗原表位位于129LVAITASA LQAFRE142。氨基酸序列比对结果显示,本研究所鉴定的p27 表位在ALV 各亚群之间高度保守。因此,该表位对于ALV 群特异性抗原检测试剂盒的研究具有重要意义。
本研究所制备的MAb 2C7 以及对p27 抗原表位的分析为ALV 感染的检测、p27 蛋白功能研究以及研发新的禽白血病ELISA 抗原检测试剂盒提供了有利的工具。
[1]Payne L N,Brown S R.A novel subgroup of exogenous avian leukosis virus in chickens[J].J Gen Virol,1991,72:801-807.
[2]Payne L N,Howes K,Gillespie A M,et al.Host range of Rous sarcoma virus pseudotype RSV(HPRS-103)in 12 avian species:support for a new avian retrovirus envelope subgroup,designated J[J].J Gen Virol,1992,73:2995-2997.
[3]Cui Zhi-zhong,Du Yan,Zhang Zhi,et al.Comparison of Chinese field strains of avian leukosis subgroup J viruses with prototype strain HPRS-103 and United States strains[J].Avian Dis,2003,47:1321-1330.
[4]Gao Yu-long,Qin Li-ting,Pan Wei,et al.Avian leukosis virus subgroup J in layer chickens,China[J].Emerg Infect Dis,2010,16:1637-1638.
[5]Sun Shu-hong,Cui Zhi-zhong Epidemiological and pathological studies subgroup J avian leukosis virus infections in Chinese local "yellow" chickens[J].Avian Pathol,2007,36:221-226.
[6]Cheng Zi-qiang,Liu J,Cui Zhi-zhong,et al.Tumors associated with avian leukosis virus subgroup J in layer hens during 2007 to 2009 in China[J].J Vet Med Sci,2010,72:1027-1033.
[7]陈晨,曹红,陈富勇,等.抗禽白血病P27 抗原单克隆抗体的制备与鉴定[J].中国预防兽医学报,2005,27(4):287-289.
[8]汪家政.蛋白质技术手册[M].北京:科学出版社,2001.
[9]Nelson P N,Reynolds G M,Waldron E E,et al.Monoclonal antibodies[J].Mol Pathol,2000,53:111-117.
[10]高玉龙,王笑梅.禽白血病的防治[J].畜牧兽医科技信息,2010,1:94-96.
[11]Sukupolvi-Petty S,Austin S K,Engle M,et al.Structure and function analysis of therapeutic monoclonal antibodies against dengue virus type 2[J].J Virol,2010,84:9227-9239.
[12]Kouzmitcheva G A,Petrenko V A,Smith G P.Identifying diagnostic peptides for lyme disease through epitope discovery[J].Clin Diagn Lab Immunol,2001,8:150-160.
[13]Langeveld J P,Casal J I,Osterhaus A D,et al.First peptide vaccine providing protection against viral infection in the target animal:studies of canine parvovirus in dogs[J].J Virol,1994,68:4506-4513.

