应用酵母双杂交系统筛选与流感病毒NS2蛋白相互作用的宿主蛋白
邵信媛,朱鹏阳,罗维玉,赵玉辉,梁立滨,姜 丽,陈化兰,胡永浩,李克生*,李呈军*
(1.甘肃农业大学 动物医学学院,甘肃 兰州 730070;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/农业部动物流感重点实验室,黑龙江哈尔滨 150001)
禽流感(Avian influenza,AI)是由正粘病毒科A型流感病毒属的禽流感病毒(AIV)引起的禽类全身性或呼吸道性传染病的总称。其中,H5N1 属于高致病性AIV(HPAIV),其流行严重威胁着养禽业及人类的健康。
AIV 为有囊膜的单股负链RNA 病毒,其基因组分为8 个节段,可以编码10 种蛋白(PB2、PB1、PA、HA、NP、NA、M1、M2、NS1、NS2)。其中,非结构蛋白NS2 由基因节段8 编码,分子量约14 ku。在病毒感染后期,NS2 在细胞核内与病毒核糖核蛋白复合体(vRNP)和M1 蛋白之间形成vRNP-M1-NS2 链式复合体,并与细胞的CRM1 蛋白相互作用,介导vRNP 复合体输出细胞核[1]。此外,NS2 蛋白可以与流感病毒聚合酶复合体的PB2 和PB1 蛋白结合,促进病毒基因组的复制。通过调控病毒复制过程中聚合酶的活性,NS2 蛋白对H5N1 AIV 在哺乳动物宿主体内的适应过程中具有重要意义[2]。还具有增强M1 蛋白的稳定性和促进病毒的包装与释放[3-4]。但关于NS2 的研究鲜有报道。
本研究以H5N1 AIV 的NS2 蛋白作为“诱饵”蛋白,利用酵母双杂交(Yeast two-hybrid,Y2H)筛选人的4 种细胞系的混合cDNA 文库,筛选鉴定到与NS2 相互作用的宿主蛋白PRDX3。免疫共沉淀(Co-IP)试验进一步证实两者之间在293T 细胞中存在特异性的相互作用,为进一步研究NS2 蛋白的功能奠定了基础。
1 材料和方法
1.1 主要实验材料 含有Calu-3、A549、THP-1 和U251 4 种细胞系的cDNA 文库由本实验室构建;质粒pGEX-6p-1、pEGFP、pCAGGS-和Y2H 系统有关的试剂及各种缺陷型培养基均购自Clontech 公司;酵母质粒提取试剂盒、大肠杆菌DH5α 均购自天根生化科技(北京)有限公司;Platinum Pfx DNA 聚合酶、转染试剂Lipofectamine LTX and Plus Reagent 均购自Invitrogen 公司;限制性内切酶、Pierce IP Lysis Buffer 均购自Thermo scientific 公司;T4 DNA 连接酶购自Promega 公司;Protein Marker 购自Fermentas公司;家兔抗Myc 标签单克隆抗体(MAb)、小鼠抗GFP MAb、家兔抗GFP MAb 购自Sigma-Aldrich 公司;IRDye800CW 山羊抗兔IgG 抗体和山羊抗小鼠IgG 抗体购自LI-COR Bioscience 公司。
1.2 酵母诱饵重组质粒p GBKT7-H5NS2的构建根据A/Anhui/02/2005(H5N1)NS2 基因(简称H5NS2)序列(CY098581.1)设计基因特异引物,上、下引物分别引入Eco RⅠ、Bam HⅠ酶切位点,PCR 扩增目的基因,经Eco RⅠ/Bam HⅠ双酶切后克隆于pGBKT7中,构建pGBKT7-H5NS2 诱饵重组质粒,并经测序鉴定。
1.3 诱饵重组质粒酵母菌的转化 采用标准的醋酸锂法制备酵母感受态细胞Y2HGold,按照Clontech公司说明书提供的方法将pGBKT7-H5NS2 转化到Y2HGold 感受态中,保存备用。
1.4 诱饵质粒自激活的检测 将含有pGBKT7-H5NS2/Y2HGold 重组酵母菌,分别划线接种于SD/-Trp/-Leu、SD/-Trp/-Ade/-His/-Leu、SD/-Trp/-Ade/-His/-Leu/A/X-a-gal 营养缺陷型培养基上,30 ℃培养1 周,观察诱饵质粒转化子在SD/-Trp/-Leu 和SD/-Trp/-Ade/-His/-Leu 培养基上是否生长以及是否在SD/-Trp/-Ade/-His/-Leu/A/X-a-gal 培养基上有蓝色克隆生长,是否存在自激活作用。
1.5 目的蛋白的筛选 按照双杂交系统说明书,将pGBKT7-H5NS2/Y2HGold 与4 种细胞系的Y187 cDNA 文库进行杂交后挑取阳性候选菌落。挑取的阳性候选菌落进行酵母质粒提取,并转化到大肠杆菌感受态DH5α 中提取质粒。
对筛选的阳性质粒进行测序分析后,利用NCBI 的在线工具Vectorscreen 除去目的片段两端所含部分载体序列,经BLAST(Basic local alignment search tool,http://www.ncbi.nlm.nih.gov/BLAST/)对测序结果进行同源性分析和比对,明确序列代表的基因信息。
1.6 共转化试验 将筛选的酵母阳性重组质粒与pGBKT7-H5NS2 共转化感受态酵母菌Y2HGold,同时设空白对照pGBKT7+pGADT7、自激活对照pGBKT7+重组捕获质粒、阳性对照pGBKT7-p53+pGADT7-T 和阴性对照pGBKT7-Lamin+pGADT7-T,以排除假阳性。
1.7 真核表达重组质粒pEGFP-H5NS2的构建及鉴定 根据H5NS2 序列设计基因特异引物,PCR 扩增目的基因后,将其通过Eco RⅠ/Bam HⅠ克隆于pEGFP-C1 中,构建pEGFP-H5NS2 重组质粒,并经测序鉴定。
1.8 真核表达重组质粒p CAGGS-myc-PRDX3的构建及鉴定 设计引物,以A549 细胞系cDNA 为模板,扩增PRDX3 基因,将其通过Eco RⅠ/XhoⅠ克隆于pCAGGS 中,构建pCAGGS-myc-PRDX3 重组质粒,并经测序鉴定。
1.9 Co-IP试验 按转染试剂盒方法将pEGFP-C1和 pCAGGS-myc-PRDX3 或 pEGFP-C1-H5NS2 和pCAGGS-myc-PRDX3 共转染到293T 细胞中。转染细胞48 h 后,收集细胞裂解物上清,取少量样品处理后进行western blot 检测,其余样品进行Co-IP 试验。Co-IP 试验流程如下:首先在剩余样品内加入小鼠抗GFP MAb,4 ℃感作12 h 后加入Dynabeads Protein G 磁珠,4 ℃继续感作6 h。以预冷的IP 裂解液洗涤4~6 次,加入适量IP 裂解液重悬磁珠进行SDS-PAGE,采用兔抗Myc MAb、兔抗GFP MAb对免疫沉淀复合物中的组分进行western blot 检测。
1.10 GST pull-down试验 将H5NS2 基因克隆于pGEX-6p-1 中,并在大肠杆菌中表达制备GSTH5NS2 重组蛋白和GST 标签蛋白。将pCAGGSmyc-PRDX3 转染293T 细胞,48 h 后收集细胞中的蛋白样品用于pull-down 试验。pull-down 试验流程如下:将GST-H5NS2 树脂与Myc-PRDX3 混合,同步设立GST 树脂与Myc-PRDX3 对照,置于4 ℃感作6 h。用裂解液洗去未结合的蛋白,加入适量裂解液重悬树脂进行SDS-PAGE,以家兔抗Myc MAb进行western blot 检测。
2 结果
2.1 酵母双杂交筛选与NS2蛋白相互作用的宿主蛋白及其功能分析 将诱饵质粒pGBKT7-H5NS2 转化酵母菌Y2HGold,重组菌能够在SD/-Trp/-Leu 培养基上生长,而且生长状态与其他各对照组无明显差异,表明该诱饵质粒无细胞毒性;重组菌不能在SD/-Trp/-Ade/-His/-Leu 上生长以及在SD/-Trp/-Ade/-His/-Leu/A/X-α-gal 培养基上无蓝色克隆生长,表明该诱饵质粒不存在自激活现象。酵母双杂交筛选结果显示被捕获的蛋白为HGS、EXOSC4、ZWINT、PRDX3、IRF3、NDUFB9 和RMND5B。Gene Ontology(GO)分析结果显示筛选得到的7 种宿主蛋白分别参与细胞代谢、生物调节、细胞生长发育、细胞组织间的相互作用和细胞定位等(表1)。
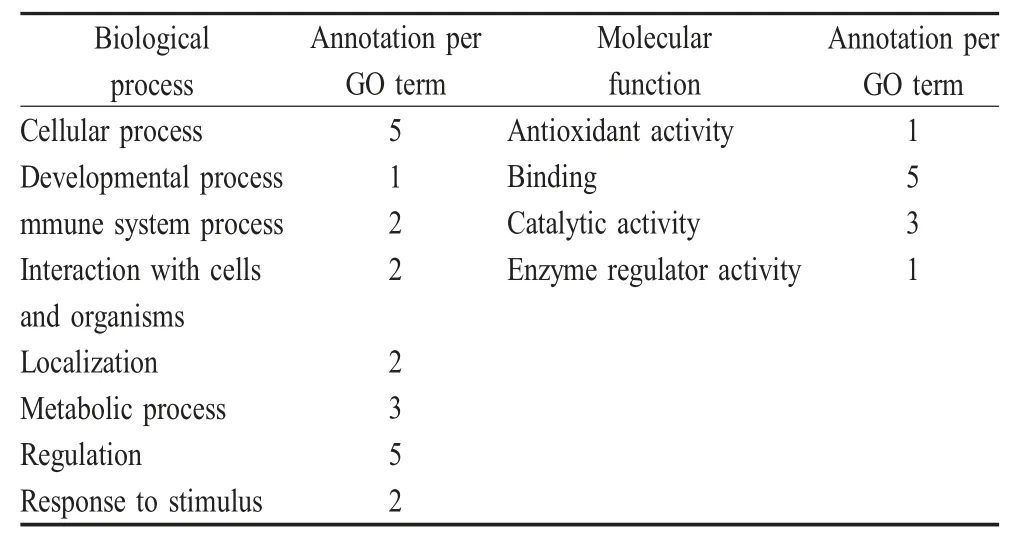
表1 与NS2 蛋白相互作用蛋白GO 分析Table 1 Bioactivity profile of the NS2-interacting proteins based on GO analysis
2.2 酵母共转化试验验证NS2蛋白与PRDX3的相互作用 自激活试验和毒性试验结果显示重组质粒pGADT7-PRDX3(AD-PRDX3)不存在自激活现象,并且对酵母细胞无毒性,能够排除结果的假阳性。将BD-NS2 与AD-PRDX3 共转化至酵母菌Y2HGold感受态细胞,并涂布于SD/-Trp/-Leu、SD/-Trp/-Ade/-His/-Leu 和SD/-Trp/-Ade/-His/-Leu/A/X-α-gal 培养平板上,这菌株在3 种不同的缺陷型培养基上均能够正常生长并分解底物X-α-Gal 而使菌落变蓝。结果表明,在酵母系统中NS2 蛋白与PRDX3 存在相互作用(图1)。
2.3 Co-IP验证NS2与PRDX3的相互作用 在293T 细胞中共转染pEGFP-C1 和pCAGGS-myc-PRDX3 或pEGFP-C1-H5NS2 和pCAGGS-myc-PRDX3质粒。转染后48 h 裂解细胞,进行Co-IP 及western blot 检测。结果显示,带有EGFP 标签的H5NS2 和带有myc 标签的PRDX3 在293T 细胞中均可以表达,利用小鼠抗GFP MAb 进行免疫共沉淀后,进行western blot,可以检测到H5NS2 和PRDX3 之间的结合,但H5NS2 与EGFP 对照之间则不能够相互结合(图2),表明重组表达的H5NS2 蛋白与PRDX3 蛋白在293T 细胞中具有特异性的相互作用。

图1 酵母双杂交试验验证PRDX3 与NS2 蛋白的相互作用Fig.1 Ineraction between porcine PRDX3 and NS2 protein identified by yeast two-hybrid system
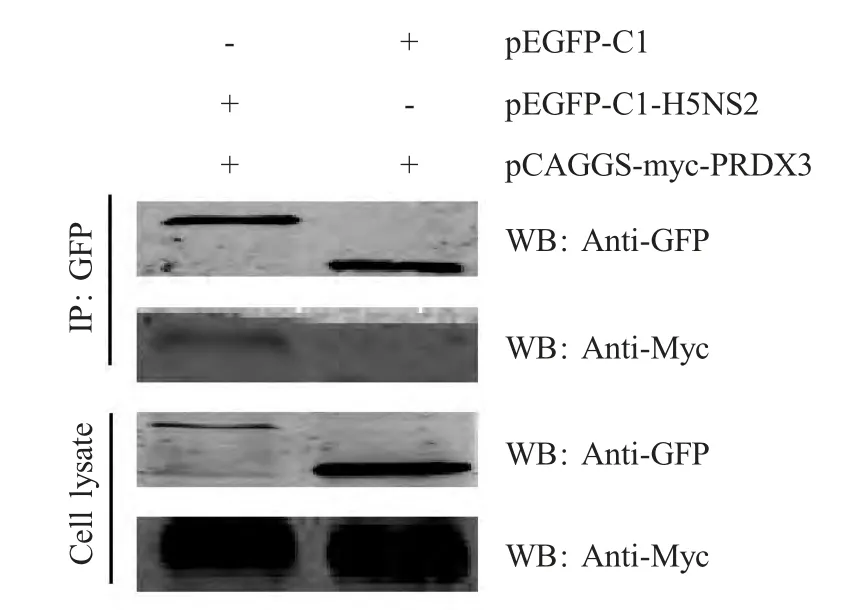
图2 Co-IP 试验验证H5NS2 和PRDX3 的相互作用Fig.2 H5NS2 interacts with PRDX3 by Co-IP assay
2.4 GST pull-down试验验证NS2和PRDX3的相互作用 为排除NS2 蛋白与PRDX3 间接相互作用,本研究进行了GST pull-down 试验。GST-H5NS2 融合表达蛋白为诱饵或者作对照的GST 蛋白与转染pCAGGS-myc-PRDX3 质粒的293T 细胞的细胞裂解液孵育,进行GST pull-down。结果表明,在各蛋白正常表达的情况下,GST-H5NS2 样品中能够检测到PRDX3 而GST 样品中则未检测到PRDX3(图3),进一步证明了NS2 蛋白与PRDX3 存在特异的,直接的相互作用。

图3 GST pull-down 试验验证H5NS2 与PRDX3 的相互作用Fig.3 H5NS2 interacts with PRDX3 by GST pull-down assay
3 讨论
Y2H 系统作为一种研究蛋白质相互作用的经典技术,已被广泛用于研究病毒蛋白与宿主蛋白之间的相互作用。该方法避免了蛋白质纯化过程,可以检测存在于蛋白质之间的微弱的或暂时的相互作用,而且适用于高通量筛选与目的蛋白相互作用的蛋白[5]。本研究采用NS2 作为“诱饵”蛋白,通过酵母双杂交系统筛选含有Calu-3、A549、THP-1 和U251 4 种细胞cDNA 文库,证明了与NS2 的相互作用蛋白PRDX3。Co-IP 试验证实NS2 和PRDX3 在293T 细胞中存在特异性的相互作用。
PRDX3 是过氧化物氧还酶蛋白家族的一员,主要定位于线粒体,调控线粒体中细胞色素c 的释放[6-7]。PRDX3 可以降低细胞内的过氧化氢含量,发挥抗细胞凋亡的作用[8-9]。流感病毒的NS2 蛋白在结构上可以分为对蛋白酶敏感的氨基端(1~53)和对蛋白酶具有抵抗性的羧基端(54~121)[10]。在NS2 蛋白的氨基端具有两个核输出信号,一个位于aa12~aa21 之间,另外一个位于aa31~aa40 之间,两个核输出信号均与CRM1 具有相互作用关系,介导vRNP 复合体输出细胞核的过程[1]。此外,NS2 蛋白还具有调控病毒基因组复制和促进病毒包装释放方面的重要作用[3-4]。本研究利用酵母双杂交系统鉴定了一种新的与流感病毒NS2 相互作用的宿主蛋白PRDX3,不仅拓展了流感病毒与宿主因子的相互作用网络,而且为进一步探索流感病毒的复制周期和致病及免疫机制奠定了基础。
[1]Paterson D,Fodor E.Emerging roles for the influenza A virus nuclear export protein(NEP)[J].PLoS Pathog,2012,8(12),e1003019.
[3]Gao Shi-juan,Wu Jiao-xianng,Liu Ran-yi,et al.Interaction of NS2 with AIMP2 facilitates the switch from ubiquitination to SUMOylation of M1 in influenza A virus-infected cells[J].J Virol,2015,89(1):300-311.
[4]Gorai T,Goto H,Noda T,et al.F1Fo-ATPase,F-type proton-translocating ATPase,at the plasma membrane is critical for efficient influenza virus budding[J].PNAS USA,2012,109(12):4615-4620.
[5]廖亚金,李素,贺番,等.猪外周血单个核细胞cDNA 酵母表达文库的构建及与猪瘟病毒E2 蛋白相互作用细胞蛋白的筛选[J].中国预防兽医学报,2013,35(9):707-710.
[6]Chae H Z,Kim H J,Kang S W,et al.Characterization of three isoforms of mammalian peroxiredoxin that reduce peroxides in the presence of thioredoxin[J].Diabetes Res Clin Pract,1999,45(2-3):101-112.
[7]Chang T S,Cho C S,Park S,et al.Peroxiredoxin Ⅲ,a mitochondrion-specific peroxidase,regulates apoptotic signaling by mitochondria[J].J Biol Chem,2004,279(40):41975-41984.
[8]Nonn L,Berggren M,Powis G.Increased expression of mitochondrial peroxiredoxin-3(thioredoxin peroxidase-2)protects cancer cells against hypoxia and drug-induced hydrogen peroxide-dependent apoptosis[J].Mol Cancer Res,2003,1(9):682-689.
[9]Chua P J,Lee E H,Yu Y,et al.Silencing the Peroxiredoxin Ⅲgene inhibits cell proliferation in breast cancer[J].Int J Oncol,2010,36(2):359-364.
[10]Akarsu H,Burmeister W P,Petosa C,et al.Crystal structure of the M1 protein-binding domain of the influenza A virus nuclear export protein(NEP/NS2)[J].EMBO J,2003,22(18):4646-4655.

