一株血鹦鹉嗜水气单胞菌的分离鉴定
钱晓宇,陈成勋,丁亦玙,毛海涛
(天津农学院 水产学院/天津市水产生态及养殖重点实验室,天津 300384)
嗜水气单胞菌(Aeromonas hydrophila)是一种典型的人兽共患病病原,可引起人类腹泻和多种水产动物的败血症。研究表明,嗜水气单胞菌是导致淡水鱼细菌性出血病的重要病原,对多种水产动物具有较强的致病性,包括斑点叉尾鮰[1]、中华鳖[2]、黄鳝[3]、团头鲂[4]等,危害性很大,给养殖业造成严重的经济损失。
血鹦鹉(Cichlasoma var.),属于淡水热带观赏鱼,色彩鲜艳且具有生长迅速、抗病力强、对温度适应性强等特点,目前鹦鹉鱼是天津地区的主要观赏鱼养殖品种。2014 年6 月,天津市宁河县众民水产养殖场血鹦鹉暴发传染病,本研究通过传统生物学鉴定方法与现代分子生物学技术相结合,对病原菌进行了鉴定分析。
1 材料和方法
1.1 主要实验材料 健康血鹦鹉和患病鱼来自天津市宁河县众民水产养殖场。DNA 快速提取试剂盒购自天根生化科技(北京)有限公司;革兰氏阴性菌鉴定卡购自生物梅里埃中国有限公司;药敏纸片购自杭州天和微生物试剂有限公司。引物合成和基因序列测定均由上海生工生物工程技术服务有限公司完成。VITEK 2 Compact 全自动微生物鉴定仪为法国梅里埃产品。
1.2 病原菌的分离和筛选 取具有典型病理症状的血鹦鹉,在无菌条件下取其肝、肾、脾、鳃丝及肌肉腐烂处进行病原菌的分离,划线接种于普通营养琼脂,32 ℃于振荡培养24 h,对分离菌进行生长情况、形态学及革兰氏染色鉴定。
1.3 生理生化试验 采用VITEK 2 Compact 全自动微生物鉴定仪和革兰氏阴性菌鉴定卡进行测定。
1.4 16S rRNA基因序列分析 以提取细菌的DNA为模板,采用引物5'-AGAGTTTGATCCTGG-3'/5'-G GTTACCTTGTTACGACTT-3',进行PCR 扩增,PCR反应条件:94 ℃4 min,94 ℃30 s、55 ℃30 s、72 ℃1 min,35 个循环;72 ℃10 min。并对PCR 产物进行测序。测序结果进行序列同源性分析,使用MEGA4.0 软件,采用邻接法构建系统发育树。
1.5 药敏试验 参照文献[5-6]方法,将新鲜培养的分离菌稀释至1×105cfu/mL,将17 种药敏纸片贴于MH 固体培养基上,32 ℃培养24 h。根据抑菌圈直径的大小判定分离菌对药物的敏感性。
1.6 pH对分离菌生长的影响 将浓度为2.2×108cfu/mL 的菌悬液以1 %接种量接种于pH 分别为3~11 的无菌营养肉汤中,32 ℃200 r/min 振动培养24 h后,测定在各pH 下菌悬液的OD600nm值。以无菌营养肉汤作为空白对照,确定最佳增殖的pH 值。
1.7 温度对分离菌生长的影响 根据1.6 结果,将浓度为2.2×108cfu/mL 的菌悬液以1 %接种量接种于最佳pH 的营养肉汤中,按4 ℃递增设定培养温度,在16 ℃~40 ℃的情况下200 r/min 振动培养24 h后,测定在各培养温度下菌悬液的OD600nm值,确定最佳培养温度。
1.8 分离菌生长曲线的测定 参照文献[7]的方法,将浓度为2.2×108cfu/mL 的菌悬液以1 %接种量接种于最佳pH 的营养肉汤中,在最佳温度条件下以200 r/min 振动培养,设定测量时间为48 h,每2 h测一次菌悬液的OD600nm值,以培养时间为横坐标,OD600nm值为纵坐标绘制细菌生长曲线。
1.9 人工感染试验 将体长8.10 cm±0.64 cm,体质量为44.41 g±4.08 g 的健康血鹦鹉置于90 cm×70 cm×45 cm 塑料水槽中暂养7 d,水温保持在25 ℃~27 ℃。每箱随机投放锦鲤10 尾。用0.65 %生理盐水洗脱菌落,稀释浓度为2.2×106cfu/mL、2.2×107cfu/mL、2.2×108cfu/mL、2.2×109cfu/mL、2.2×1010cfu/mL 和2.2×1011cfu/mL 的菌悬液,腹腔注射健康锦鲤,每尾注射0.1 mL,另设对照组注射等量生理盐水,持续观察96 h,记录死亡情况。采用寇氏法计算半致死剂量(LD50):LD50=Lg-1Xk-d{∑P-0.5}。式中:Xk为最大剂量的对数;d 为相邻两组剂量高剂量与低剂量之比的对数(即相邻两组对数剂量的差值);P 为各组死亡率,用小数表示;∑P 为各组死亡率之和[8]。
2 结果
2.1 临床症状与病理变化 自然发病鱼临床和病理变化症状主要表现为体表出血,病灶处肌肉深度腐烂,鳞片严重脱落,腹部肿大,鳃丝充血肿胀,肠道出现淡黄色积液,肝脏肿大糜烂有少量出血点。
2.2 病原菌的分离和筛选 从患病鱼症灶分离、纯化得到1 株疑似病细菌,命名为YW01。挑选健康血鹦鹉注射菌悬液YW01 及无菌生理盐水,96 h 内注射YW01 的实验鱼出现死亡,再次分离病原进行重复人工感染得到同一致病菌,从而确定该病病原菌为YW01。重新分离纯化的细菌经过24 h 培养,菌落形态呈白色或淡黄色半透明状,菌落小,圆形,中央凸起,表面光滑,菌落周围整齐。经革兰氏染色后进行观察,结果显示该菌为革兰氏阴性菌,呈杆状。
2.3 病原菌的生理生化反应 生理生化试验结果显示,该菌对侧金花盏醇、L-阿拉伯醇、D-纤维二糖、D-山梨醇、D-洛塔糖、α-葡萄糖反应呈阴性,对D-葡萄糖、葡萄糖发酵、D-麦芽糖、D-甘露醇、D-甘露糖、蔗糖、D-海藻糖反应呈阳性;对H2S、β-葡萄糖苷酶、酯酶、乳酸盐产碱、琥珀酸盐产碱、等反应呈阳性;对β-葡萄糖苷酸酶、L-苹果酸盐同化、L-乳盐酸同化、赖氨酸脱羧酶、鸟氨酸脱羧酶、氨基乙酸芳胺酶、磷酸酶、丙二酸盐、尿酸酶、L-脯氨酸芳胺酶、β-半乳糖苷酶等反应呈阴性。因此初步确定该株致病菌为嗜水气单胞菌。
2.4 16S rRNA基因序列分析 以分离菌株的DNA为模板进行PCR 扩增,结果显示,目的片段约为1 500 bp(图略)。序列分析显示,其与嗜水气单胞菌同源性为99 %,构建系统发育树如图1,进一步表明该菌为嗜水气单胞菌。
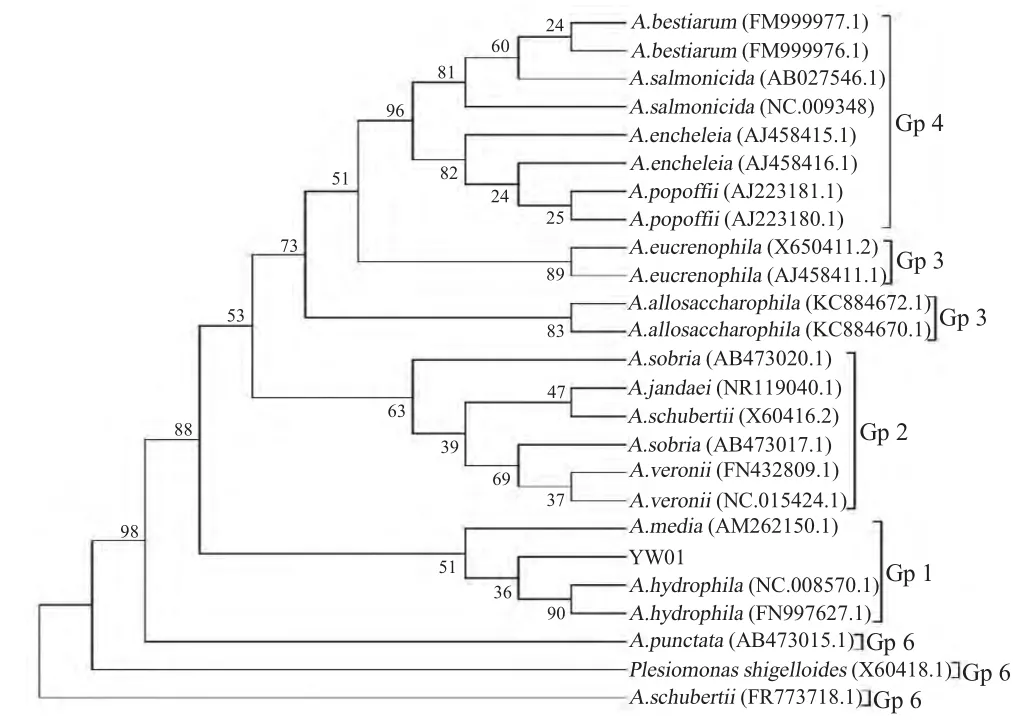
图1 YW01 的16S rRNA 聚类分析Fig.1 The cluster analysis of the isolate based on 16S rRNA
2.5 药敏试验 药敏试验结果见表1。
2.6 p H对病原菌生长的影响 经过在不同pH 下的培养显示,当培养基pH 为3~5 时,该菌株的OD600nm值变化不大;当pH 值为5~7 时,培养液的OD600nm值随着pH 的升高显著增大;在pH 值达到7~8 时,OD600nm值达到峰值;之后OD600nm值随着pH 值升高而显著减小,当pH 值达到11 时,OD600nm值最低。表明该菌株最适pH 为7~8。

表1 YW01 药敏试验(n=5)Table 1 Antibiotic sensitivity of isolate strain YW01(n=5)
2.7 温度对病原菌生长的影响 经过在不同温度下的培养显示,该菌株当培养温度为12 ℃~32 ℃时,菌株M3 的OD600nm值逐渐增大,在32 ℃达到峰值;之后,OD600nm值随着培养温度的升高而显著下降,当温度值达到40 ℃时,OD600nm值最低。表明在12 ℃~40 ℃均能生长,最适生长温度为32 ℃。图2 为病原菌在最适生长温度为32 ℃时的生长曲线。

图2 32 ℃条件下菌株YW01 的生长曲线Fig.2 The growth curve of isolate strain YW01 at 32 ℃
2.8 人工感染试验 实验结果见表2,经计算LD50=9.55×109cfu/mL,与以往研究比较[9-10],表明该分离菌株具有较低的致病性。
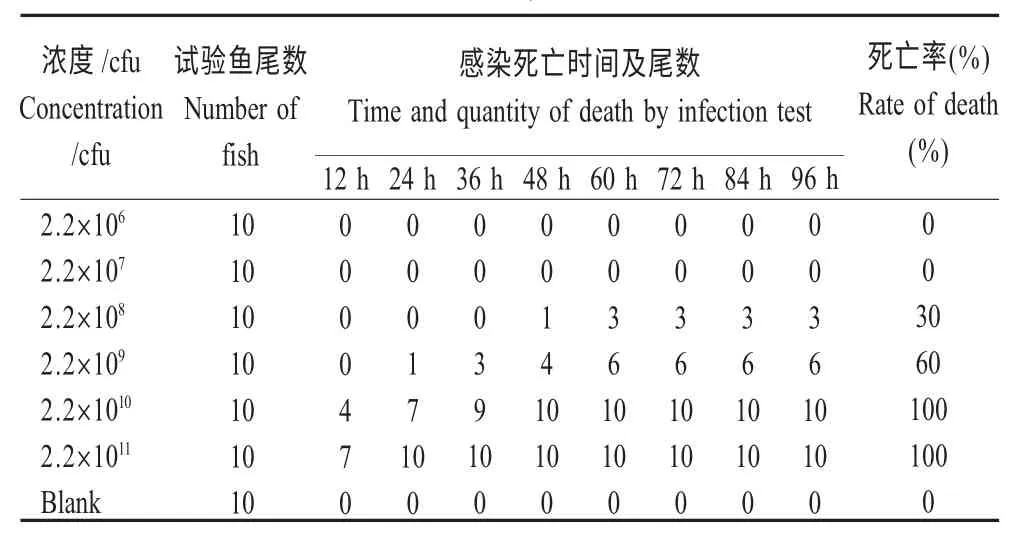
表2 YW01 菌株感染试验Table 2 Infection test by isolate strain YW01
3 讨论
嗜水气单胞菌感染淡水鱼类引起的疾病根据鱼的种类表现略有不同,例如锦鲤表现为体表及各鳍出血、鳞片脱落,大面积肌肉腐烂甚至穿孔[9],施氏鲟症状主要为体表出血、腹部肿胀、肝脾肾等器官出现出血现象[10];本研究中血鹦鹉的发病症状与嗜水气单胞菌引起的水产动物疾病症状相近。
研究发现,嗜水气单胞菌对甘露醇、葡萄糖等反应呈阳性[11],与本研究结果相同。秦国民等研究发现嗜水气单胞菌对葡萄糖、蔗糖、甘露醇、麦芽糖、脂酶等反应呈阳性,对β-丙氨酸芳胺酶等反应呈阴性[12],与本研究相同,但对组氨酸同化、乳酸盐产碱等反应结果与本研究不同。为了进一步确定YW01 的分类学地位,本研究进行了16S rRNA 基因的序列比对分析,通过构建系统进化树,YW01 与嗜水气单胞菌聚类,相应基因的同源性为99 %。因此综合以上分析确定YW01 为嗜水气单胞菌。
司力娜等在东北三省患病鲤鱼分离的嗜水气单胞菌的药敏研究中发现对多粘霉素B、诺氟沙星高度敏感,对氨苄西林、头孢拉定、林可霉素不敏感[13],与本研究结果相同,但本研究中对麦迪霉素不敏感,对红霉素、萘啶酸高度敏感与其则不同。由此可以得出即使是同一种病原菌不同的分离株抗药性也不完全相同。
对嗜水气单胞菌生物学特性的研究过程中发现病原菌的最适pH 为7~8,表明自然养殖水体中适宜嗜水气单胞菌的生长;最适生长温度出现在32 ℃,表明该病原菌在夏季水温相对较高时生长代谢旺盛,而在温度较低时生长缓慢,提醒养殖户在饲养观赏鱼类的过程中,水温上升时应当注意该类细菌病的防范。此外通过细菌生长曲线确定该分离菌的最佳培养时间为10 h~22 h,推测该分离菌为急性感染菌类,潜伏期较短。嗜水气单胞菌对西伯利亚鲟的LD50为5.62×105cfu/mL[14],对斑鳢的LD50为6.83×105cfu/mL[15]。本研究中分离菌YW01 对血鹦鹉鱼的LD50为9.55×109cfu/mL,明显比上述实验结果低,表明该分离株的致病力相对较低。
本研究为嗜水气单胞菌引起传染病的防治提供了实验依据。
[1]艾晓辉,丁运敏,汪开毓,等.在斑点叉尾鮰血清中强力霉素对嗜水气单胞菌药动-药效模型研究[J].水生生物学报,2011,6:893-899.
[2]罗方兴,毛盼,王荣华,等.中华鳖腐皮病的病原鉴定与药敏试验[J].水生态学杂志,2013,34(3):85-89.
[3]陈晓利,彭彬,占爱思,等.黄鳝源嗜水气单胞菌的体外中药药敏试验[J].淡水渔业,2014,44(2):43-46.
[4]夏飞.团头鲂源嗜水气单胞菌分离鉴定、检测及缘色荧光蛋白标记菌株的构建[D].南京:南京农业大学,2012.
[5]Song Xue-hong,Zhao Jie,Bo Yun-xuan,et al.Aeromonas hydrophila induces intestinal inflammation in grass carp(Ctenopharyngodon idella):An experimental model[J].Aquaculture,2014,434:171-178.
[6]杨宁,黄海,张希,等.尼罗罗非鱼嗜水气单胞菌病的病原分离鉴定和药敏实验[J].水产科学,2014,05:306-310.
[7]秦国民,张晓君,陈翠珍,等.鲤嗜水气单胞菌感染症及其病原生物学特性[J].水生态学杂志,2008,02:53-57.
[8]李翠萍,吴民耀,王宏元.3 种半数致死浓度计算方法之比较[J].动物医学进展,2012,09:89-92.
[9]李梅,刘文利,黄树涛,等.锦鲤嗜水气单胞菌的分离鉴定及生物学特性研究[J].中国预防兽医学报,2010,32(8):591-594.
[10]孟彦,肖汉斌,张林,等.施氏鲟出血性败血症病原菌的分离鉴定[J].华中农业大学学报,2007,26(6):822-826.
[11]李焕荣,崔德凤,张耳,等.锦鲤致病性嗜水气单胞菌分离和药敏实验[J].中国预防兽医学报,2002,24(3):205-208.
[12]秦国民,张晓君,陈翠珍,等.锦鲤维氏气单胞菌感染症及其病原生物学特性研究[J].安徽农业科学,2008,36(19):8115-8117.
[13]司力娜,李绍戊,王荻,等.东北三省15 株致病菌性嗜水气单胞菌分离株的药敏实验分析[J].江西农业大学学报,2011,33(4):786-790.
[14]李圆圆,曹海鹏,何珊,等.鲟源致病性嗜水气单胞菌X1的分离鉴定与药敏特性研究[J].微生物学通报,2008,35(8):1186-1191.
[15]陈言峰,马文山,陈文慧,等.斑鳢嗜水气单胞菌病病原的鉴定及其病理组织学的研究[J].大连海洋大学学报,2011,6:514-520.

