鱼类鳗弧菌赖解旋酶基因扩增技术的建立
梁君妮,尹伟力,刘 宁,许红岩
(烟台出入境检验检疫局,山东 烟台 264000)
弧菌广泛分布于淡水环境和海水环境,许多研究表明,有多种弧菌是鱼类的重要条件性病原菌,主要包括鳗弧菌、灿烂弧菌、创伤弧菌、溶藻胶弧菌和哈维氏弧菌等[1]。其中鳗弧菌引起的疾病最为严重,在世界范围流行。鳗弧菌也是我国海水养殖鱼类重要的条件致病菌。李清禄等从网箱养殖发病的大黄鱼体内分离到2 株鳗弧菌[2]。肖慧等从发生烂鳃、烂尾病的鲈鱼体内分离到鳗弧菌[3]。莫照兰等从患病的牙鲆体内分离到一株鳗弧菌[4]。研究表明分离出的鳗弧菌均具有致病性。
赖解旋酶DNA 恒温扩增技术(Helicase-dependent isothermal DNA amplification,HDA)是模拟自然界生物体内DNA 复制的自然过程,在恒温条件下利用解旋酶解开DNA 双链,同时DNA 单链结合蛋白(SSB)稳定解开的单链,为引物提供结合模板,由DNA 聚合酶催化合成互补链。新合成的双链在解旋酶的作用下又解成单链,并作为下一轮合成的模板进入上述的循环扩增反应,最终实现靶序列的指数式增长[5-6]。HDA 技术操作简单,具有良好的应用前景,特别适用于现场诊断产品的开发,目前已应用于一些病原菌的检测。本实验选取鳗弧菌的toxR 基因作为检测靶基因,设计特异性引物,建立快速检测鳗弧菌的HDA 新方法。
1 材料和方法
1.1 菌株及临床样品 实验所用的标准菌株购自美国典型菌种保藏中心;分离菌株由本实验室分离鉴定并保存,共计16 株(表1)。所有菌株均保存在含15 %甘油缓冲液的保种管中,-80 ℃冰箱保存。所用的临床样品均购自市场。
表1 实验用标准菌株和分离菌株Table 1 Standard and isolated strains for experiment
1.2 主要试剂 TINAamp Bacteria DNA Kit 细菌基因组DNA 提取试剂盒购自Promega 公司;DNA Marker、Bst polymerase 和MutL protein 购自宝生物工程(大连)有限公司;腺嘌呤核苷三磷酸(ATP)、dNTPs、大肠杆菌UvrD 解旋酶、海藻糖购自上海富众生物科学有限公司;T4 噬菌体基因32 编码蛋白(T4 gp32)购自New England 公司;细菌基因组DNA提取试剂盒购自生工生物工程(上海)有限公司。
1.3 引物设计与合成 根据NCBI 中登录的鳗弧菌的toxR 基因序列,经B1ast 比对,采用Primer Premier 5.0 软件设计一对特异性扩增引物:P1:5'-AA CGAGCCTGAAGAGGAA-3'/P2:5'-AACGAGCCTGA AGAGGAA-3'。预期扩增片段为98 bp,引物由宝生物工程(大连)有限公司合成。
1.4 实验菌株基因组DNA的提取 按传统培养方法分别增菌培养表1 中实验菌株。分别取实验菌株的细菌培养液1 mL,根据细菌基因组DNA 提取试剂盒说明书方法提取细菌DNA,保存于-20 ℃备用。
1.5 细菌16S rDNA的PCR扩增 选用细菌的16S rDNA 基因片段的通用引物(F:5'-CCTACGGGA GGCAGCAG-3'/R:5'-ATTACCGCGGCTGCTGG-3')对提取的不同菌株DNA 进行PCR 扩增。预期扩增片段为250 bp。
1.6 HDA反应体系的建立 反应体系为50 μL,采用两步法反应:反应液I:2 μL 模板DNA,20 pmol引物,ddH2O 补至25 μL。反应液Ⅱ:5 μL 10×buffer B[350 mM Tris-HAc(pH7.5)、100 mM 二硫苏糖醇、1 mg/mL BSA、100 mM MgSO4],150 nmol ATP,20 nmol dNTPs,5 U Bst ploymerase,100 ng大肠杆菌UvrD 解旋酶,600 ng MutL protein,4.5 μg T4 gp32,25 μM 海藻糖,用ddH2O 补至25 μL。
反应液I 在95 ℃中水浴5 min,55 ℃水浴退火3 min,将反应液Ⅱ加入反应液I 混匀,置65 ℃恒温扩增90 min。产物经2.0 %琼脂糖凝胶电泳检测。
1.7 HDA特异性试验 采用已建立的HDA 方法对表1 中所列的鳗弧菌等实验菌株DNA 按照1.6 HDA 扩增条件进行扩增,琼脂糖凝胶电泳检测。
1.8 HDA灵敏度试验
1.8.1 标准菌株灵敏度检测试验 利用分光光度计检测鳗弧菌标准菌株ATCC45843 的DNA 浓度,TE缓冲液进行10 倍梯度稀释,对各个稀释度样品进行HDA 扩增,经2.0 %琼脂糖凝胶电泳检测,确定灵敏度。
1.8.2 人工污染模拟样品灵敏度检测试验 将鳗弧菌标准菌株ATCC45843 的培养液用TE 缓冲液进行10 倍梯度稀释,对各个稀释度进行平板计数(36.5 ℃培养48 h 后计数),同时将稀释液分别接种到含10 g碎鱼肉中,28 ℃培养24 h 后提取DNA 进行HDA扩增,产物经2.0 %琼脂糖凝胶电泳检测,确定灵敏度。
1.8.3 HDA 方法与普通PCR 方法敏感性比较试验利用建立的HDA 方法与普通PCR 对1.8.1 和1.8.2中鳗弧菌的DNA 各稀释度样品进行检测,采取相同反应体积和引物,产物经琼脂糖凝胶电泳检测,比较两种方法的敏感性。
1.9 临床样品鳗弧菌的检测 利用已建立的HDA方法和PCR 方法对120 份鱼类样品进行检测。称取120 份鱼类样品各10 g,加入90 mL 培养基,匀浆,28 ℃培养24 h,提取DNA,进行HDA 和PCR 扩增,产物经2.0 %琼脂糖凝胶电泳检测,比较两种方法的符合率,并与普通细菌培养法进行比较。
2 结果
2.1 细菌16S rDNA基因的PCR扩增 采用细菌16S rDNA 基因通用引物对所有菌株的DNA 进行PCR 扩增,结果表明提取得到所有的菌株DNA,完全符合实验要求(图1)。
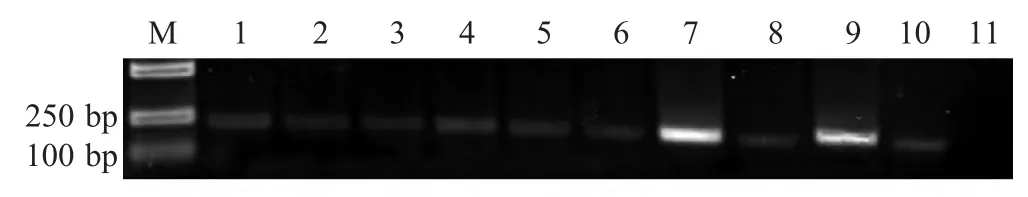
图1 所有菌株通用引物PCR 扩增结果Fig.1 The amplification of 16S rDNA fragment from all tested bacteria with universal primers
2.2 特异性试验 利用建立的HDA 对所有实验菌株DNA 进行扩增,结果显示仅对鳗弧菌标准株及分离株的扩增结果呈阳性,在约100 bp 处出现明显的DNA 扩增片段(图2),其余菌株的扩增结果均为阴性。表明该HDA 方法对于鳗弧菌具有良好的特异性。
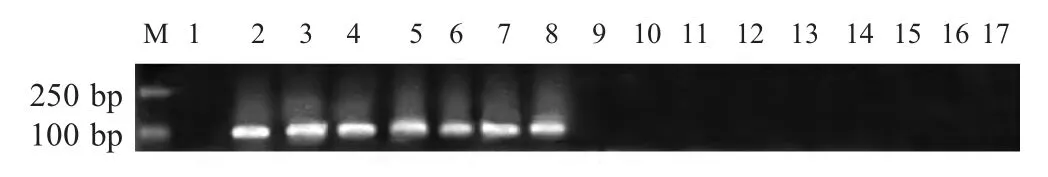
图2 HDA 方法检测鳗弧菌的特异性Fig.2 The specific test of the HDA for V.anguillarum detection
2.3 灵敏度试验
2.3.1 标准菌株检测灵敏度试验 鳗弧菌标准菌株原液提取的DNA 经分光光度计检测为30 μg/mL,利用建立的HDA 方法和普通的PCR 方法扩增不同稀释度的鳗弧菌标准菌株的DNA,结果显示,两种方法的最低检出量均为30 ng/mL(图3)。

图3 标准菌株HDA 方法(A)和PCR 方法(B)的敏感性试验Fig.3 Sensitivity tests of HDA(A)and PCR(B)on standard strains
2.3.2 人工污染模拟样品检测灵敏度试验 将鳗弧菌标准菌株10 倍梯度稀释后计数,各梯度菌悬液含菌量分别为:2.1×106cfu/mL、2.1×105cfu/mL、2.1×104cfu/mL、2.1×103cfu/mL、2.1×102cfu/mL、2.1×101cfu/mL、2.1×100cfu/mL。利用建立的HDA 方法和普通的PCR 方法对各浓度梯度的人工污染的模拟样品DNA 进行扩增,结果显示,两种方法对样品添加菌的最低检出限均为2.1×102cfu/mL。
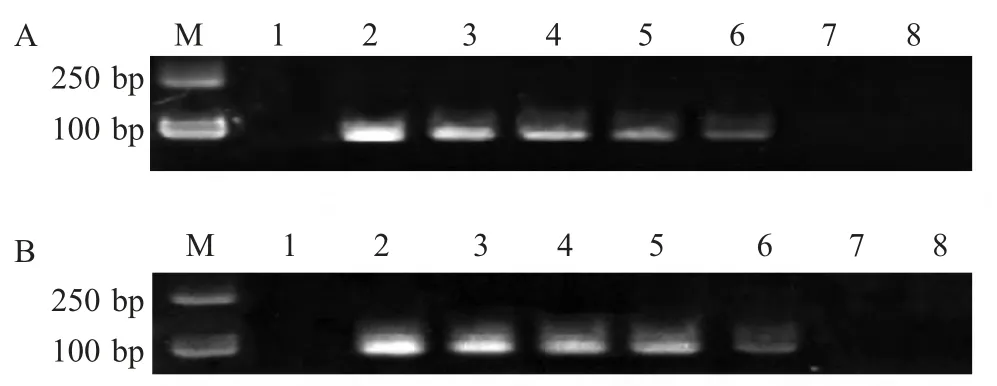
图4 人工污染样品HDA 方法(A)和PCR 方法(B)的敏感性试验Fig.4 Sensitivity tests of HDA(A)and PCR(B)about artificially strains
2.4 临床样品鳗弧菌的检测 利用建立的HDA法、普通PCR 法和细菌培养法对从市场上采购的40 种共120 份鱼类样品(每种类取3 份样品)进行检测,结果显示,细菌培养法检出阳性率为10.8 %(13/120);HDA 方法和普通PCR 检测的阳性率均为20.8 %(25/120),两者符合率为100 %,并且检出率均远高于细菌培养法。
3 讨论
HDA技术作为一种新型的核酸恒温扩增技术,不仅引物设计简单、灵敏特异而且操作简便,仅需要恒温水浴槽就能进行反应,几乎融汇了PCR 法和LAMP 方法的优点。王建广等利用HDA 法对沙门氏菌进行了检测,最低检测限为460 pg/反应,与普通PCR 相当[7];石琰璟等通过HDA 法对副溶血性弧菌进行了检测,最低检测限为19.9 ng/mL,与普通PCR 相当[8]。美国NEB 公司已经开发出一系列基于HDA 技术的反应试剂盒,展现出良好的应用前景[9]。
toxR 基因广泛分布于弧菌中。庞玲玲建立了利用toxR 鉴定哈氏弧菌的PCR 方法[10],Bauer 和RorviK 利用toxR 基因设计了通用引物进行副溶血弧菌、创伤弧菌和霍乱弧菌的同步PCR(mPCR)检测[11],许拉等利用toxR 基因建立了同时检测4 种弧菌和两种病毒的mPCR 方法[12],而Neogi 等利用toxR 和vvhA 两个基因建立了检测霍乱弧菌、副溶血弧菌和创伤弧菌的mPCR 体系[13],并对环境样品进行了检测。因此,本研究也采用鳗弧菌的toxR 基因作为检测靶基因,自行设计特异性引物,建立了快速检测鳗弧菌的HDA 检测方法。
为验证本研究建立的HDA 方法的特异性,对实验室分离的6 株阳性菌株进行了检测,检测结果均为阳性,并对120 份鱼类样品进行检测,阳性检出样品25 个。为了保证所建方法的灵敏度,以建立的HDA 检测方法与普通的细菌培养法及PCR 检测方法进行了对比,结果显示,HDA 方法检出率与PCR 方法一致,高于传统的细菌培养法。本研究建立的HDA 检测方法有望成为鱼类细菌病的日常检测手段。
[1]杨少丽,王印庚,董树刚,等.海水养殖鱼类弧菌病的研究进展[J].海洋水产研究,2005,26(4):75-83.
[2]李清禄,陈强.海水网箱养殖大黄鱼细菌性病原鉴定与感染治疗研究[J].应用与环境生物学报,2001,7(5):489-493.
[3]肖慧,李军,徐怀恕,等.鲈鱼苗烂鳃、烂尾病病原菌的研究[J].青岛海洋大学学报,1999,29(1):87-93.
[4]莫照兰,茅云翔,张培军,等.一株牙鲆皮肤溃烂症病原菌的鉴定[J].微生物学报,2002,42(3):263-269.
[5]Vincent M,Xu Yan,Kong Hui-min.Helicase-dependent isothermal DNA amplification[J].EMBO Rep,2004,5(8):785-800.
[6]刘洵,程天印,常小斌,等.赖解旋酶恒温基因扩增技术的原理、应用和展望[J].长沙大学学报,2007,21(2):29-31.
[7]王建广,姜英辉,雷志文,等.应用依赖解旋酶DNA 恒温扩增技术检测沙门氏菌的研究[J].中国卫生检验杂志,2010,20(12):3289-3231.
[8]石琰璟,王建广,房保海,等.应用依赖解旋酶DNA 恒温扩增技术检测副溶血性弧菌[J].青岛科技大学学报,2011,32(1):42-45.
[9]Miller V L,Mekalanos J J.A novel suicide vector and its use in construction of insertion mutations:osmoregulation of outer membrane proteins and virulence determinants in Vibrio cholerae requires toxR[J].J Bacteriol,1988,170(6):2575-2583.
[10]庞玲玲.哈维氏弧菌毒力相关基因的筛查及快速检测技术研究[D].青岛:中国海洋大学,2007.
[11]Bauer A,Rvik L M.A novel multiplex PCR for the identification of Vibrio parahaemolyticus,Vibrio cholerae and Vibrio vulnificus[J].Lett Appl Microbiol,2007,45(4):371-375.
[12]许拉,黄倢,戈蕾,等.同时检测两种对虾病毒和4 种弧菌的同步PCR 方法的建立[J].海洋水产研究,2008,29(4):39-45.
[13]Neogi S B,Chowdhury N,Asakura M,et al.A highly sensitive andspecific multiplex PCR assay for simultaneous detection of Vibrio cholerae,Vibrio parahaemolyticus and Vibrio vulnificus[J].Lett Appl Microbiol,2010,51(3):293-300.

