鞭毛蛋白及鸡GM-CSF重组新城疫病毒对鸡的免疫增强作用
王 卉,张天援,吕 政,孙 田,尹杰超,吴云舟,刘云野,吴 金,任桂萍,李德山
(1.东北农业大学 生命科学学院/生物制药教研室,黑龙江 哈尔滨 150030;2.吉林和元生物工程有限公司,吉林 吉林 132000)
新城疫(Newcastle disease,ND)是由ND 病毒(NDV)引起的一种高接触性、致死性的急性败血性的禽类重大烈性传染病[1]。目前,预防该病主要措施是使用灭活油佐剂疫苗接种,但该类疫苗接种后约15 d 才能产生有效保护抗体。因此,研制能够诱导机体快速产生ND 免疫保护的新型疫苗已成为NDV 防制中亟待解决的问题。
针对鞭毛蛋白(FliC)与粒细胞-巨噬细胞集落刺激因子(Granulocyte-Microphage colony stimulating factor,GM-CSF)作为佐剂的研究国内外已有报道[2]。本实验以NDV 弱毒株rClone30 为载体,将鼠伤寒沙门氏菌(Salmonella typhimurium)Ⅰ的fliC 基因和鸡GM-CSF(chGM-CSF)基因分别插入pBrClone30 的F与HN 之间,利用反向遗传操作技术拯救重组NDV,并通过免疫试验评价FliC 和chGM-CSF 作为佐剂对NDV 疫苗疫应答的增强作用,为进一步研究佐剂疫苗提供了实验依据。
1 材料和方法
1.1 病毒株、重组质粒、细胞株和实验动物NDV LaSota rClone30 毒株、NDV pBrClone30 感染性质粒、pBrTM1-NP、pBrTM1-P、pBrTM1-L 辅助质粒以及S.typhimurium SGSC3029 株、感受态E.coli DH5α 株、感受态STBL-2 株、BHK-21 细胞、鸡胚成纤维细胞DF-1 均由本实验室保存;NDV BJ 强毒株购自吉林和元生物工程有限公司;chGM-CSF 基因序列由南京金斯瑞生物技术有限公司合成;9~11 日龄SPF 级鸡胚、鸡血及鸡抗NDV 血清均购自中国农业科学院哈尔滨兽医研究实验动物中心。
1.2 主要试剂 dNTP Mixture、Oligo(dT)18、DNA Marker、T4 DNA 连接酶、pMD18-T 载体、限制性内切酶、r Taq DNA 聚合酶均购自TaKaRa 公司;DNA 凝胶回收试剂盒购自Axygen 公司;质粒提取试剂盒购自Tiangen 公司;PCR 产物纯化试剂盒购自OMEGA 公司;转染试剂Lipofectmine 2000 购自Invitrogen 公司。
1.3 目的基因的克隆和鉴定 利用酚氯仿抽提法提取S.typhimurium 全基因组为模板进行PCR 扩增fliC。fliC 上游引物:5'-GTTAACGCCACCATGGCC TGGGCTCCTCTCCT-3',下游引物:5'-ACGCGTCG GTTAACGCAGTAAAGAGAGGACG-3'。预期fliC 目的片段约1 500 bp,将扩增的fliC 基因片段克隆于pMD18-T 载体中,由Invitrogen 公司进行测序。并将fliC 和chGM-CSF 目的基因分别插入pBrClone30,构建重组质粒pBrClone30-fliC 和pBrClone-chGMCSF(图1)。
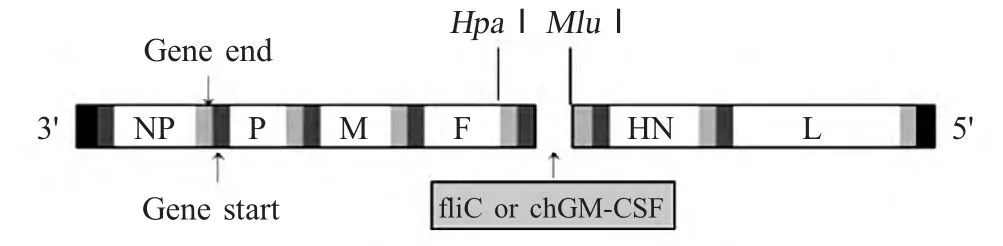
图1 重组NDV 基因组cDNA 质粒的构建Fig.1 The construction of recombinant NDV genomic cDNA
1.4 重组质粒rClone30-fliC和rClone30-GM-CSF的病毒拯救与RT-PCR鉴定 参照Lipofectamine 2000 使用说明书,分别将辅助质粒pBrTM1-NP、pBrTM1-P、pBrTM1-L、重组质粒pBrClone30-fliC 以及pBrClone30-GM-CSF 共转染60 %~80 % 融合的BHK-21 细胞单层中。培养72 h 后裂解细胞,离心并收集上清液,以200 μL/只接种9 日龄SPF 鸡胚尿囊腔。继续培养72 h 后收集尿囊液,进行NDV血凝(HA)和血凝抑制(HI)检测。将结果呈阳性的尿囊液-80 ℃保存备用。
采用TRIzol 法提取阳性尿囊液中重组NDV 的RNA,采用上游引物5'-TTAAGAAAAAATACGGGT AG-3' 和下游引物5'-TCTCTGAAGGCCTCTCAGG C-3' 分别进行RT-PCR 鉴定(带有部分NDV 基因组序列),对所扩增的PCR 产物进行测序分析。
1.5 ELISA检测重组NDV外源基因的表达 以0.1 MOI 的重组rClone30-fliC、rClone30-GM-CSF 以及空载体病毒rClone30 分别感染DF-1 细胞。感染48 h 后收集细胞液上清液,以DMEM 培养基作为调零对照,Mock 对照组为不加病毒的DF-1 细胞,按FliC 单抗和鸡GM-CSF ELISA 试剂盒说明书步骤操作,检测重组NDV 外源基因的表达。
1.6 重组NDV细胞增殖稳定性检测 将重组病毒rClone30-fliC、rClone30-GM-CSF 和rClone30 按0.01 MOI 感染DF-1 细胞,CO2培养箱中37 ℃培养,分别收获24 h、48 h、72 h、96 h 细胞液上清液,测定TCID50。
1.7 重组NDV HI抗体效价检测 将30 日龄SPF鸡随机分为4 组,每组10 只。rClone30、rClone30-fliC 与rClone30-GM-CSF 分别以105TCID50/0.1 mL 通过滴鼻点眼方式免疫,剂量为200 μL/只,空白组为相同剂量的0.9 %生理盐水。免疫后7 d、14 d、21 d 每组随机选取5 只并分别翅静脉采血分离血清,按常规方法检测NDV HI 抗体效价。
1.8 动物免疫效力试验 将30 日龄SPF 鸡随机分为4 组,每组10 只。分组和免疫方式同实验1.7。免疫后7 d,选用NDV 强毒BJ 株,以104ELD50/0.1 mL 经肌肉注射分别对实验鸡进行攻毒,观察并统计各组发病与死亡情况。攻毒前,对各组实验鸡采血分离血清,检测NDV HI 抗体效价。
2 结果
2.1 目的基因的克隆与鉴定 以S.typhi DNA 和pUC57-GM-CSF 质粒为模板,通过PCR 扩增fliC 基因片段,大小与预期结果相符(图2)。测序结果显示fliC 片段和chGM-CSF 片段大小分别为1 488 bp和435 bp,与预期结果一致。
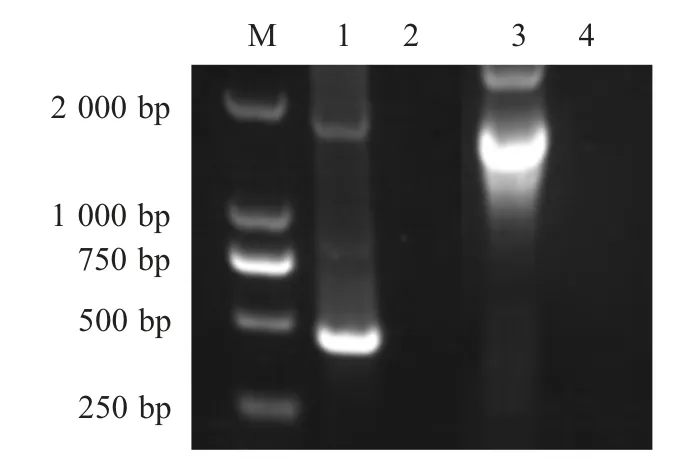
图2 chGM-CSF 和fliC 基因的PCR 扩增Fig.2 Amplification of chGM-CSF and fliC gene by PCR
2.2 重组NDV rClone30-fliC和rClone30-GM-CSF的拯救与RT-PCR鉴定 rClone30-fliC 和rClone30-GM-CSF 通过反向遗传操作系统拯救出具有感染性的病毒粒子。HA 试验和HI 试验分析呈现阳性,不同鸡胚的HA 效价介于29~211。收获的阳性尿囊液作为重组NDV 的F1 代。
采用RT-PCR 扩增fliC 和chGM-CSF 目的片段,大小与预期相符。将扩增后的目的基因序列结果进行比对,结果一致,表明通fliC 与chGM-CSF 片段分别正确插入rClone30 载体。
2.3 重组NDV细胞增殖稳定性检测 分别收获24 h、48 h、72 h、96 h 细胞上清液,计算TICD50。结果显示,重组病毒rClone30-fliC、rClone-GM-CSF均与rClone30 亲本株保持相似滴度(图3)。
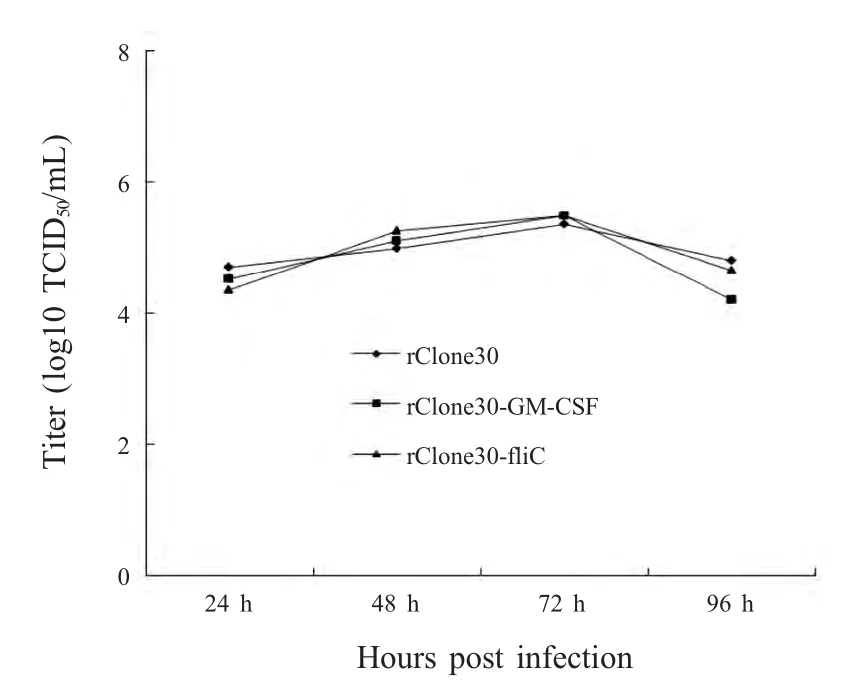
图3 rClone30,rClone30-GM-CSF 和rClone30-fliC在DF-1 细胞中增殖曲线Fig.3 Growth curves of rClone30,rClone30-GM-CSF and rClone30-fliC in DF-1 cells
2.4 ELISA检测重组病毒外源基因表达 rClone30-fliC 和rClone30-GM-CSF 尿囊液以0.1 MOI 感染60%~80 %单层DF-1 细胞,48 h 后进行ELISA 检测FliC 和chGM-CSF 蛋白表达量。结果显示FliC 和chGM-CSF 的蛋白表达量明显高于rClone30 组,表明重组病毒在细胞水平上能够表达外源基因(图4)。
图4 重组病毒中chGM-CSF(A)和FliC(B)的蛋白表达量Fig.4 Expression of chGM-CSF and FliC in the recombinant NDV
2.5 免疫后血清抗体效价的测定 免疫7 d、14 d、21 d 后,各组随机选取5 只进行采血并分离血清,按照常规方法测定血清中NDV HI 抗体效价。结果显示,免疫7 d 后,rClone30-GM-CSF 组HI 抗体效价达到25.2,rClone30-fliC 达到24.5,均明显高于rClone30 组的23;免疫14 d 后各组均达到峰值,其中rClone30-fliC 组和rClone30-GM-CSF 组HI 抗体效价分别为27和26.6,而rClone30 组达到25.9,差异不显著;免疫21 d 后各组HI 抗体效价均有下降,但rClone30-GM-CSF 组、rClone30-fliC 组仍然高于rClone30 组(图5)。
2.6 动物免疫效力试验 实验组免疫7 d 后攻毒,结果显示,攻毒后4 d 空白组实验鸡均死亡;攻毒后6 d,rClone30 组有两只发病,但无死亡。rClone30-fliC 组和rClone30-GM-CSF 组均无临床症状和死亡。表明rClone30-fliC 组和rClone30-GM-CSF组在免疫后7 d 就可使机体产生有效的保护性抗体(表1)。
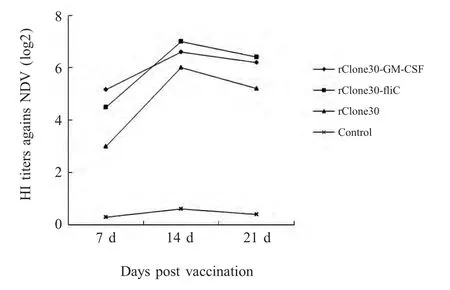
图5 血清中NDV HI 抗体效价水平Fig.5 Level of serum antibody against NDV
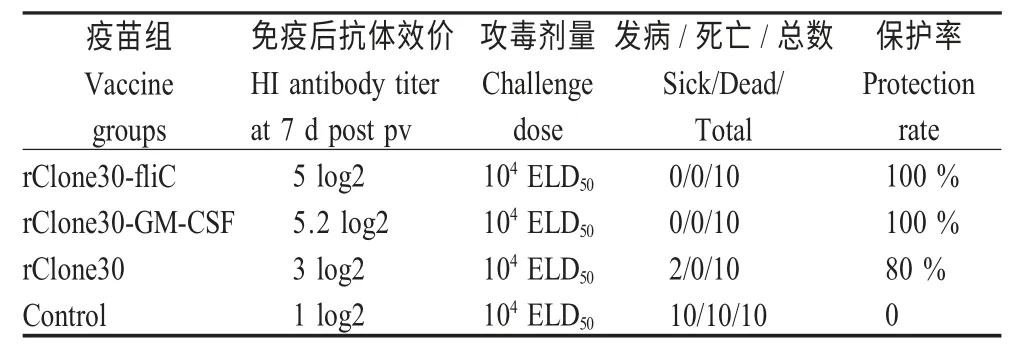
表1 交叉试验结果Table 1 Crossing test of the experimental results
3 讨论
研究表明重组GM-CSF 通过树突状细胞增强抗原提呈能力,从而增强动物对抗原的免疫应答[3]。Dranoff 等首次将GM-CSF 作为免疫佐剂,增强了抗肿瘤疫苗的免疫反应,因此GM-CSF 被大量用作疫苗佐剂,以弥补疫苗的缺陷[4]。鞭毛蛋白可以通过表达在细胞表面的TLR5,调控一系列促炎细胞因子的合成[5]。同时激活抗原提呈细胞,从而聚集、激活和分化T 辅助细胞[6],最终启动获得免疫应答。因此,鞭毛蛋白通过与TLR5 的相互作用,可以发挥其免疫佐剂作用,显著增强体液免疫应答和细胞免疫应答水平。
本实验利用GM-CSF 与鞭毛蛋白可增强免疫应答水平的特点,将chGM-CSF、fliC 片段分别插入NDV,拯救获得重组NDV。本实验对两种重组病毒免疫SPF 雏鸡后收集血清进行了HI 检测,结果表明,SPF 雏鸡在免疫后7 d,rClone30-GM-CSF 和rClone30-fliC 免疫组的HI 值基本持平,较rClone30组和空白组均有显著提高。但HI 抗体效价只是一种检测鸡体免疫状态的方式,并不能保证鸡群能够完全抵抗强毒的攻击。因此,攻毒是检测疫苗是否能起到对鸡保护作用的重要手段。本实验表明,rClone30-GM-CSF 组和rClone30-fliC 组保护率均为100 %,而rClone30 组发现两例发病。结果表明FliC 和chGM-CSF 作为佐剂能够增强NDV 免疫,使机体在7 d 就产生有效的NDV 抗体,提前于传统油佐剂灭活疫苗。
GM-CSF 与鞭毛蛋白作为佐剂,在国内外均有报道,通常是与DNA 疫苗的抗原共表达,以此提高DNA 疫苗的效应[7]。本研究首次尝试将鸡GM-CSF 片段以及鞭毛蛋白fliC 片段分别与NDV 进行重组,构建重组活载体疫苗,省去表达和纯化过程。同时,这类疫苗能够增强早期免疫的效果,弥补灭活苗和弱毒苗抗体产生时间过长的缺点,为今后进一步开展新型疫苗的研究工作提供了实验依据。
[1]Yonekur K,Yonekura S M,Namba K.Complete atomic model of the bacterial flagellar filament by electron cryomicroscopoy[J].Nature,2003,424(6949):643-650.
[2]Huleatt J W,Jacobs A R,Tang J,et al.Vaccination with recombinant fusion proteins incorporating Toll-like receptor ligands induces rapid cellular and humoral immunity[J].Vaccine,2007,25,763-775.
[3]Caux C,Dezutter-Dambuyant C,Schmitt D,et al.GM-CSF and TNF-α cooperate in the generation of dendritic Langerhans cell[J].Nature,1992,360:258.
[4]Dranoff G,Jaffee E,Lazenby A,et al.Vaccination with irradiated tumor cells engineered to secrete murine granulocyte-macrophage colony-stimulating factor stimulates potent,specific,and long-lasting anti-tumor immunity[J].Proc Natl Acad Sci USA,1993,90(8):3539-3543.
[5]Aderem A,Ulecitch R J.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406:782-787.
[6]Sanders C J,Yu Y,Moore D A,et al.Humoral immune response to flagellin requires T cells and activation of innate immunity[J].Immunol,2006,177:2810-2818.
[7]Aguilar J C,Rodriguez E G.Vaccine adjuvants revisited[J].Vaccine,2007,25(19):3752-3762.

