一株致病性血清2型猪链球菌的多位点序列分型及其灭活后对小鼠的免疫保护效果评价
高明明,王淑杰,金家民,刘永刚,陶 冶,李爱东,张 璐,李 莉,姜成刚,王 刚,申 红*,蔡雪辉*
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物疫病诊断及技术服务中心,黑龙江 哈尔滨 150001;3.动物用生物制品国家工程研究中心,黑龙江 哈尔滨 150001)
猪链球菌(Streptococcus suis)为革兰氏阳性球菌,是一种重要的人畜共患病病原菌,为猪传染病主要的病原之一,可引起关节炎、脑膜炎、败血症等[1]。本研究使用多位点序列分型(Multi-locus sequence typing,MLST)方法进行分型分析,该技术基于核酸序列测定,通过对不同管家基因的分型来确定最终的序列分型。这种方法可以准确地记录细菌基因水平上的变异,并且该方法已成为近年来发展迅速的微生物分型方法[2]。疫苗是预防和控制传染病的有效方法之一,目前对于S.suis 全菌疫苗的研究主要集中在血清2 型上[3],但对于每个疫苗候选分子都寄希望能具有更广泛的保护效果,不仅可以对同源菌株有保护性,对其它血清型也同样有保护效果,因此本研究使用3 种血清型的S.suis 分别攻毒,评价一株血清2 型S.suis 分离株灭活疫苗的保护效果,为S.suis 高效疫苗的研制提供依据。
1 材料和方法
1.1 主要实验材料及实验动物 S.suis 7 WH 及S.suis 9 ZD 由中国农业科学院哈尔滨兽医研究所动物疫病诊断中心分离鉴定;Todd-Hewitt Broth(THB)培养基、弗氏佐剂、山羊抗鼠IgG-HRP 均购自美国Sigma-Aldrich 公司;细菌基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司;耐热性r Taq DNA聚合酶、dNTP、DNA Maker 均购自TaKaRa 公司;48 只6 周龄SPF 级ICR 雌性小鼠,购自哈尔滨兽医研究所实验动物中心;引物合成及测序由北京华大基因研究中心完成(表1)。
1.2 病原的分离鉴定 将无菌采集的12 份广东地区送检病料组织样品划线接种于血平板培养基上,于37 ℃培养18 h。用常规方法进行革兰氏染色镜检;并用API 20 STREP 链球菌鉴定系统进行生化鉴定;PCR 方法对分离株进行S.suis 的保守基因gdh以及cps1、cps2、cps7 和cps9 4 个血清型分型鉴定。分离菌株命名为GD。
1.3 分离菌株毒力因子鉴定 PCR 方法检测分离菌株的溶菌酶释放蛋白(Mrp)、胞外蛋白因子(Ef)和溶血素(Sly)3 种毒力因子。
1.4 GD的MLST分型分析 按照Samantha J.King方法分别对GD 分离株7 个看家基因aroA,gki,dpr,mutS,recA,thrA,cpn60 进行扩增,并将看家基因的序列片段上传至MLST 数据库以确定菌株的序列型。
1.5 免疫保护试验 48 只6 周龄ICR 雌性小鼠,随机分为6 组,每组8 只,分别在0 d、14 d 和28 d对3 组小鼠以3×108cfu 的剂量皮下注射免疫GD 灭活菌,首免使用弗氏完全佐剂乳化,以后使用弗氏不完全佐剂乳化;另外3 组作为对照,用等体积PBS 代替菌液。在每次免疫后3 d(即首免后3 d,17 d,31 d)对小鼠进行尾静脉采血,ELISA 方法检测抗体。三免后一周分别用S.suis 2 型GD 株、7 型WH 株、9型ZD 株对小鼠进行腹腔攻毒试验,攻毒剂量为2×107cfu。攻毒后随时观察小鼠的精神状态及死亡情况并记录。
1.6 细菌载量检测 分别在攻毒后第1 d、3 d、5 d对小鼠进行尾静脉采血,梯度稀释后血琼脂平板计数,测定小鼠血液中的细菌载量。对于死亡小鼠无菌条件下剖检并取相同重量的心、肝、脾、肺、肾、脑组织进行研磨,梯度稀释后血琼脂平板计数,测定小鼠各组织脏器中的细菌载量。
1.7 病理组织学观察 小鼠死亡后,分别取心、肝、脾、肺、肾、脑组织置于10 %福尔马林溶液中固定,HE 染色观察各脏器的病理组织学变化。
2 结果
2.1 分离鉴定及毒力因子检测结果 该分离菌在血琼脂平板上呈灰白色、半透明、边缘整齐、光滑圆形菌落,直径约0.5 mm,α 溶血。革兰氏染色镜检可观察到散在排列的革兰氏阳性短链球菌。用API 20 STREP 试验条进行生化试验,反应结果码为4741473,与分析图谱索引比对确定为猪链球菌种。经PCR 鉴定12 株分离菌株gdh 基因均呈阳性,确定为猪链球菌;并且分型鉴定结果均为S.suis 2 型;毒力因子检测结果为Mrp+/Ef+/Sly+(图1)。

表1 本实验所用引物Table 1 Primers used in study list
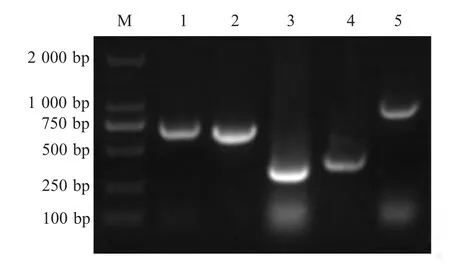
图1 猪链球菌保守引物的PCR 鉴定Fig.1 Identification and classification of S.suis strain by PCR
2.2 MLST分型分析 MLST 分型结果显示,分离自发病猪的12 株分离菌均属于ST1 型,等位基因图谱是1、1、1、1、1、1、1,与高致病性的世界大流行株P1/7 同型。
2.3 抗体检测结果 小鼠在首免后及经2 次加强免疫后抗体水平显著提高,而对照组未产生特异性抗体,差异显著(p<0.05)(图2)。
2.4 免疫保护试验结果 免疫攻毒试验结果显示:对照组小鼠于3 d 内全部发病或死亡;而免疫组小鼠,对GD 株、WH 株和ZD 株攻毒的保护率分别为87.5 %、87.5 %和75 %(表2)。
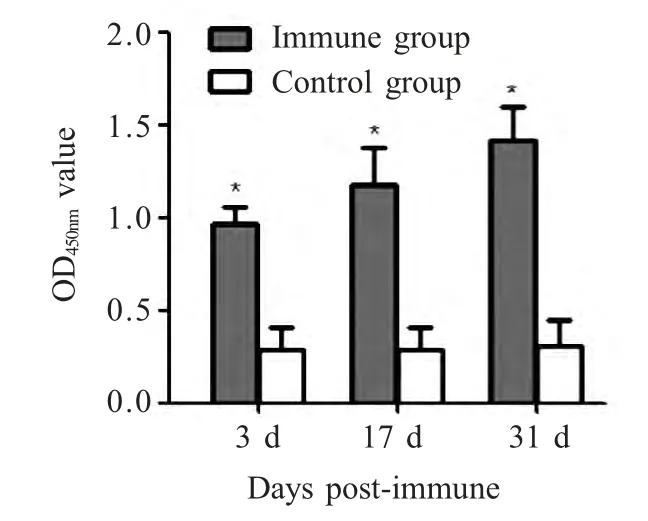
图2 免疫后抗体检测结果*p<0.05Fig.2 Immune response induced by inactivated bacteria in mice
2.5 小鼠血液中的细菌载量测定 攻毒后血液内细菌载量测定结果显示所有免疫组小鼠血液中细菌载量明显低于对照组,感染WH 的免疫组小鼠血液中细菌载量高于GD 株和ZD 株感染的免疫组小鼠,其中感染GD 菌株的免疫组小鼠血液内细菌载量最低(图3)。
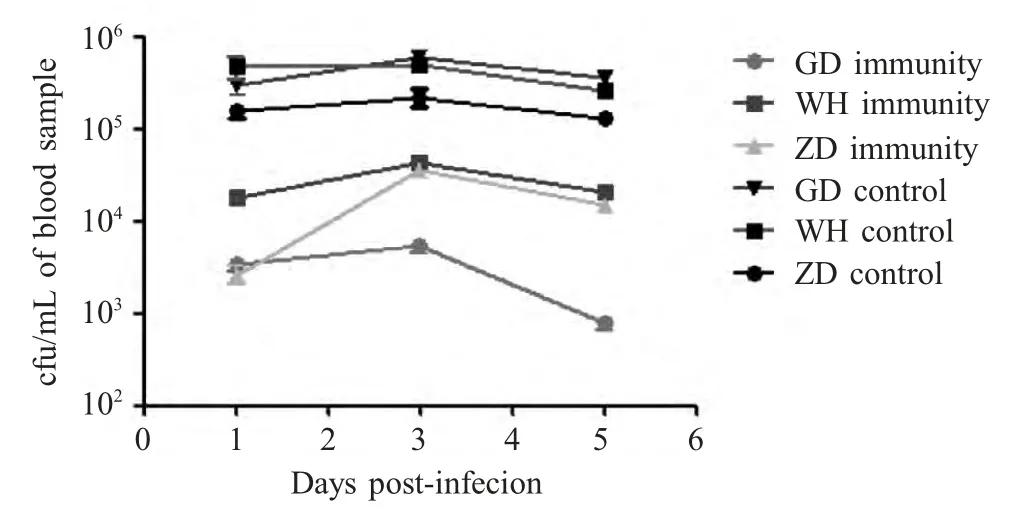
图3 小鼠血液中细菌载量测定Fig.3 Mean numbers of S.suis detected in blood
2.6 小鼠组织脏器中的细菌含量测定 攻毒后脏器内细菌载量测定结果显示,在所有组织脏器中,小鼠肺脏中的含菌量最高,其次是脑,含菌量最少的是心脏,并且所有免疫组小鼠脏器内的细菌含量要明显少于对照组(图4)。
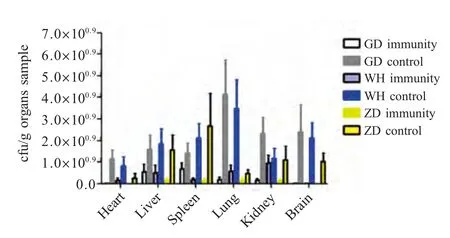
图4 猪链球菌在组织中的含量测定Fig.4 Mean numbers of S.suis detected in organs
2.7 小鼠各脏器的组织学检查 病理切片结果显示小鼠的病理学损伤主要表现为脑膜炎、浆液性肺炎和薄壁组织的心肌炎(图5)。其中经免疫的小鼠心肌纤维均无明显的病理变化,而对照组小鼠呈现化脓性心肌炎,可见有细菌感染;经免疫后的小鼠肺脏基本正常,而对照组小鼠肺脏则有大面积的浆液性肺炎,浸润的细胞以嗜中性粒细胞为主,肺泡壁毛细血管扩张淤血,肺泡隔内有黑褐色颗粒沉着;免疫组小鼠脑组织无明显病理变化,对照组小鼠大脑实质内出现散在出血,及大面积的坏死灶并伴有嗜中性粒细胞浸润。
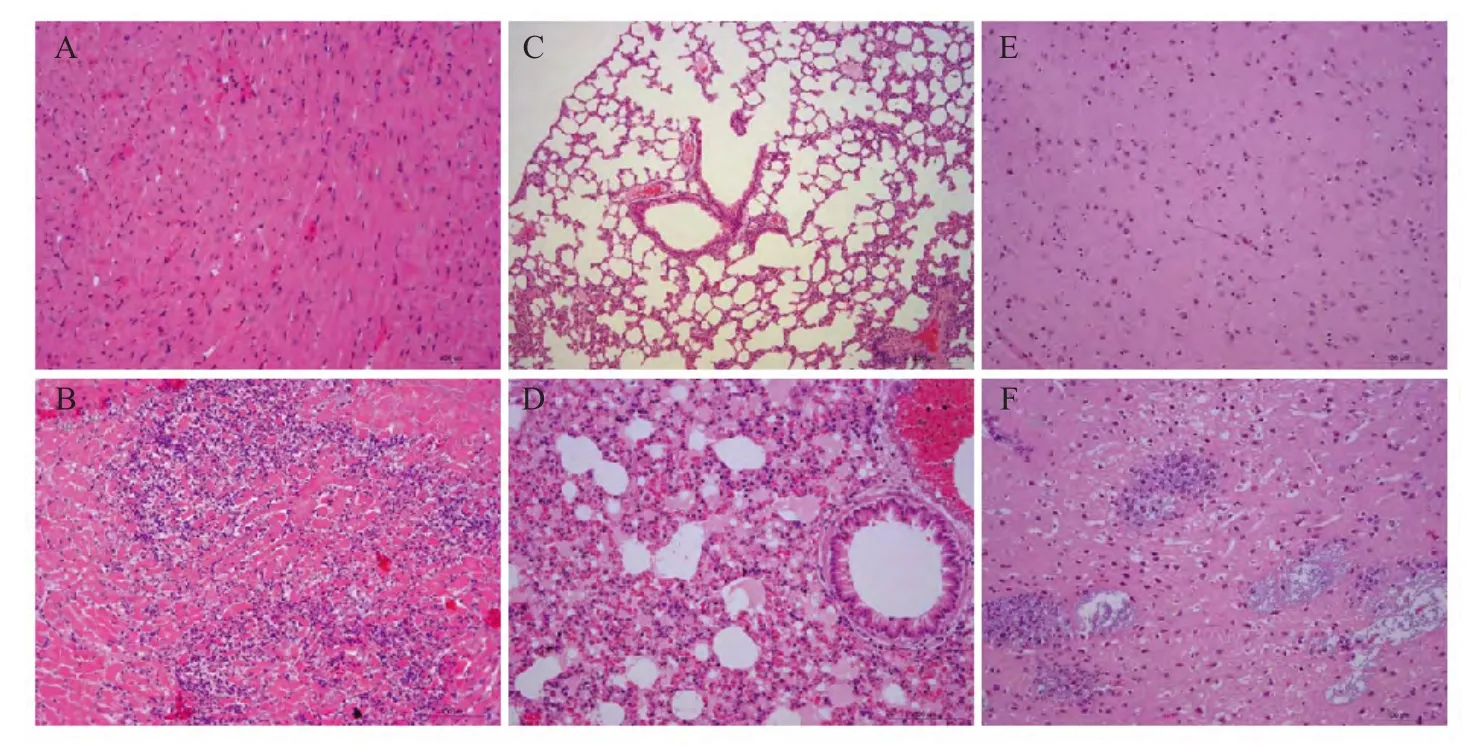
图5 免疫组与对照组小鼠组织病理切片观察(400×,HE)Fig.5 Histopathological section observation immunized group and control group(400×,HE)
3 讨论
通过S.suis ST 型的聚类分析表明,多数ST 型可以归类到4 个ST 复合体中(Sequence type complex)-ST1 复合体、ST27 复合体、ST87 复合体、ST61 复合体。其中ST1 复合体包括ST1~12,ST84,ST86,ST124;ST27 复合体包括ST25~35,ST83,ST101-103;ST87 复合体包括ST12~22,ST87,ST89;ST61 复合体包括ST59、ST61、ST64、ST123、ST125[4]。其中ST1 复合体分布最广,致病性最强,分离株最多,在世界范围内均有报道[5]。本实验室对我国广东省不同地区的12 份病料组织样品进行了分离鉴定及分离株的MLST 分型分析,结果表明,12 株分离株均为S.suis 2 型,MLST 分型为ST1型,表明这12 株分离株属于同一个克隆群,即ST1克隆群。实验结果与叶长芸等对1998 年和2005 年我国南方地区大规模暴发的S.suis 病疫情分离株进行的MLST 分析鉴定和王洪敏等[6]对广州的分离株进行的MLST 鉴定结果相同,表明近年来我国S.suis 的主要流行株的ST 分型仍为ST1 型。
目前,在亚单位疫苗的开发过程中发现,一些针对某蛋白制作的亚单位疫苗,动物免疫后即使可以产生抗体,但并不一定诱导保护作用防止感染,可能是由于地理因素或者针对免疫原所产生的抗体并未对S.suis 起到调理吞噬作用而对动物未产生有效的预防保护作用[7-9],因此全菌疫苗的研制成为研究的热点。本实验选用广东分离株GD 制作疫苗进行免疫,并对其免疫保护效果进行评价,结果显示,经GD 株灭活后免疫的小鼠可有效抵抗同源菌及其他血清型猪链球菌的感染,免疫保护效果较好,提示该菌株可以作为预防S.suis 病的有效疫苗候选分子。
[1]李小军,李旭金,郭丽芬,等.猪链球菌分子生物学检测研究进展[J].广东农业科学,2009,7:208-211.
[2]Wisselink H J,Stockhofe-Zurwieden N,Hilgers L A,et al.Assessment of protective efficacy of live and killed vaccines based on a non-encapsulated mutant of Streptococcus suis serotype 2[J].Vet Microbiol,2002,84(1-2):155-168.
[3]Zhang Wei,Lu Cheng-ping.Immunoproteomics of extracellular proteins of Chinese virulent strains of Streptococcus suis type 2[J].Proteomics,2007,7:4468-4476.
[4]Maiden M C J,Bygraves J A,Feil E,et al.Multilocus sequence typing:a portable approach to the identification of clones within populations of pathogenic microorganisms[J].PNAS USA,1998,95:3140-3145.
[5]Samantha J K,James A L,Peter J H,et al.Development of a multilocus sequence typing scheme for the pig pathogen Strep tococcus suis:identification of virulent clones and potential cap-sular serotype exchange[J].J Clin Microbiol,2002,40(10):3671-3680.
[6]王洪敏,柯昌文,潘武滨,等.2005 年广东省临床分离猪链球菌的MLST 分子分型研究[J].南方医科大学学报,2008,28(8):1438-1441.
[7]Devriese L A,Ceyssens K,Hommez J,et al.Characteristics of different Streptococcus suis ecovars and description of a simplified identification method[J].Vet Microbiol,1991,26(1-2):141-150.
[8]吴立志,沈志强,张松林,等.猪链球菌2 型枯草杆菌素样蛋白酶的截短表达及其免疫保护作用研究[J].中国预防兽医学报,2013,35(6):507-509.
[9]Wang Shu-jie,Jin Jia-min,Liu Yong-gang,et al.Phylogenetic and pathogenetic analysis of Streptococcus suis serotype 7 strain HW07 isolated from diseased pig in China[J].Afr J Microbiol Res,2013,29:406-412.

